◆医药快讯◆
2014-05-30
美国FDA批准生物钟调节药物Tasimelteon上市
美国FDA于2014年1月31日批准Vanda制药公司的Tasimelteon(参考译名:他司美琼,商品名:Hetlioz)胶囊上市,用于治疗非24小时睡眠觉醒障碍。
Tasimelteon为褪黑素 MT1和 MT2受体激动药,确切作用机制尚不明确,MT1和MT2受体与生物周期节律相关。
Tasimelteon用于非24小时睡眠觉醒障碍的有效性已通过两项随机、双盲、安慰剂对照、多中心、平行组试验评估。受试者为全盲的非24小时睡眠觉醒障碍患者,试验通过患者日记记录评估夜间睡眠和日间小睡的时长与时间。试验结果显示,与安慰剂组相比,Tasimelteon可明显改善症状。临床试验中,Tasimelteon与β肾上腺素受体拮抗药合用时,疗效可能减弱。
Tasimelteon最常见的不良反应为头痛、丙氨酸氨基转移酶升高、噩梦、梦境异常、上呼吸道或尿路感染。
(来源:http://www.fda.gov)
美国FDA批准抗肿瘤药Ibrutinib上市
美国FDA近期批准Pharmacyclics公司的Ibrutinib(商品名:Imbruvica)胶囊上市,用于治疗已接受过至少一种疗法治疗的套细胞淋巴瘤(MCL)患者。
Ibrutinib为一种小分子布鲁顿氏酪氨酸激酶(BTK)抑制药,其于BTK活性部位与半胱氨酸残基形成共价键,导致BTK酶活性抑制。BTK为B细胞抗原受体和细胞因子受体通路的信号分子,其在信号传导中的作用为通过B细胞表面受体,激活通路对B细胞交换、趋化及黏附的需求。非临床研究显示,Ibrutinib在体内可抑制恶性B细胞增殖和存活,在体外可抑制细胞转移和底物黏附。
Ibrutinib的安全性及有效性通过一项非盲、多中心、单臂试验证明。试验的首要终末指标为研究者评估的总缓解率(ORR)。试验结果显示,ORR为65.8%,外部独立审查委员会(IRC)复审的 ORR为69%。中位缓解时间为1.9个月。有33%患者出现一过性淋巴细胞计数增加。
试验中最常见的不良反应有血小板减少、腹泻、中性粒细胞减少、贫血、疲劳、肌肉骨骼痛、外周水肿、上呼吸道感染、恶心、瘀伤、呼吸困难、皮疹、腹痛、呕吐、食欲减退。
(来源:http://www.fda.gov)
美国FDA批准抗菌药物卢立康唑上市
美国FDA近期批准Medicis公司的卢立康唑(通用名:Luliconazole, 商品名:Luzu)1%外用乳膏上市,用于局部治疗18岁及以上患者因红色毛癣菌和絮状表皮癣菌引起的趾间足癣、股癣及体癣。
卢立康唑为唑类抗真菌药,其用于皮肤癣菌的确切机制尚不明确,但其通过抑制羊毛甾醇脱甲基酶似可抑制麦角固醇(真菌细胞膜的组成部分,也是羊毛甾醇的对应累积产物)合成,致麦角固醇数量减少。
卢立康唑作用于趾间足癣的安全性和有效性通过2项随机、多中心、双盲、媒介对照试验证明。用于股癣的安全性和有效性通过1项随机、多中心、双盲、媒介对照试验证明。治疗完全成功以完全清除(趾间足癣4周,股癣3周)定义。
试验结果显示,用于趾间足癣的2项试验中,达完全清除的受试者比例分别为26%和14%,达有效治疗的比例分别为48%和33%,临床治愈的比例分别为29%和15%,真菌学治愈比例分别为62%和56%。用于股癣的试验中,达完全清除的受试者比例为21%,有效治疗比例为43%,临床治愈比例为24%,真菌学治愈比例为78%。
卢立康唑安全性较好,多为轻度不良反应,最常见的不良反应为用药部位反应。
(来源:http://www.fda.gov)
Eluxadoline用于腹泻型肠易激综合征的两项Ⅲ期临床试验达首要终末指标
美国Furiex制药公司于2014年2月4日宣布,其药物Eluxadoline用于腹泻型肠易激综合征(IBS-d)的两项Ⅲ期临床试验达首要终末指标。
Eluxadoline为在研口服药物,具有μ型阿片受体激动和δ阿片受体拮抗活性,其主要在肠道起效,口服生物利用度低。其双重阿片活性可用于治疗IBS-d腹泻和疼痛症状且不引起μ型阿片激动药所致便秘。
两项试验(3001、3002)皆为随机、双盲、安慰剂对照试验。试验的首要疗效终末指标为复合指标,评估最初12周(美国食品药品监督管理局要求)和26周(欧洲药品审评局要求)的治疗反应。反应率比较依据的是1~12周和1~26周一半及以上天数达到每日复合反应标准 (对疼痛和粪便硬度的改善)的患者数。
两项试验在首要联合和部分次要终末指标上皆显示统计学上显著的高反应率,具体试验数据如表1所示。
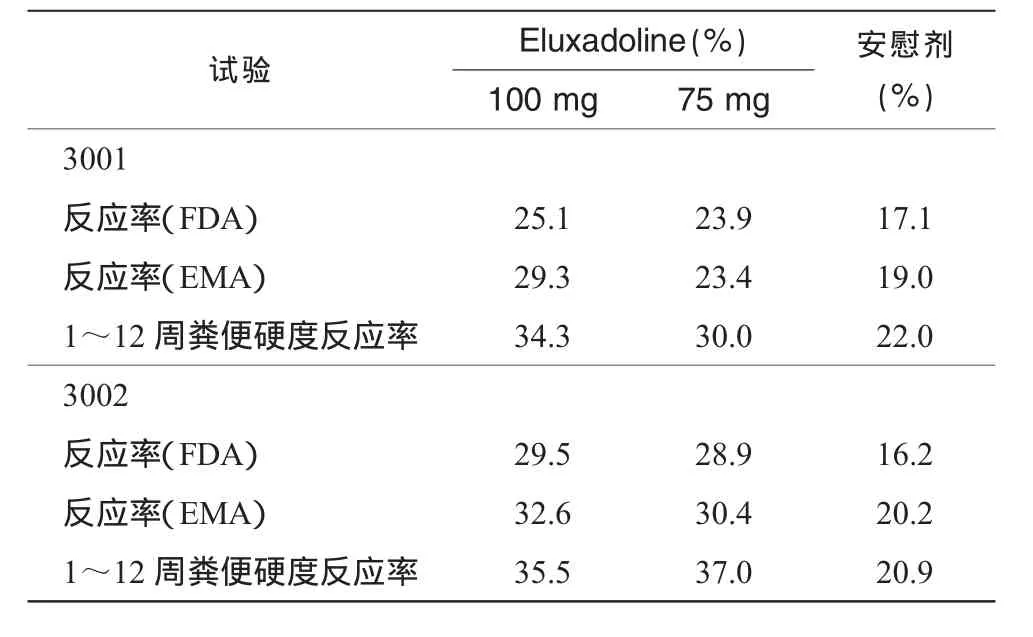
表1 两项试验终末指标的比较
两项试验中,Eluxadoline100mg组1~12周疼痛数值也有改善,但尚未达到统计学上显著差异。两项试验中,Eluxadoline显示较好耐受性,最常见的副作用为便秘、恶心。
(来源:http://www.drugs.com)
欧洲药品评审局批准降糖药Dapagliflozin/Metformin上市
欧洲药品评审局 (EMA)于2014年1月16日批准阿斯利康(Astrazeneca)公司和百时美施贵 宝(Bristol Myers Squibb)的 Dapagliflozin/Metformin(参考译名:达格列净-二甲双胍,商品名:Xigduo)片剂上市,作为饮食和运动的辅助疗法,用于18岁及以上2型糖尿病患者提高血糖控制能力。
用药患者应为单用最大耐受量的二甲双胍或二甲双胍与其他降糖药合用仍不能充分控制血糖者,或为已接受达格列净和二甲双胍单独片剂联合治疗者。
Dapagliflozin/Metformin包含两种降糖药:达格列净和盐酸二甲双胍。达格列净为高效、选择性、可逆性Ⅱ型钠葡萄糖协同转运体(SGLT2)抑制药;盐酸二甲双胍具有降糖作用,可同时降低基础血糖和餐后血糖。以上两种药物作用机制不同但互补。
与单用达格列净与盐酸二甲双胍相比,联用未见额外的不良反应。
(来源:http://www.ema.europa.eu)
抗菌药物Ceftolozane/Tazobactam与甲硝唑合用于复杂性腹腔内感染的Ⅲ期临床试验取得满意成果
美国Cubist公司于2013年12月16日宣布,其抗菌药物Ceftolozane/Tazobactam与甲硝唑合用于复杂性腹腔内感染的Ⅲ期临床试验取得满意成果。
Ceftolozane/Tazobactam包含 2种成分:Ceftolozane为新型头孢菌素,与当前头孢菌素相比,在体外显示对绿脓假单胞菌的强效抗性;Tazobactam(中文通用名:三唑巴坦)为β-内酰胺酶抑制药。Ceftolozane与Tazobactam合用可扩大覆盖产生超广谱β-内酰胺酶的细菌的范围。
本项试验成果源自2项多中心、全球性、随机、双盲试验。试验旨在确定复杂性腹腔内感染患者使用Ceftolozane/Tazobactam(与甲硝唑合用)和美罗培南(通用名:Meropenem)相比的安全性及有效性。试验的首要终末指标为初次用药后26~30日随访时,美国FDA和欧洲药品审评局(EMA)定义的Ceftolozane/Tazobactam与美罗培南非劣效性标准。FDA定义为治愈测试(TOC)达临床治愈的微生物学意向治疗(MITT)人群患者比例,EMA定义为临床可评估人群患者比例。
试验结果显示,Ceftolozane/Tazobactam与美罗培南非相比,具有显著的非劣效性,达首要终末指标。二级分析结果亦支持主要结果。
试验中最常见的不良事件为恶心、腹泻、发热、失眠、呕吐。
(来源:http://www.drugs.com)
