229例梅毒患者临床和脑脊液分析
2014-05-28王向东刘继峰裘新民刘克敏叶喻剑陈俊帆许爱娥
瞿 镔,王向东,刘继峰,裘新民,刘克敏,沈 琳,叶喻剑,陈俊帆,许爱娥
(浙江省杭州市第三人民医院,杭州310009)
一期或二期梅毒患者经正规驱梅治疗后6个月,甲苯胺红不加热血清试验(TRUST)滴度不能下降4倍,排除再感染,提示治疗失败[1]。推测与中枢神经系统受累、机体免疫功能异常、人免疫缺陷病毒(HIV)感染或未及早治疗有关。梅毒的任何阶段都有可能发生中枢神经病变,其临床表现复杂多变,常不典型或无症状,未经治疗或感染持续存在可发生脑实质的改变[2]。门诊经治疗后TRUST滴度长期不下降的梅毒患者许多是体检发现,病期不明的潜伏梅毒,为了早发现,早治疗,我们把驱梅治疗后观察TRUST滴度是否下降4倍的时间定为6个月,排除再感染,初次血清 TRUST 滴度≥1∶4,TRUST滴度下降低于4倍或再升高的患者行腰穿取脑脊液检查。
1 资料与方法
1.1临床资料 229例梅毒患者来自2011年7月—2013年6月本院皮肤科性病门诊,否认其他神经系统疾病,血TRUST和TPPA阳性,均曾按治疗指南应用长效青霉素或普鲁卡因青霉素驱梅治疗至少1个疗程,治疗后6个月TRUST滴度不能下降4倍或升高,排除再感染。记录其临床资料,同时采集其脑脊液标本,所有患者检查前均已获知情同意。
1.2方法
1.2.1标本采集 常规腰穿,用无菌试管接取7 mL脑脊液,分别做脑脊液常规、生化、TRUST、TPPA、19S-IgM TPPA、VDRL、FTA-ABS检查。IgG 指数=(脑脊液IgG/血清IgG)/(脑脊液白蛋白/血清白蛋白)。同一天抽取患者静脉血5 mL,予血CD4+T细胞、血TRUST、TPPA、HIV、乙型肝炎病毒和丙型肝炎病毒检查。确诊神经梅毒患者行头颅核磁共振(MRI)或计算机断层扫描(CT)、眼科和耳鼻喉科检查、脑电图和精神心理卫生测试。
1.2.2主要试剂和方法 TRUST试剂盒购自上海荣盛生物技术有限公司;TPPA试剂盒购自日本富士株式会社;VDRL试剂盒、淋巴细胞亚群均由美国BD公司生产;FTA-ABS试剂盒由爱尔兰Trinity Biotech PLC生产。检测参照试剂说明书和操作规程进行。
1.2.3数据分析 所有数据采用STATA12专业统计软件进行数据分析处理,所得数据计量资料均以±s表示,两样本均数间比较用t检验,多组之间均数比较采用方差分析。计数资料采用卡方检验,等级资料相关分析采用秩相关分析。P<0.05认为差异具有统计学意义。
2结果
2.1患者一般情况 229例患者平均(36.03±12.48)岁,以21~50岁性活跃人群为主,占82.09%,见表1。有35例确诊为神经梅毒,平均(47.13±11.92)岁;非神经梅毒组194例,平均(34.08±11.55)岁,2组平均年龄差异有统计学意义(t=-6.06,P=0.000)。神经梅毒组男23例,女12例;非神经梅毒组男47例,女147例。2组性别差异有统计学意义(χ2=24.05,P=0.00)。神经梅毒组以男性患者为主;非神经梅毒组以女性患者为主。同性恋10例。酗酒3例,吸毒3例。合并疾病:结核病3例,甲状腺炎10例,红斑狼疮5例,乙肝41例,丙肝2例,糖尿病4例,荨麻疹5例,血液系统异常10例。新生儿梅毒2例,流产和死胎6例,不孕不育18例。
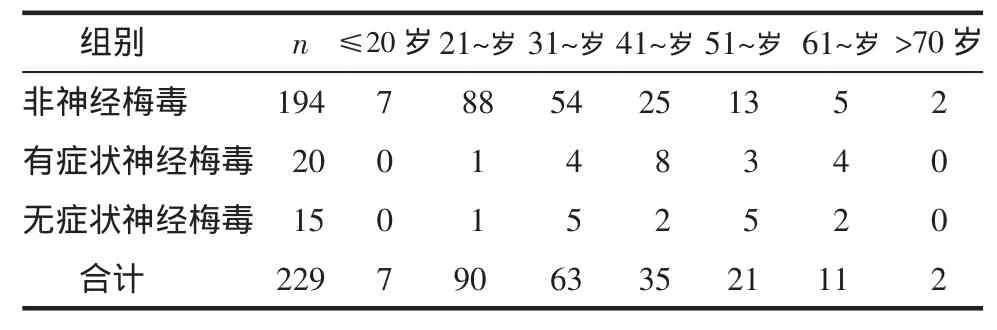
表1 不同感染组年龄分布情况 例
2.2神经梅毒分型 有症状神经梅毒20例,无症状神经梅毒15例。有症状神经梅毒:麻痹性痴呆5例,脑膜血管梅毒8例,视神经梅毒2例,脊髓痨3例,心血管和脑膜血管梅毒1例,胃肠危象1例。脑电图异常15例。MRI和CT检查两侧脑室旁、颞顶叶缺血样病灶4例,脑萎缩1例,双颞顶叶异常信号灶2例。多发性脑梗死伴升主动脉夹层伴假腔血栓形成,主动脉关闭不全1例,肝功能异常2例。
2.3实验室检查
2.3.1外周血CD4+T淋巴细胞计数 神经梅毒组(683.59±230.35)×106/L,非神经梅毒组(753.21±268.63)×106/L,差异无统计学意义(t=1.42,P=0.15)。
2.3.2脑脊液白细胞计数 神经梅毒组脑脊液白细胞计数(13.37±27.84)×106/L,非神经梅毒组(2.13±4.72)×106/L,差异有统计学意义(t=-5.25,P=0.00)。
2.3.3脑脊液蛋白定量 神经梅毒组(50.57±32.83)g/mL,非神经梅毒组(26.52±30.87)g/mL,差异有统计学意义(t=-4.20,P=0.00)。
2.3.4脑脊液IgG指数 神经梅毒组(1.86±1.11)(正常值 0.30~0.77),非神经梅毒组:(0.54±0.21),差异有统计学意义(t=-15.37,P=0.00)。
2.3.5HIV阳性6例
2.3.6初次血TRUST滴度与神经梅毒关系 见表2。
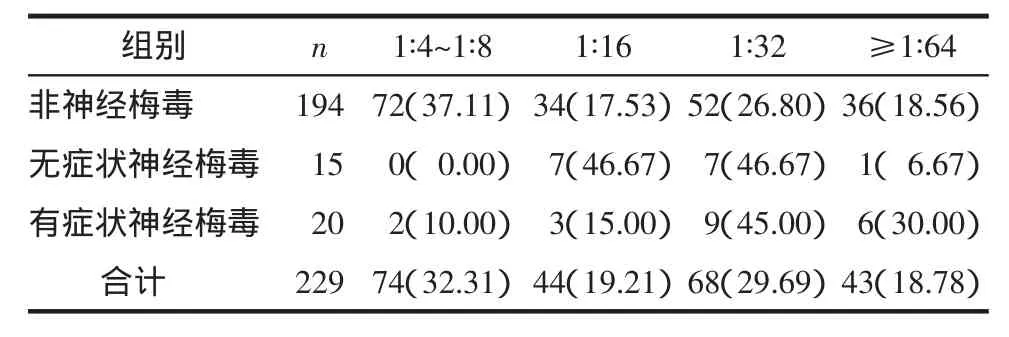
表2 3组患者初次血清RPR滴度比较 例(%)
2.3.7脑脊液梅毒抗体检查 以VDRL为金标准,计算另外4个实验室指标的敏感性和特异性,阳性预测值和阴性预测值。见表3、4。
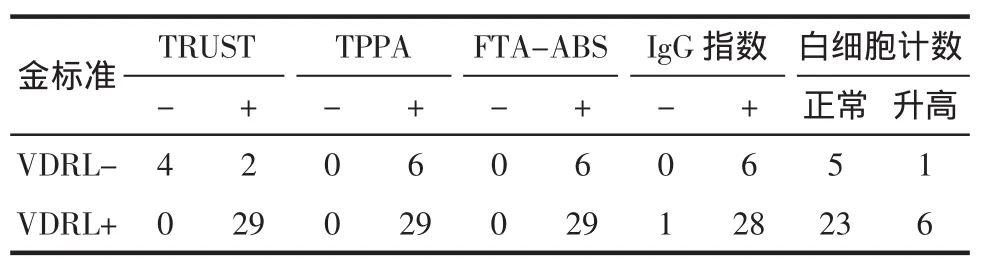
表3 35例神经梅毒患者脑脊液试验结果 例

表4 4个实验室指标的敏感性和特异性,阳性预测值和阴性预测值 (%)
3 讨论
神经梅毒患者符合神经梅毒诊断标准[3]:⑴无其他已知原因所致的符合神经梅毒的临床症状和体征;⑵非梅毒螺旋体抗原血清学试验:阳性。梅毒螺旋体抗原血清学试验:阳性。⑶脑脊液检查:白细胞计数≥10×106/L,蛋白量>500 mg/L,且无其他引起这些异常的原因。⑷脑脊液VDRL试验或FTA-ABS试验阳性。无条件做后两项试验时,可行RPR或TPPA试验。无症状神经梅毒指无任何神经系统症状和体征,梅毒血清学试验阳性并存在脑脊液实验室检查异常,且无其他引起这些异常的原因[3]。在对229例治疗半年后TRUST滴度下降小于4倍或升高的梅毒患者进行脑脊液检查后发现35例神经梅毒,检出率是15.28%。提示及时的脑脊液检查可以减少神经梅毒的漏诊率。
虽然许多梅毒患者中枢神经系统被梅毒螺旋体侵犯,但并非所有患者均发生脑脊液异常或神经梅毒,神经梅毒患者在不同的临床阶段,免疫应答反应不同,其原因尚不清楚。Marra等[4]利用梅毒动物模型发现系统感染梅毒螺旋体后脑脊液出现白细胞升高,8周后下降,与之伴随的是CD4+T淋巴细胞和γ-干扰素升高。有学者报道神经梅毒患者脑脊液白细胞计数升高占82.7%[5],而我们35例神经梅毒患者白细胞计数升高者仅占20%(7/35),在神经梅毒感染早期或急性活动期白细胞可明显升高,而我们的患者大部分病程不明并曾按潜伏梅毒治疗数次。脑脊液蛋白定量和IgG指数升高2组之间有差异,但在正常人,脑脊液蛋白定量随着年龄增加升高,大于65岁,脑脊液蛋白定量>60 g/mL也不认为一定是异常[6]。同时神经梅毒组比非神经梅毒组平均年龄要大,我们检测结果脑脊液IgG指数敏感性100%、特异性0%,因此诊断神经梅毒,脑脊液蛋白定量和IgG指数升高要排除其他神经系统疾病,结合脑脊液其他检查和年龄分析才有意义。免疫状态影响TRUST滴度的下降,我们回顾资料发现部分患者伴HIV感染和自身免疫病。HIV抗病毒治疗可以提高梅毒治疗效果[7]。HIV患者CD4+T≤350×106/L和(或)TRUST≥1∶32增加神经梅毒患病率[8]。我们的试验发现初次血TRUST滴度≥1∶16,神经梅毒患病率升高,初次血 TRUST 滴度 1∶4~1∶8,以潜伏梅毒为主。
神经梅毒的临床表现无特异性,迄今尚无诊断神经梅毒的“金标准”。神经梅毒的确诊不能仅凭某一项试验,VDRL检测类脂成份,当梅毒抗体数量充足时,VDRL阳性,有时即使有神经梅毒存在,在感染早期人体产生抗类脂抗原的抗体不足,脑脊液VDRL也可阴性,因此脑脊液的VDRL特异性高,但敏感性低。我们检测脑脊液VDRL阳性率82.86%,但1例患者第一次检测时脑脊液白细胞计数、蛋白定量和IgG指数明显升高,但VDRL阴性,按神经梅毒治疗3个月后复查脑脊液,炎性指标好转,但VDRL和TRUST出现阳性,滴度都为1∶1。这例患者早期脑脊液标本刚好采集到,梅毒螺旋体早期感染中枢神经系统如何发生炎症反应,还有待进一步随访检测更多患者。有学者研究认为:CSF-TRUST可以作为CSF-VDRL的替代方法[9];而Marra等[10]实验发现脑脊液RPR有更高的假阴性。我们所发现的神经梅毒病例中脑脊液TRUST阳性率88.57%,VDRL阳性率82.86%,FTA-ABS阳性率100%,TPPA阳性率100%,IgG指数阳性率97.14%,白细胞升高阳性率20%。TPPA与FTA-ABS敏感性和特异性一致,与文献报道类似[5]。VDRL检测阳性率与TRUST接近,可能与我们选取的患者病期不明,晚期神经梅毒患者比例高相关。推测在神经梅毒晚期两种试验结果可能一致。神经梅毒组FTA-ABS、TPPA和IgG指数敏感性高,在我们的使用中也证实了此点。脑脊液VDRL阳性更适合确诊神经梅毒,阴性不能排除神经梅毒[11],脑脊液FTA-ABS试验阴性可用来排除神经梅毒,综合考虑其他检测指标可以早诊断早治疗,及时随访。
[1]Centers for Disease Control and Prevention.Sexually transmitted diseases treatment guidelines 2010[S].2010:58.
[2]Hook EW 3rd,Peeling RW.Syphilis control--a continuing challenge[J].N Engl J Med,2004,351:122-124.
[3]卫生部疾病控制司.性病诊疗规范(试行)及性病治疗推荐方案[S].2006年8月.
[4]Marra CM,Castro CD,Kuller L,et al.Mechanisms of clearance of Treponema pallidum from the CSF in a nonhuman primate model[J].Neurology,1998,51:957-961.
[5]Luger AF,Schmidt BL,Kaulich M.Significance of laboratory findings for the diagnosis of neurosyphilis[J].Int J STD AIDS,2000,11:224-234.
[6]Rice EW,Singer WH.Total proteins in cerebrospinal fluid(Turbidimetric)[J].Stand Meth Clin Chem,1965,5:231-236.
[7]Ghanem KG,Moore RD,Rompalo AM,et al.Antiretroviral therapy is associated with reduced serologic failure rates for syphilis among HIV-infected patients[J].Clin Infect Dis,2008,47:258-265.
[8]Marra CM,Maxwell CL,Smith SL,et al.Cerebrospinal fluid abnormalities in patients with syphilis:association with clinial and laboratory features[J].J Infect Dis,2004,189:369-376.
[9]Castro R,Prieto ES,da Luz Martins Pereira F.Nontreponemal tests in the diagnosis of neurosyphilis:an evaluation of the Venereal Disease Research Laboratory(VDRL)and the Rapid Plasma Reagin(RPR)tests[J].J Clin Lab Anal,2008,22:257-261.
[10]Marra CM,Tantalo LC,Maxwell CL,et al.The rapid plasma reagin test cannot replace the venereal disease research laboratory test for neurosyphilis diagnosis[J].Sex Transm Dis,2012,39:453-457.
[11]Dans PE,Cafferty L,Otter SE,et al.Inappropriate use of the cerebrospinal fluid Venereal Disease Research Laboratory(VDRL)test to exclude neurosyphilis[J].Ann Intern Med,1 986,104:86-89.
