溶菌酶稳定的银纳米粒子的合成及稳定性研究
2014-05-25赵亚利杨涛张英高红云席亚楠
赵亚利,杨涛,张英,高红云,席亚楠
(河北大学化学与环境科学学院,河北 保定 071002)
·基础研究·
溶菌酶稳定的银纳米粒子的合成及稳定性研究
赵亚利,杨涛,张英,高红云,席亚楠
(河北大学化学与环境科学学院,河北 保定 071002)
目的 使用蛋白质做稳定剂来合成银纳米粒子,并探讨其稳定性,为其在生物医学领域及日常生活中的应用提供理论指导。 方法 采用化学还原法一步合成溶菌酶稳定的银纳米粒子,改变稳定性影响因素并观察银纳米溶胶的变化。即加入不同浓度的氯化钠来改变银纳米溶胶的离子强度,用酸或碱来调节溶胶pH,对溶胶进行多次冷冻-解冻循环。并且用柠檬酸稳定的银纳米粒子做对照试验。 结果 溶菌酶稳定的银纳米粒子对离子强度的变化比较敏感,在10 mmol/L NaCl条件下完全沉淀;在酸性条件下能够稳定存在(pH≤6);冷冻-解冻循环对其稳定性影响比较小。 结论 溶菌酶稳定的银纳米粒子的稳定性受周围环境影响较大,在使用及储存时需要加以注意。
银纳米粒子;溶菌酶;稳定性
随着纳米技术的不断发展,纳米粒子在生物医学领域及人们日常生活中的应用越来越广泛[1]。银纳米粒子具有很强的抗菌抗病毒性能,对常见细菌(如大肠杆菌、白色念珠菌、金黄色葡萄球菌以及其他革兰氏阳性菌、革兰氏阴性菌等[2])以及HBV[3]、HIV[4]等都有良好的抑制效果,并且银纳米粒子属于非抗生素类杀菌剂,无耐药性,因此含有银纳米粒子医疗器械的应用越来越广泛,如抗菌导管、敷料、宫内节育器等[5-7]。合成银纳米粒子成为研究者们的兴趣所在。银纳米粒子的合成方法有光化学法[8]、电化学法[9]、热化学法[10]、化学还原法[11]、生物化学法[12]等,其中通过还原金属盐制备金属纳米粒子是比较简单、常用的方法。银纳米粒子具有很高的表面能,很容易聚集,通常需要加入稳定剂来获得分散性良好的银纳米粒子胶体溶液[13]。溶菌酶是一种常见的蛋白质,在医学上可作为一种天然抗感染物质,具有抗菌、消炎、抗病毒等作用,临床上可用于慢性鼻炎、急慢性咽喉炎、口腔溃疡、水痘、带状疱疹和扁平疣等的治疗[14]。多种细胞及分泌物中均含有溶菌酶,如胎盘、脾脏、唾液、血浆、尿、乳汁等体液以及蛋清、牛奶、微生物等[15]。已经有文献报道过利用蛋清溶菌酶作为还原剂,在甲醇溶液中合成具有抗菌活性的银纳米粒子[16],但是合成条件需要较长时间的光照射,而且银纳米粒子转移到水溶液中的过程较繁琐。在此,使用溶菌酶做稳定剂,通过硼氢化钠还原硝酸银,方便快捷地制得了溶菌酶稳定的银纳米粒子胶体溶液。溶菌酶的存在增强了银纳米粒子的稳定性,而溶菌酶作为生物分子,与银纳米粒子相结合有可能会提高银纳米粒子的生物相容性。溶菌酶的量对银纳米粒子的稳定性有显著影响。此外,一些与银纳米粒子的使用或储存等相关的常见因素,如离子强度、pH以及冷冻-解冻循环等,对银纳米粒子的稳定性也有不同程度的影响,稳定性实验中用柠檬酸稳定的银纳米粒子做对照。对银纳米粒子稳定性的研究有助于扩大其在生物医学领域以及人们日常生活中的应用。
1 材料与方法
1.1 试剂
硝酸银(AgNO3)、硼氢化钠(NaBH4)和3-氨丙基三乙氧基硅烷(APTES)购自百灵威科技有限公司。鸡蛋白溶菌酶(冻干粉末)购自Sigma公司。柠檬酸三钠、氯化钠、氢氧化钠、盐酸均为分析纯试剂。实验所用水为Milli-Q体系纯化的超纯水(>18.0 MΩ)。
1.2 仪器设备
原子力显微镜(AFM)成像使用美国Agilent公司的5500型扫描探针显微镜,在室温大气环境下采用AC模式进行,扫描速度为1.0 line/s,AFM图像经过二阶平滑处理。紫外-可见吸收光谱测试在日本岛津UV-2550分光光度计上进行。实验中的照片使用SAMSUNG数码相机拍摄。
1.3 银纳米粒子的合成
溶菌酶稳定的银纳米粒子的合成方法如下:(1)10 mL 0.2 mmol/L溶菌酶与200 μL 10 mmol/L AgNO3溶液混合均匀(Ag+与溶菌酶摩尔比为1∶1),在剧烈搅拌下逐滴加入80 μL 100 mmol/L NaBH4溶液。制得银纳米胶体溶液(A)。(2)保持AgNO3的量不变,将Ag+与溶菌酶摩尔比变为5∶1,制备银纳米胶体溶液(B)。
通过改进Jana报道的合成银晶种的方法[17]来制备柠檬酸稳定的银纳米粒子胶体溶液,具体步骤为:9.5 mL H2O与250 μL 10 mmol/L 柠檬酸三钠、250 μL 10 mmol/L AgNO3混合均匀,在剧烈搅拌下逐滴加入300 μL 10 mmol/L NaBH4溶液,搅拌30 s后停止。
1.4 稳定性影响实验
1.4.1 离子强度影响
向1 mL银纳米溶胶中加入200 μL不同浓度的NaCl溶液,混合均匀,4 ℃下储存,24 h后观察现象。
1.4.2 pH影响
制备好的溶菌酶稳定的和柠檬酸稳定的银纳米溶胶的pH均约为6。将等体积不同浓度的HCl或NaOH溶液加入到银纳米溶胶中,调节其pH值,观察pH变化对银纳米溶胶稳定性的影响。
1.4.3 冷冻-解冻循环影响
各取1 mL制备好的银纳米溶胶于2 mL离心管中,在-20 ℃下冷冻1 h,然后在室温下解冻,此为冷冻-解冻循环1次。溶菌酶稳定的银纳米溶胶的冷冻-解冻循环次数分别为1、2、5、8和10次;柠檬酸稳定的银纳米溶胶的冷冻-解冻次数分别为1、2、3、4和5次。
1.5 原子力显微镜(AFM)表征实验的样品制备
将溶菌酶稳定的银纳米粒子胶体溶液稀释一倍,取50 μL滴加到新解离的云母片上,30 min后用超纯水清洗云母表面3次,在室温下干燥器内充分干燥。制备柠檬酸稳定的银纳米粒子的AFM表征样品时,首先将云母片进行APTES功能化,即滴加15 μL 0.05 % (V/V)的APTES到新解离的云母表面上,10 min后用超纯水清洗表面3次,再用N2吹干。将柠檬酸稳定的银纳米胶体溶液稀释两倍,然后将APTES功能化的云母片浸泡到1 mL该溶液中,30 min后用超纯水清洗3次,在室温下干燥器内充分干燥。
2 结果
2.1 银纳米粒子的表征
Ag+与溶菌酶初始摩尔比为1∶1时,经过NaBH4还原得到的是棕黄色澄清银纳米粒子胶体溶液(A),而当初始摩尔比变为5∶1时,得到的灰绿色银纳米粒子溶液(B)在5 min内完全沉淀。溶液(A)的等离子体共振吸收峰在414 nm处,溶液(B)的上清液吸光度为零,如图1所示。制备的溶菌酶稳定的银纳米粒子为球形颗粒,分布较均匀,平均粒径为(2.51±0.67) nm,如图2所示。Ag+与柠檬酸三钠的初始摩尔比为1∶1时,制得的柠檬酸稳定的银纳米溶胶为金黄色澄清溶液,等离子体共振吸收峰在392 nm处。如图3所示。柠檬酸稳定的银纳米粒子也为球形颗粒,平均粒径为(6.02±1.42) nm。如图4所示。
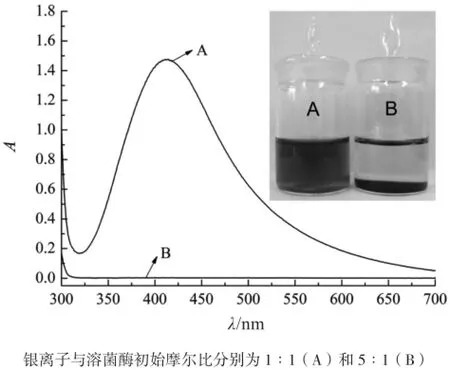
图1 溶菌酶稳定的银纳米粒子的照片及紫外-可见吸收光谱
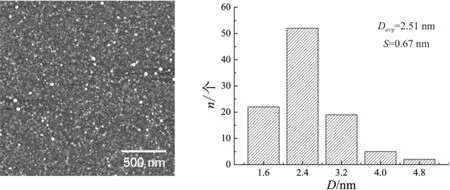
图2 溶菌酶稳定的银纳米粒子的AFM图及粒径统计
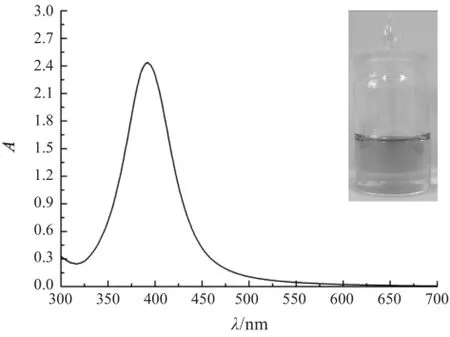
图3 柠檬酸稳定的银纳米粒子的照片及紫外-可见吸收光谱

图4 柠檬酸稳定的银纳米粒子的AFM图及粒径统计
2.2 离子强度对银纳米粒子稳定性的影响
溶菌酶稳定的银纳米溶胶中加入10 mmol/L NaCl后,在24 h内完全沉淀,溶胶颜色从棕黄色变为无色,紫外-可见吸收光谱显示,吸光度从1.25降为0.07,进一步证明澄清的上清液中几乎已经没有银纳米粒子存在。而柠檬酸稳定的银纳米溶胶颜色随NaCl浓度的增加逐渐变浅直至无色,吸光度随之逐渐降低,最大吸收波长略微红移。当NaCl浓度增加到40 mmol/L时,银纳米粒子完全从溶液中沉降出来,上清液澄清透明,吸光度为零。如图5所示。
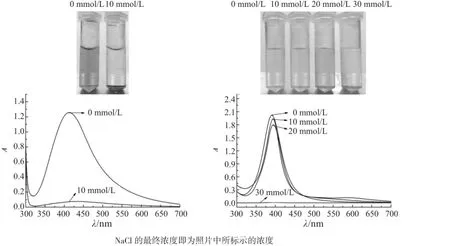
图5 不同NaCl浓度对溶菌酶稳定的银纳米粒子(左)和柠檬酸稳定的银纳米粒子(右)稳定性影响的照片及紫外-可见吸收光谱
2.3 pH对银纳米粒子稳定性的影响
在酸性条件下,溶菌酶稳定的银纳米溶胶的颜色仍为棕黄色且溶液的分散状态几乎没有变化。pH 7~9完全沉淀,而pH 10~11胶体溶液在外观上与原始溶液没有明显差别,但相应的吸光度有所下降。当pH≥12时,胶体溶液的颜色明显变浅,呈灰色,吸光度几乎为零。柠檬酸稳定的银纳米溶胶的pH约为6,随着酸度的增加,溶胶颜色逐渐变浅,吸光度逐渐降低直至为零。而pH 7~12溶液颜色比初始状态更加明显,呈亮金黄色,紫外-可见吸收光谱曲线几乎重合,吸光度有所增大且最大吸收波长略微红移。如图6所示。
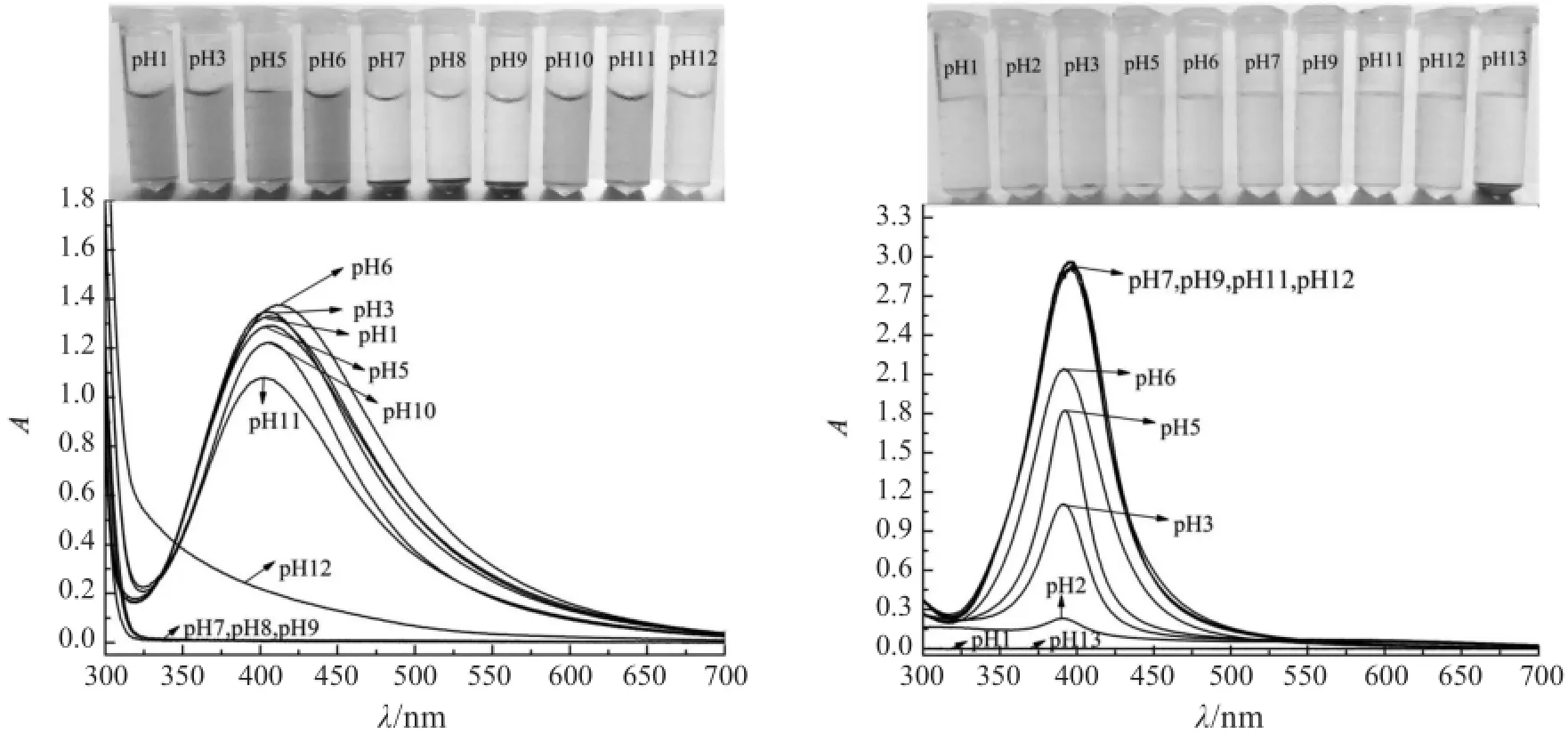
图6 不同pH条件下溶菌酶稳定的银纳米粒子(左)和柠檬酸稳定的银纳米粒子(右)的照片及紫外-可见吸收光谱
2.4 冷冻-解冻循环对银纳米粒子稳定性的影响
经过多次冷冻-解冻循环后,溶菌酶稳定的银纳米溶胶仍为棕黄色澄清溶液,而紫外-可见吸收光谱显示,随着冷冻-解冻循环次数的增加,银纳米粒子的吸光度有逐渐降低趋势。柠檬酸根稳定的银纳米粒子,经过1次冷冻-解冻循环后,溶液颜色从金黄色立即变成橙黄色,随着循环次数的增多,溶胶颜色渐变成橙红色、浅红色并趋向灰色。紫外-可见吸收光谱显示,银纳米粒子的吸光度随着冷冻-解冻循环次数的增加而快速降低。如图7所示。

图7 不同冷冻-解冻循环次数对溶菌酶稳定的银纳米粒子(左)和柠檬酸稳定的银纳米粒子(右)稳定性影响的照片及紫外-可见吸收光谱
3 讨论
本文首次使用溶菌酶作为稳定剂,通过NaBH4还原成功制备了分散性良好的银纳米粒子胶体溶液。实验结果显示减少稳定剂用量后得到的银纳米溶胶不能稳定存在,说明稳定剂的量对胶体溶液的稳定性至关重要。实验使用最常用稳定剂——柠檬酸三钠,来对比溶菌酶对银纳米粒子的稳定效果。对于粒径小于25 nm的银纳米粒子,由于内在尺寸效应,纳米粒子的增大会引起SPR峰的蓝移[7,18],因此比较图1与图3的紫外-可见吸收光谱曲线,可以推测柠檬酸稳定的银纳米粒子的粒径比溶菌酶稳定的银纳米粒子的粒径要大。结果显示柠檬酸稳定的银纳米粒子的平均粒径比溶菌酶稳定的银纳米粒子的平均粒径大3.51 nm左右,与紫外-可见吸收光谱数据相符。比较图2与图4,可以看出,溶菌酶稳定的银纳米粒子比柠檬酸稳定的银纳米粒子的粒径分布更窄,尺寸更加均匀。因此,溶菌酶不仅可以有效地稳定银纳米粒子,而且比传统稳定剂(柠檬酸)有更强的控制银纳米粒子尺寸的能力。
溶菌酶稳定的银纳米粒子在10 mmol/L NaCl条件下完全沉淀,而柠檬酸稳定的银纳米粒子在30 mmol/L范围内溶胶状态变化不大,由此可见,溶菌酶稳定的银纳米粒子对离子强度变化的忍耐能力不如柠檬酸稳定的银纳米粒子强。NaCl对银纳米粒子的沉降机理可能与不同的稳定剂有关。银纳米粒子与溶菌酶形成的生物共轭体中,溶菌酶的氨基结合到银纳米粒子的表面上[19],在酸性条件下,氨基的质子化使得银纳米粒子表面带有正电荷,加入NaCl后,Cl-中和掉部分正电荷,导致静电层的厚度减小,粒子-粒子间的相互作用增强,从而导致粒子聚集和沉降程度增加[20]。柠檬酸稳定的银纳米溶胶中加入NaCl后,银纳米粒子表面上的柠檬酸根与Na+相互作用,导致银纳米粒子表面的裸露程度增加[21],从而相互聚集,不能稳定存在。
溶菌酶稳定的银纳米粒子在酸性条件下可以很稳定地存在,这可能与溶菌酶的性质有关,溶菌酶在酸性条件下比较稳定,pH大于7时酶活性急剧下降[14],从而不能很好地稳定银纳米粒子。柠檬酸稳定的银纳米粒子的耐酸性不如溶菌酶稳定的银纳米粒子强,这可能是因为在近中性或碱性条件下,柠檬酸根的羧基结合在银纳米粒子表面上,粒子间通过静电斥力而稳定存在。柠檬酸的pKa1、pKa2、pKa3值分别为3.13、4.76、6.40,随着酸度的增加,银纳米粒子表面上的柠檬酸根逐渐被质子化,导致粒子间的范德华斥力减小,引力增加,粒子逐渐聚集。因此,在酸性条件下,溶菌酶稳定的银纳米粒子能够稳定存在,酸度变化不会影响银纳米粒子溶胶的颜色和状态,扩大了在酸性条件下的应用范围。
冷冻-解冻循环与物质的储存与再用密切相关,相比于柠檬酸稳定的银纳米粒子,冷冻-解冻循环次数对溶菌酶稳定的银纳米溶胶的影响较小。这可能是因为在-20 ℃冷冻过程中溶菌酶的结构没有遭到破坏,从而能够较好地保护银纳米粒子。柠檬酸作为离子化合物,对温度变化的承受力较差,这突出说明了蛋白质作为稳定剂的优势。
综上所述,生物分子溶菌酶作为银纳米粒子的稳定剂,增强了银纳米粒子的稳定性。与传统方法(以柠檬酸为稳定剂)相比,溶菌酶稳定的银纳米粒子对离子强度变化比较敏感,在酸性条件下能够稳定,受冷冻-解冻循环影响较小。对银纳米粒子稳定性的研究可以为银纳米粒子在生物医学领域及日常生活中的应用提供一定的理论指导。
[1] CHAUDHURI R G, PARIA S. Core/shell nanoparticles: classes, properties, synthesis mechanisms, characterization, and applications[J]. Chem Rev, 2012, 112(4): 2373-2433.
[2] KUMAR A, VEMULA P K, AJAYAN P M, et al. Silver-nanoparticle-embedded antimicrobial paints based on vegetable oil[J]. Nat Mater, 2008, 7(3): 236-241.
[3] LU Lei, SUN R W, CHEN Rong, et al. Silver nanoparticles inhibit hepatitis B virus replication[J]. Antivir Ther, 2008, 13(2): 253-262.
[4] LARA H H, AYALA-NUNEZ N V, IXTEPAN-TURRENT L, et al. Mode of antiviral action of silver nanoparticles against HIV-1[J]. J Nanobiotech, 2010, 8: 1-10.
[5] DAVID R, BALU K, NATHAN B S, et al. Antimicrobial surface functionalization of plastic catheters by silver nanoparticles[J]. J Antimicrob Chemoth, 2008, 61(4): 869-876.
[6] FICHTNER J, GURESIR E, SEIFERT V. Efficacy of silver-bearing external ventricular drainage catheters: A retrospective analysis[J]. J Neurosurg, 2010, 112(4): 840-846.
[7] 张燕, 王强斌. 银纳米粒子的生物医学应用研究进展[J]. 生物物理学报, 2010, 26(8): 673-679.
[8] MAFUNE F, KOHNO J, TAKEDA Y, et al. Structure and stability of silver nanoparticles in aqueous solution produced by laser ablation[J]. J Phys Chem, 2000, 104(35): 8333-8337.
[9] YIN Bingsheng, MA Houyi, WANG Shuyun, et al. Electrochemical synthesis of silver nanoparticles under protection of poly(N-vinylpyrrolidone)[J]. J Phys Chem B, 2003, 107(34): 8898-8904.
[10] BOKHONOV B B, SHARAFUTDINOV M R, WHITCOMB D R, et al. In situ self-assembly of silver nanoparticles[J]. J Phys Chem C, 2014, 118(22): 11980-11989.
[11] YANG Jiping, YIN Huajie, JIA Jingjing, et al. Facile synthesis of high-concentration, stable aqueous dispersions of uniform silver nanoparticles using aniline as a reductant[J]. Langmuir, 2011, 27(8): 5047-5053.
[12] NJAGI E C, STAFFORD L, GENUINO H, et al. Biosynthesis of iron and silver nanoparticles at room temperature using aqueous sorghum bran extracts[J]. Langmuir, 2011, 27(1): 264-271.
[13] IFUKU S, TSUJI M, MORIMOTO M, et al. Synthesis of silver nanoparticles templated by TEMPO-mediated oxidized bacterial cellulose nanofibers[J]. Biomacromolecules, 2009, 10(9): 2714-2717.
[14] 刘慧, 王凤山, 楚杰. 蛋清溶菌酶部分酶学性质及酶活性的影响因素研究[J]. 中国生化药物杂志, 2008, 29(6): 385-387, 391.
[15] 陈艳, 江明锋, 叶煜辉, 等. 溶菌酶的研究进展[J]. 生物学杂志. 2009, 26(2): 64-66.
[16] EBY D M, SCHAEUBIN M M, FARRINGTON K E, et al. Lysozyme catalyzes the formation of antimicrobial silver nanoparticles[J]. ACS Nano, 2009, 3(4): 984-994.
[17] JANA N R, GEARHEART L, MURPHY C J. Wet chemical synthesis of silver nanorods and nanowires of controllable aspect ratio[J]. Chem Commol/Lun, 2001, 3: 617-618.
[18] KELLY K L, CORONADO E, ZHAO L L, et al. The optical properties of metal nanoparticles: the influence of size, shape, and dielectric environment[J]. J Phys Chem B, 2003, 107(3): 668-677.
[19] DAS R, JAGANNATHAN R, SHARAN C, et al. Mechanistic study of surface functionalization of enzyme lysozyme synthesized Ag and Au nanoparticles using surface enhanced Raman spectroscopy[J]. J Phys Chem C, 2009, 113(52): 21493-21500.
[20] BADAWY A M, LUXTON T P, SILVA R G, et al. Impact of environmental conditions (pH, ionic strength, and electrolyte type) on the surface charge and aggregation of silver nanoparticles suspensions[J]. Environ Sci Technol, 2010, 44(4): 1260-1266.
[21] DOMINGUEZ-MEDINA S, BLANKENBURG J, OLSON J, et al. Adsorption of a protein monolayer via hydrophobic interactions prevents nanoparticle aggregation under harsh environmental conditions[J]. ACS Sustainable Chem Eng, 2013, 1(7): 833-842.
(责任编辑:刘俊华)
Study on the preparation and stability of the lysozyme-stabilized silver nanoparticles
ZHAO Yali, YANG Tao, ZHANG Ying, GAO Hongyun, XI Yanan
(College of Chemistry and Environmental Science, Hebei University, Baoding 071002, China)
Objective We have synthesized silver nanoparticles using protein as the stabilizer and discussed their stability to provide theoretical guidance for their application in biomedical field and daily life. Methods We have presented a one-step approach of chemical reduction to prepare the lysozyme-stabilized silver nanoparticles. Results The stability of lysozyme-stabilized silver nanoparticles was sensitive to the change of ionic strength and the nanoparticles precipitated completely in 10 mmol/L NaCl. The lysozyme-stabilized silver nanoparticles were stable under acidic condition (pH≤6). And the freeze-thawing cycle had a little influence on their stability. Conclusion The stability of lysozyme-stabilized silver nanoparticles is greatly influenced by the surrounding conditions. The variation caused by the stability factors should be considered for use and storage of the lysozyme-stabilized silver nanoparticles.
silver nanoparticles; lysozyme; stability
O648
A
1674-490X(2014)04-0001-07
2014-07-02
河北省自然科学基金资助项目(B2011201107);河北大学引进人才科研启动项目基金(2009-172)
赵亚利(1988—),女,河北石家庄人,在读硕士。
杨涛(1977—),男,陕西西安人,副教授,博士,硕士生导师,主要从事生物大分子和纳米材料的相互作用研究和扫描探针成像分析。E-mail: tyang@hbu.edu.cn
