烟草赤星病拮抗芽胞杆菌的筛选及培养基优化
2014-05-25罗楚翔陈建刚王昌军李进平施河丽祁高富陈守文
罗楚翔,彭 建,杨 欢,陈建刚,王昌军,李进平,施河丽,祁高富,陈守文*
(1.华中农业大学农业微生物国家重点实验室,武汉 430070;2.湖北中烟工业有限责任公司技术研发中心,武汉 430040;3.武汉黄鹤楼香精香料有限公司,武汉 430040;4.武汉乐阳生物科技有限公司,武汉 430075;5.湖北省烟草科研所,武汉 430030;6.恩施州烟草公司科技中心,湖北 恩施 445000)
烟草是我国重要的农业经济作物。历年烟草病害调查报告表明烟草赤星病是烟叶种植成熟期的主要真菌病害。1892年首次在美国发现烟草赤星病,我国自1916年开始在北京附近发现后,该病在全国各大烟区都有发生,对烟草行业造成严重的损失[1]。烟草赤星病的防治采用抗病育种、农业防治、化学防治和生物防治的方法。目前国内主要采用种植抗(耐)病品种及栽培防治为主、药剂防治为辅的综合防治措施,防治上大多采用化学方法[2-4]。由于对烟草品质的要求逐步提高,对成熟期病害的防治不宜采用有残留的化学药剂,使用拮抗微生物达到防治植物病害的目的是植物病害防治的重要组成部分[5-8]。
生防芽胞杆菌对烟草赤星病的防治在国内外都有相关报道,很多研究都是处在可控制的实验室条件下展开的。Fravel等[9]从烟叶表面分离筛选出的Bacillus cereus subsp.mycoids菌株在控制温度和湿度的温和条件下能有效控制烟草赤星病情的发展。李安娜等[10]从烟草叶围或根际的105株微生物中,分离筛选到 7株抑菌作用明显的菌株,其中B102对烟草赤星病的拮抗作用显著,其抑菌带宽度达13 mm。
芽胞杆菌的主要生防机制是竞争、拮抗、诱导植物抗性和促生作用[11-13],其突出的特征是能产生耐热抗逆的内生芽胞,这有利于生防菌剂的生产、加工和保存,也有利于菌体在环境中存活与定殖[14-15]。作者从实验室保存的 93株芽胞杆菌中分离了3株烟草赤星病拮抗菌,挑选其中效果最好的1株进行了生物学鉴定,并对其培养基配方进行了优化,显著提高了其发酵生物量。
1 材料与方法
1.1 材料
1.1.1 菌种及烟草 长柄链格孢菌(Alternaria longipes ACCC 30002);93株芽胞杆菌(本实验室保存);烟草K326(感赤星病品种)。
1.1.2 培养基 LB液体培养基:蛋白胨10.0 g/L,酵母浸粉5.0 g/L,氯化钠10.0 g/L,灭菌前pH 7.4;PDA 培养基:马铃薯200.0 g/L,蔗糖20.0 g/L,去皮马铃薯切成块状后煮沸30 min,4层纱布过滤后,滤液加入蔗糖,并补充蒸馏水至 1000 mL,琼脂18.0 g,灭菌前pH调节至6.6;Waksman培养基:葡萄糖10.0 g/L,蛋白胨5.0 g/L,氯化钠5.0 g/L,牛肉膏3.0 g/L,琼脂18.0 g/L,灭菌前pH 6.8;发酵培养基(KMB):甘油20.0 g/L,蛋白胨20.0 g/L,MgSO4·7H2O 2.5 g/L,K2HPO4·3H2O 1.5 g/L,灭菌前pH 7.2。
1.2 方法
1.2.1 芽胞杆菌培养 菌种活化:将-80 ℃保存的菌种在LB平板划线,于37 ℃培养20 h转接到斜面,斜面保存在4 ℃。种子培养:从斜面挑取菌落,接种在种子培养基中,于37 ℃,180 r/min的恒温摇床中培养。摇瓶发酵:将种子液按一定比例接种到发酵培养基中,于37 ℃,180 r/min的恒温摇床中培养。
1.2.2 拮抗芽胞杆菌的筛选 平板共培养筛选,方法参照文献[16],长柄链格孢菌在PDA平板上活化后,用5 mm的打孔器从菌落边缘取下新鲜菌饼,接入新鲜Waksman平板中心做指示菌,用接种环挑取分离纯培养物在距离菌饼3 cm处划线,每个菌株做3次重复,以仅接种病原真菌菌块而没有接种测试菌的作为对照。然后所有测试菌株放置在30 ℃培养大约 7 d,待对照平板菌落长满后,测量空白对照病原菌接种点距离沿平板边缘辐射生长的距离(R1)和接种拮抗菌时病原菌接种点距离沿拮抗菌方向辐射生长的距离(R2)。
病原菌径向生长抑制率(PIRG)[17]:
PIRG=(R1-R2)/R1×100%
R1表示空白对照组病原菌接种点距离沿平板边缘辐射生长的距离;R2表示处理组病原菌接种点距离沿拮抗菌方向辐射生长的距离。
1.2.3 盆栽试验 病原菌培养:赤星病原菌 A.longipes ACCC 30002于PDA培养基上培养,刮下孢子,用1%葡萄糖溶液将孢子浓度调为105个/mL,备用;拮抗菌的制备:拮抗菌在种子液中培养,离心稀释,调整菌株细胞浓度为109CFU/mL,备用;烟草幼苗培养:2011年3月烟草K326种子经表面消毒后催芽、播种,培养至第 10片真叶展开,移至盆钵,盆钵置于温室中,温室条件为28~30 ℃,相对湿度为65%,16 h光照(白天)、8 h黑暗(晚上);盆栽试验设计:2011年7月中旬,将拮抗菌均匀喷洒在烟叶上,48 h后将 A.longipes ACCC 30002孢子液喷洒在烟叶上。从第1株烟发病时间作为起始时间,每隔5 d统计发病情况。盆栽试验每组3个重复,每个重复5株烟,每组共15株烟。CK组:不接种拮抗菌,48 h后接种病原菌;处理组:接种拮抗菌,48 h后接种病原菌。
1.2.4 生防效果评价方法 烟草赤星病病情分级标准(病情代表值):
0级:全株无病;1级:病斑面积占叶片面积的1%以下;3级:病斑面积占叶片面积的1%~5%;5级:病斑面积占叶片面积的6%~10%;7级:病斑面积占叶片面积的 11%~20%;9级:病斑面积占叶片面积的21%以上。
盆栽试验发病率、病情指数和相对防效:
发病率=N/M×100%
N表示发病株数,M表示调查总株数;
病情指数=∑(i×Ni)/(I×M)×100%
I表示病情代表值,Ni表示 i病情下发病株数目,I表示最高病情代表值,M表示调查总株数;
相对防效=(FCK-Fm)/FCK×100%
FCK表示CK组病情指数,Fm表示处理组病情指数。
1.2.5 菌株鉴定方法 以实验室保存的 B.subtilis 3-10为参照,菌株的生理生化鉴定参照《伯杰氏系统细菌学手册》第9版。Biolog微生物系统鉴定方法见仪器操作说明。
1.2.6 统计分析方法 以上盆栽试验及培养基优化实验数据结果采用SPSS 18.0 软件进行显著差异性(P<0.05)分析。
2 结 果
2.1 菌株的筛选及鉴定
2.1.1 拮抗芽胞杆菌筛选 通过平板对峙筛选,从实验室保存的93株芽胞菌株中筛选出了10株拮抗效果较好的菌株。从抑菌效果看(表1),菌株K11、KN1的平均PIRG值最大,达到了63.64%和61.36%,可以作为盆栽试验的测试菌株。虽然菌株 1-1的PIRG值不突出,但其生长速度明显快于其它菌株,表现出生态位点上的竞争优势,因此也可以作为盆栽试验的测试菌株。
2.1.2 烟草赤星病拮抗菌的温室盆栽试验 由表 2和图1可知,筛选的3株拮抗菌都具有一定的生物防治效果。发病第10天,K11菌处理组相对防效最高为51.11%,病情指数比对照下降了17.03%,并且低于KN1和1-1处理组,说明K11具备较好的生物防治效果。
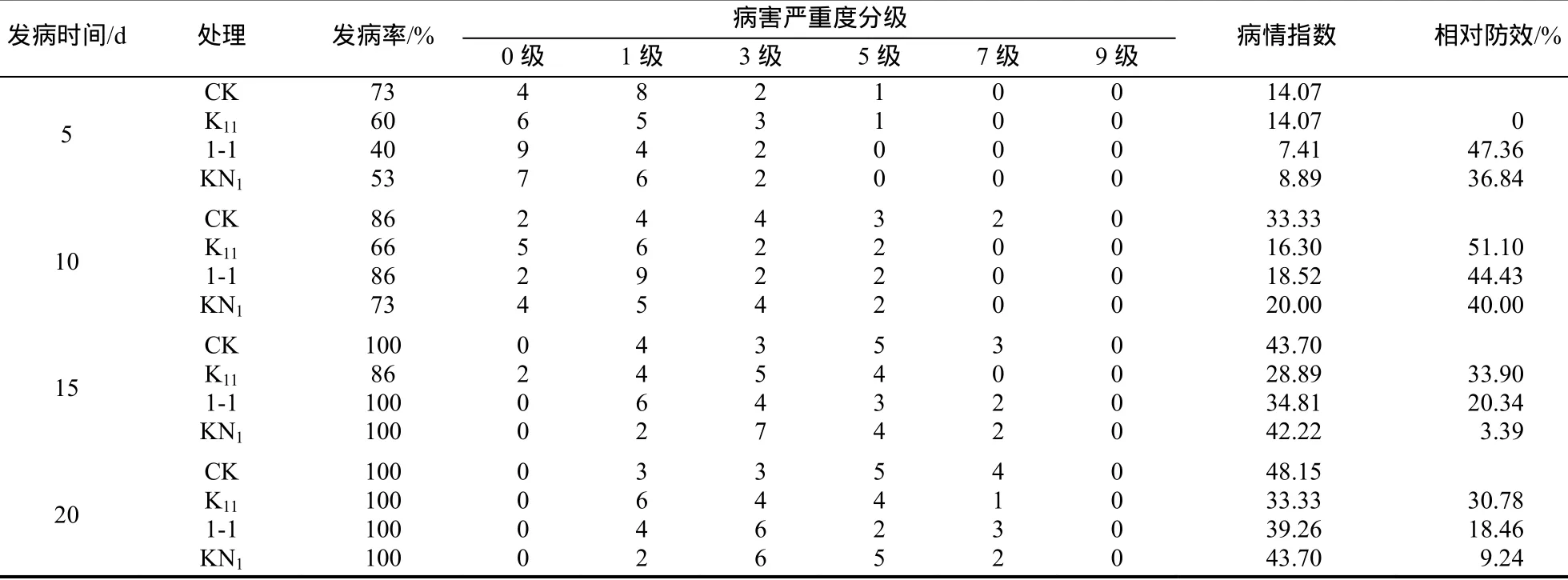
表2 3株拮抗菌株对烟草赤星病生防效果Table2 Bio-control effect of three antagonistic strains against tobacco brown spot disease

图1 接种拮抗菌后烟株病情指数随时间的变化Fig.1 The change of disease index with the treatment of antagonistic strains selected with time
2.2 菌株K11的鉴定
2.2.1 菌株 K11的形态观察及生理生化指标 菌株K11在LB固体培养基上生长,菌落培养初期粘稠、表面光滑、边缘整齐,随着培养时间的延长,菌落近白色,圆形,表面干燥、起皱、不透明。K11菌株的形态、生理生化特征(表3)与B.subtilis 3-10最为接近。
2.2.2 Biolog微生物自动分析仪鉴定 Biolog微生物自动分析仪鉴定微生物需要考虑3个参数:可能性、相似性(SIM)、位距(DIS)。SIM 和 DIS是两个重要的参数,表示测试结果与数据库相应的数据的匹配程度。当DIS<5.0,SIM>0.75为良好的匹配;SIM值越接近于1%,检定结果的可靠性越高。根据96孔板的反应结果,系统显示了10个可能的ID,如果10个SIM值的总和大于0.5时,系统给出的鉴定结果ID是一个属名,菌株K11的10个ID值总和为0.635,K11属于芽胞杆菌属,初步鉴定为Bacillus subtilis 。
2.3 菌株K11的培养基优化
2.3.1 碳源的选择 以20 g/L甘油的含碳量作为参考,选取7种常用有机碳源,以含碳量相等的原则替换甘油,考察K11的利用情况。结果如图2所示,对K11生长的有利碳源是蔗糖、葡萄糖。考虑到葡萄糖的成本要远低于蔗糖,因此,选用葡萄糖为碳源。

表3 菌株K11的生理生化特点Table3 The physiological and biochemical characteristic of the strain K11

图2 不同碳源对菌株K11生物量的影响Fig.2 Effect of different carbon sources on biomass production
2.3.2 氮源的选择 以20 g/L的蛋白胨含氮量为参考,选取6种常用氮源,以含氮量相等的原则代替蛋白胨。如图3所示,选取豆粕作为有机氮源。
2.3.3 无机盐的筛选 如图4所示,选用1 g/L的ZnSO4·7H2O、MgSO4·7H2O、K2HPO4·3H2O、FeSO4和 CaCO3进行单一无机盐替换。MgSO4·7H2O 和K2HPO4对K11的生物量有显著性影响。
2.3.4 培养基主要成分正交试验结果 分别采用单因素实验考查葡萄糖(10~30 g/L)、豆粕(10~40 g/L)、MgSO4·7H2O(0.1~0.9 g/L)和 K2HPO4·3H2O(0.5~3.0 g/L)对K11生物量的影响,结果表明,各自的合适浓度为:葡萄糖20 g/L,豆粕30 g/L,K2HPO4·3H2O 1.0 g/L,MgSO4·7H2O 0.1 g/L。其中,MgSO4·7H2O添加量在实验浓度范围内对K11生物量没有显著影响。进一步采用正交实验设计,探讨葡萄糖、豆粕和K2HPO4·3H2O对K11生物量的影响(表4)。

图3 不同氮源对菌株K11生物量的影响Fig.3 Effect of different nitrogen sources on biomass production

图4 无机盐对菌株K11生物量的影响Fig.4 Effect of 5 types of inorganic salt on biomass production

表4 培养基主要成分正交实验设计Table4 The orthogonal experiment design of major component in the medium

表5 培养基主要成分正交实验结果Table5 The results of orthogonal experiment of major component in the medium
从表5可知,在本次正交实验设计的条件下,通过Minilab软件进行极差分析,得出各因素影响K11生物量的主次顺序为葡萄糖>豆粕>磷酸氢二钾。最优培养基配方为:葡萄糖20 g/L,豆粕40 g/L,K2HPO4·3H2O 0.5 g/L,MgSO4·7H2O 0.1 g/L。优化后生防菌株 K11的生物量比对照提高6.5倍,生物量高达1.28×1010CFU/mL,芽胞形成率在95%以上。
3 讨 论
本研究由病情指数与时间的变化曲线来看,菌株1-1处理组在发病初期有最低的病情指数,可能原因是该菌生长速度快,占据了烟草叶片上的生态位点,起到了防止病原菌侵入的作用。3株菌相比,菌株K11相对防效更加稳定,但随着时间推移,拮抗菌相对防治效果的整体趋势是下降的。一方面可能随着烟叶表面营养的匮乏,拮抗菌的数量随之下降;另一方面萌发的病原菌孢子成功侵入植株后,在植株体内存在特定的庇护场所而不会受到拮抗菌的影响[18]。氮源优化的过程中,当豆粕浓度过高时(>30 g/L)反而不利于生物量的合成,可能是菌株K11生物量的合成需要好氧条件,而高浓度豆粕使培养体系过于粘稠,不利于溶氧的传递。
一般来讲拮抗微生物能够在叶围及根际生存、定殖,是因为其能在体表占据有利的空间,与病原物进行空间及营养的竞争,同时还能分泌拮抗物质,如几丁质酶、抗生素、细菌毒素等,这些物质能抑制病原菌的生存,甚至杀死病原菌,本研究筛选的芽胞杆菌K11的生防机理还有待进一步研究。芽胞杆菌作为生防菌,在应用与生产过程中有其独特的优势[15]。
4 结 论
在所筛选的拮抗芽胞杆菌中,菌株K11的相对防效更加稳定,接种后第10天,菌株K11对赤星病的相对防效达到最大,为51%,但随着时间推移,拮抗菌相对防治效果呈下降趋势。菌株K11的最优氮源是豆粕,其最优浓度是40 g/L,高浓度的豆粕影响溶氧,不利于菌体的生长。
芽胞杆菌的拮抗机理比较复杂,本研究筛选出的枯草芽胞杆菌K11在烟草赤星病的防治过程中存在重大应用价值,优化后的培养基配方对其生物菌剂的生产提供了重要参考,其生防机理还有待进一步研究。
[1]张万良,翟争光,谢扬军,等.烟草赤星病研究进展[J].江西农业学报,2011(1):118-120.
[2]丁国华,赵淑华.我国烟草病害及抗赤星病育种研究进展[J].黑龙江农垦师专学报,2001,15(1):99-100.
[3]成巨龙,孙渭.烟草不同发育阶段对赤星病的抗性表现与综合防治技术[J].植物保护学报,2001,28(1):44-48.
[4]孔凡玉,石金开.烟草品种资源对烟草赤星病抗病性鉴定初报[J].中国烟草,1996,17(4):39-41.
[5]Handelsman J, Stabb E V.Biocontrol of Soilborne Plant Pathogens[J].Plant Cell, 1996, 8(10)∶ 1855-1869.
[6]Fravel D R.Commercialization and implementation of biocontrol[J].Annu Rev Physiol, 2005, 43∶ 337-359.
[7]陈瑞泰.烟草病虫害防治[M].济南:山东科学技术出版社,1989.
[8]谭仲夏,杨龙祥,李成杰.烟草赤星病的生物防治研究进展[J].烟草科技,2005(7):41-45.
[9]Fravel D R, Spurr H W, Harvey J R.Biocontrol of tobacco brown-spot disease by Bacillus cereus subsp.mycoides in a controlled environment[J].Phytopathology,1977, 67(7)∶ 930-932.
[10]李安娜,金莹,逯鹏,等.抗烟草赤星病芽胞杆菌B102菌株的筛选及抑菌作用[J].烟草科技,2008(2):57-60.
[11]Kloepper J W, Ryu C M, Zhang S.Induced systemic resistance and promotion of plant growth by Bacillus spp[J].Phytopathology, 2004, 94(11)∶ 1259-1265.
[12]Compant S, Clément C, Sessitsch A.Plant growth-promoting bacteria in the rhizo-and endosphere of plants∶ their role, colonization, mechanisms involved and prospects for utilization[J].Soil Biology and Biochemistry, 2010, 42(5)∶ 669-678.
[13]Compant S, Duffy B, Nowak J, et al.Use of plant growth-promoting bacteria for biocontrol of plant diseases∶ principles, mechanisms of action, and future prospects[J].Applied and environmental microbiology,2005, 71(9)∶ 4951-4959.
[14]米明妍,刘姣,杜春梅.芽孢杆菌生物防治植物病害研究进展[J].安徽农业科学,2013,40(34):16635-16638.
[15]齐爱勇,赵绪生,刘大群.芽孢杆菌生物防治植物病害研究现状[J].中国农学通报,2011,27(12):277-280.
[16]Tariq M, Yasmin S, Hafeez F Y.Biological control of potato black scurf by rhizosphere associated bacteria[J].Brazilian Journal of Microbiology, 2010, 41(2)∶ 439-451.
[17]Bivi M R, Farhana M S, Khairulmazmi A, et al.Control of Ganoderma Boninense∶ a causal agent of basal stem rot disease in oil palm with endophyte bacteria in vitro[J].Int J Agric Biol, 2010, 12(6)∶ 833-839.
[18]Johnson K B.Pathogen refuge∶ a key to understanding biological control[J].Annual review of phytopathology,2010, 48∶ 141-160.
