肝细胞肝癌患者血清microRNA-224水平变化及其临床诊断意义的研究*
2014-05-25陈旭义张明华王仁杰
张 华 陈旭义 杨 波 张明华 王仁杰
在生物体内不同的生理过程,诸如发育、分化、增值、凋亡、病毒感染以及肿瘤的发生发展中,特异性的miRNA发挥着重要的作用[1-3]。miRNA是通过对其靶基因的转录后表达调节发挥作用的。目前,越来越多的研究发现[4-5],miRNA在肝细胞癌(hepato⁃cellular carcinoma,HCC)或肝癌细胞中的表达量相对正常组织或细胞有非常明显,诸如,miR-122a、miR-221/222、miR-21、miR-224、miR-34a等,而且某些miRNA与HCC的转移、复发和预后等临床病理特性相关。本研究利用实时荧光定量PCR检测肝细胞肝癌患者血清miR-224水平变化,旨在探讨其临床诊断意义。
1 材料与方法
1.1 研究对象
本院2012年1月至12月收治的原发性肝细胞肝癌患者42例,其中男24例,女18例,平均年龄(53.2±7.3)岁。按照2002年美国癌症联合委员会(AJCC)分期标准进行TNM分期,Ⅰ期6例、Ⅱ期11例、Ⅲ期14例和Ⅳ期11例。36例肝硬化患者(LC),其中男19例,女17例,平均年龄(51.1±6.5)岁。HCC和LC患者均经病理诊断确诊。55例慢性乙型肝炎患者(CHB),其中男30例,女25例,平均年龄(52.8±8.9)岁。所有患者排除其他肿瘤或病毒感染疾病。另同期40例健康体检者(NC)作为正常对照组。所有入组患者在采集血液标本前均未经手术、放疗以及化疗。随机组患者与对照组在年龄、性别上差异无统计学意义,具有可比性(P>0.05)。在采集样本前均获得患者的知情同意,获本院伦理委员会批准。
1.2 检测方法
1.2.1 血清标本采集及总RNA提取 收集每例待检者外周血3 mL置于不含乙二胺四乙酸(EDTA)的试管中,在室温静置30 min后取1.0 mL上清液,4℃、820 g离心10 min;取上清液后4℃、16 000 g离心10 min,取上清液到新的离心管中,置于-80℃冰箱中保存备用。
按照RNA提取试剂盒Trizol Reagent(Invitrogen,美国)的操作说明提取血清总RNA。利用紫外分光光度计NanoDrop ND-1000(NanoDrop,Wilmington,美国)测定RNA浓度和纯度。要求总RNA溶液的A260/A280在1.8~2.1范围之内,否则再次提取。利用1%变性琼脂糖凝胶电泳分析总RNA提取的质量。获得的RNA溶液于-80°C保存备用。
1.2.2 miRNA逆转录和荧光定量PCR检测血清miR-224表达量 应用iScript cDNA synthesis kit反转录试剂盒(Bio-Rad,美国),按照说明书将1 μg总RNA反转录为cDNA,主要反应条件:25℃5 min,42℃30 min,85℃5 min。以合成的cDNA为模板,应用 iQTMSYBR®Green Supermix试剂盒(Bio-Rad,美国),按照说明书进行实时荧光定量PCR。同时以U6小核RNA(small nuclear RNA,snRNA)管家基因作为内参照。运用Primer Premier 5.0软件进行设计miRNA-224和U6的特异性引物,miRNA-224引物:s:5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGC ACTGGATACGACTAAACG-3',as:5'-CGCAAGTCCT AGTGGTTCCG-3'。U6 引物:s:5'-CTCGCTTCGGC AGCACA-3',as:5'-AACGCTTCACGAATTTGCG T-3'。引物由上海生工生物工程有限公司合成。实时荧光定量PCR检测在Bio-Rad iQ5定量PCR仪器上进行反应。PCR反应循环条件:第1步,95℃预热3 min;第2步,95℃ 30 s、56℃ 30 s、72℃ 30 s,共40个循环。熔解曲线分析0.5℃/0.5 min:55℃~95℃。在Bio-Rad荧光定量PCR-iQ5软件进行分析。每个miRNA的相对表达量用2-ΔΔCt表示,ΔΔCt=(CtHCC-miR224-CtHCC-U6)-(CtNC-miR224-CtNC-U6)每个样本重复3次试验。
1.3 统计学方法
采用SPSS 18.0统计软件对数据进行t检验、相关性分析。计量资料以表示。通过受试者工作特征曲线(receiver operator characteristic curve,ROC)判断miRNA-224表达水平在肝癌诊断中的灵敏度和特异度。P<0.05为差异有统计学意义。
2 结果
2.1 miR-224在NC,CHB,LC,HCC患者血清的表达量
参照公式计算2-ΔΔCt,分别算出miR-224在CHB,LC,HCC患者血清中的平均相对表达量(差异倍数)(表1,图1)。3组患者血清miR-224相对表达量均高于NC组,其中LC和HCC组高于对照组,差异有统计学意义(P<0.05);HCC组和LC组高于CHB组,差异有统计学意义(P<0.05);HCC组高于LC组差异有统计学意义(P<0.05)。
2.2 HCC患者血清miR-224相对表达量与临床病理特征的关系
HCC血清miR-224相对表达量与临床病理特征的相关性分析,结果显示HCC血清miR-224相对表达量与AFP呈正相关(P<0.01);但是与肿瘤大小、TNM分期、肿瘤分化程度以及淋巴结转移无相关性(P>0.05,表2)。
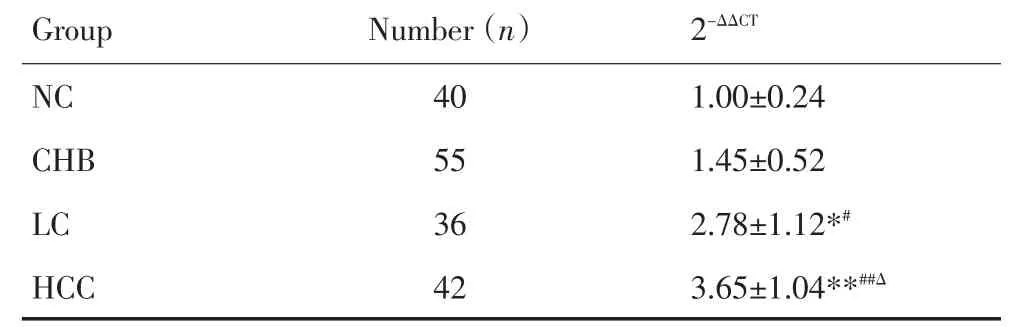
表1 miR-224在NC,CHB,LC,HCC患者血清的相对表达量Table 1 Relative expression of miR-224 in the serum of NC,CHB,LC,and HCC groups

图1 miR-224在NC,CHB,LC,HCC患者血清的相对表达水平Figure 1 Relative expression of miR-224 in the serum of the NC,CHB,LC,and HCC groups
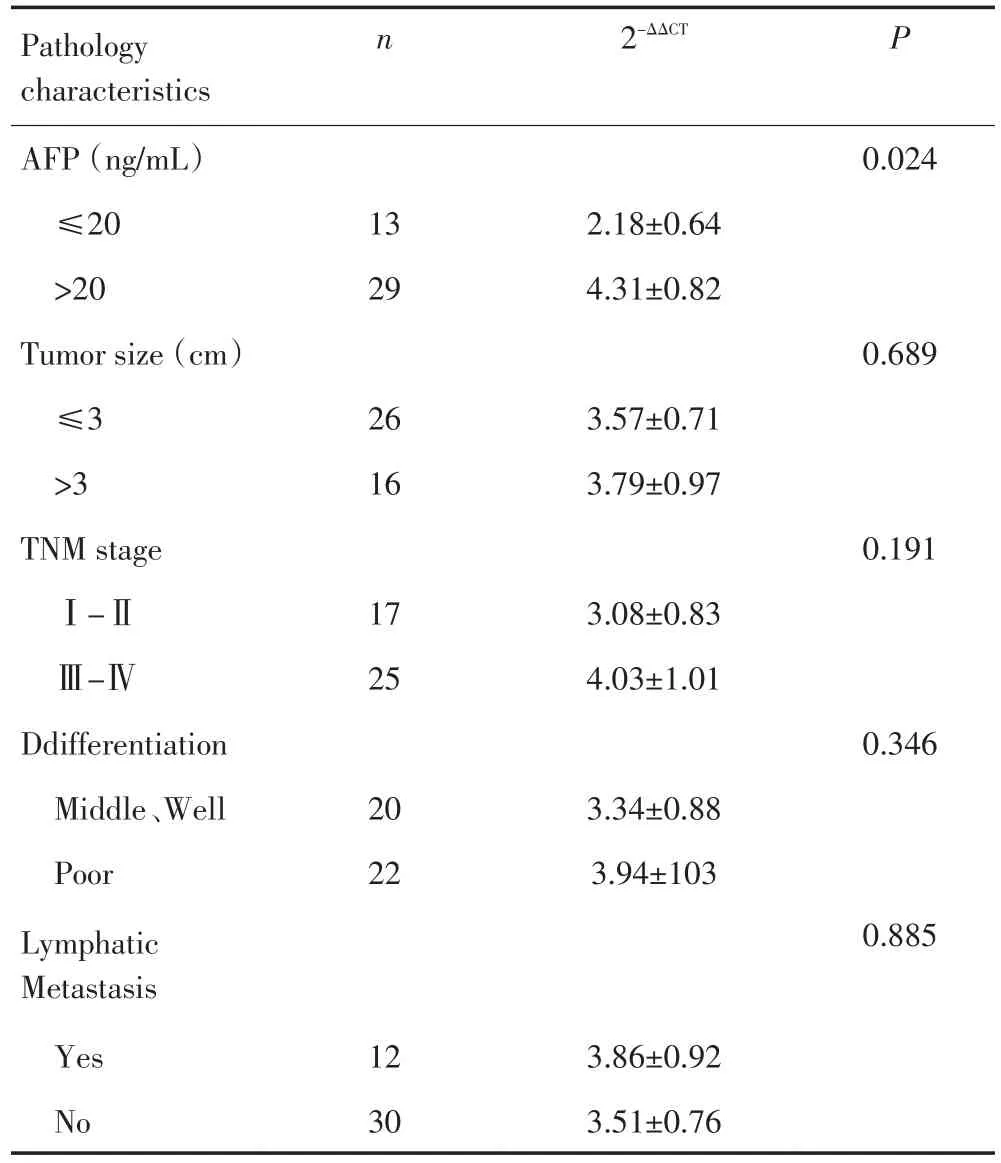
表2 HCC患者血清miR-224相对表达量与临床病理特征的关系Table 2 Relationship between the relative expression of miR-224 in the serum of the HCC group and clinico-pathological features
2.3 HCC患者血清miR-224对HCC诊断的敏感性和特异性
通过受试者工作特征曲线分析血清miRNA-224相对表达量在肝癌诊断中的灵敏度和特异度,分析结果确定了最佳的miR-224相对表达量的临界值为3.47,灵敏度被确定为82.2%,特异性为92.8%,曲线下面积(area under the curve,AUC)为0.935(图2)。提示采用实时荧光定量PCR检测血清miRNA-224的相对表达量,作为肝癌的生物标志物的检测有一定的准确性和可行性。这为高效准确诊断肝癌提供了一定的指导意义。

图2 HCC患者HCC血清miR-224相对表达量的ROC曲线Figure 2 ROC of the relative expression of miR-224 in the serum of the HCC group
3 讨论
肝癌是最常见的恶性肿瘤,在我国恶性肿瘤中其发病率位居第二,在美国恶性肿瘤相关疾病中其死亡率位居第五位[6],具体发病机理仍不十分清楚,其早期诊断仍较困难。在大量的HCC病例研究中,人们认识到HCC的发生发展过程中涉及到一系列基因的改变[7],但对其具体的分子机制并不清楚。寻找肝癌发生、发展的相关基因,了解肝癌的分子遗传学机制从而为肝癌的诊断、治疗提供理论基础是目前的研究热点。
随着对miRNA的了解越来越深入,miRNA在临床中的应用会越来越广泛。由于miRNA序列、结构、丰度和表达方式的多样性,决定了其在人类肿瘤信号通路中所起到的重要作用,而且不同肿瘤中有其特异性的miRNA表达谱[8]。研究表明,miRNA在血清和血浆中也可能有稳定的表达,血清或血浆放置在常温24 h以上或在强酸强碱环境中以及反复冰冻及融解样本多次也不影响miRNA的稳定性,采用基于茎环的RT-PCR方法证明了血浆中miRNA耐核糖核酸酶的,是非常稳定的,并且血浆和血清中的样本检测有很好的相关性,都很适合作为血液基础的标记物,提示可以作为潜在的特异性肿瘤标志物[9-11]。多项研究发现[12-16],肝脏组织特异性的miRNAs在一些恶性肝组织或者细胞中相较正常组织或细胞有非常明显的变化,其中miR-224就是其中之一,它在肝细胞肝癌患者组织中高表达。
目前,国内外较少有关于检测特异性miRNA用于肝癌的临床诊断的报道。而且通过检测患者血清miRNA用于临床诊断的更为少见。目前肿瘤患者某些外周血miRNA升高的原因可能是在肿瘤组织中超表达的miRNA以一定的方式释放入外周血中,具有肿瘤特异性,有可能作为一种新型的肿瘤标志物。本研究通过提取血清miRNA,进行实时荧光定量PCR验证,检测和分析了肝细胞肝癌患者、肝硬化患者、慢性乙型肝炎患者、40例健康体检者血清中miR-224表达情况。结果发现,肝细胞肝癌患者血清miR-224水平较健康者有明显升高(P<0.01),且高于肝硬化患者、慢性乙型肝炎患者(P<0.05或P<0.01),肝癌患者血清miR-224水平变化趋势与国内外研究结果趋于一致[12-16]。研究结果提示血清miR-224异常大幅度增高,可能是肝细胞肝癌的一个重要血清指标,对早期无症状肝癌的诊断有一定指示作用。分析HCC患者血清miR-224相对表达量与临床病理特征的关系发现,miR-224与AFP含量呈正相关(P<0.01)。同时研究发现在TNMⅠ和Ⅱ期肝细胞肝癌患者血清中的表达明显上调,进一步提示血清miR-224水平可以作为早期诊断有一定的参考意义。虽然在TNMⅠ和Ⅱ期肝细胞肝癌患者血清中的表达明显上调,而这种特异性表达上调与肿瘤的TNM分期、是否转移、肿瘤分化程度统计学分析无明显关系(P>0.05),可能与组织样本量少有关,也有可能提示血清miR-224水平变化无法作为肿瘤进展的观测指标。
通过ROC分析HCC患者血清miR-224对HCC诊断的敏感性和特异性发现,最佳的miR-224相对表达量的临界值为3.47,灵敏度被确定为82.2%,特异性为92.8%,曲线下面积(AUC)为0.935。这进一步支持了血清miRNA-224作为肝细胞肝癌的生物标志物有一定的准确性和可行性。本研究采用抽取患者血清方式,且运用一种准确的、重现性好、高效的荧光定量PCR法进行检测。因此,这在临床应用上能够早期、便捷、有效的提示癌变。患者血清miR⁃NA-224水平的检测为今后在临床上展开新的更高效的肝癌诊断方法提供了一定的指导意义。
综上所述,miR-224在肝细胞肝癌患者血清表达明显升高,对肝细胞肝癌诊断名感性和特异性高,它有可能成为一种新的血清学指标用于肝细胞肝癌的诊断。
1 Lin Y,Zeng Y,Zhang F,et al.Characterization of microRNA ex⁃pression profiles and the discovery of novel microRNAs involved in cancerduring human embryonic development[J].PLoS One,2013,8(8):e69230.
2 Jiang J,Gusev Y,Aderca I,et al.Association of MicroRNA expres⁃sion in hepatocellular carcinomaswith hepatitis infection,cirrhosis,and patient survival[J].Clin Can Res,2008,14(2):419-427.
3 Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in se⁃rum:A novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
4 Callegari E,Elamin BK,Sabbioni,et al.Role of microRNAs in he⁃patocellular carcinoma:a clinical perspective[J].Onco Targets Ther,2013,6:1167-1178.
5 Mott JL.MicroRNAs involved in tumor suppressor and oncogene pathways:implications for hepatobiliary neoplasia[J].Hepatology,2009,50(2):630-637.
6 Jernal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Can⁃cer J Clin,2008,58(2):71-96.
7 Tsai WC,Hsu SD,Hsu CS,et al.MicroRNA-122 plays a critical role in liver homeostasis and hepatocarcinogenesis[J].J Clin Invest,2012,122(8):2884-2897.
8 LU J,GETZ G,MISKA E A,et al.MicroRNA expression profiles classify human cancers[J].Nature,2005,435(7043):834-838.
9 Junhao GU,Yaping TIAN,Xinyu WEN.Serum microRNA charac⁃terization identifies miR-885-5p as a potential marker for detect⁃ing liver pathologies[J].Clin Sci(Cond),2011,120(5):183-193.
10 Wang J,Zhang KY,Liu SM,et al.Tumor-associated circulating mi⁃croRNAs as biomarkers of cancer[J].Molecules,2014,19(2):1912-1938.
11 CHIN LJ,SLACK FJ.A truth serum for cancer-microRNAs have major potential as cancer biomarkers[J].Cell Res,2008,18(10):983-984.
12 Wang Y,Lee AT,Ma JZ,et al.Profiling microRNA expression in hepatocellular carcinoma revealsmicroRNA-224 up,regulation and apoptosis inhibitor-5 as a microRNA 224-specific target[J].J Bio Chem,2008,283(19):13205-13215.
13 Wang Y,Lee CG.Role of miR-224 in hepatocellular carcinoma:a tool for possible therapeutic intervention[J]?Epigenomics,2011,3(2):235-243.
14 Ura S,Honda M,Yamashita T,et al.Differential microRNA expres⁃sion between hepatitis B and hepatitis C leading disease progression to hepatocellular carcinoma[J].Hepatology,2009,49(4):1098-1112.
15 Xiao HJ,Wang GY,Dong QH.microRNA Expression Profiles in Hepatocellular Corcionma and Adjacent Non-tumorous Tissues[J].Cancer Research on Prevention and Treatment,2012,39(8):947-949.[肖海静,王观宇,董庆华.人肝细胞肝癌和癌旁正常组织microRNA表达差异的分析[J].肿瘤防治研究,2012,39(8):947-949.]
16 Gao JP,Xiang BD,Ni HH,et al.Correlation of microRNA-224 expression between timorous tissue and plasma in hepatocellular carcinoma[J].China Journal of Modern Medicine,2011,21(32):4012-4016.[高军平,向邦德,倪航航,等.microRNA-224在肝细胞癌组织和血浆中表达的相关性[J].中国现代医学杂志,2011,21(32):4012-4016.]
