FC与FCR方案治疗慢性淋巴细胞白血病的临床回顾性分析*
2014-05-25李增军易树华章艳茹冯晓燕邢立杰齐军元赵耀中邱录贵
李 菲 李增军 易树华 章艳茹 冯晓燕 邢立杰 齐军元赵耀中 邱录贵
慢性淋巴细胞白血病(CLL)是成熟的B淋巴细胞在外周血、骨髓、淋巴结和脾脏等淋巴组织中克隆性增殖的肿瘤性疾病。二十世纪八十年代,核苷类似物的运用使CLL治疗出现重大进展。氟达拉滨联合环磷酰胺(FC)方案能明显改善患者的无进展生存时间,成为治疗CLL的标准方案。FC方案中加入利妥昔单抗(FCR)能进一步提高患者的完全缓解率和总反应率,改善患者的无进展生存时间(PFS)和总生存时间(OS)。美国综合癌症网(NCCN)已推荐FCR方案作为治疗CLL的一线方案[1]。我国CLL的发病率较低,尚缺乏FCR和FC方案治疗CLL的临床资料比较。本研究回顾性分析本院58例使用FCR或FC方案的CLL患者的治疗疗效和生存时间,并进行比较。现将结果报道如下。
1 材料与方法
1.1 临床病例
2002年12月至2012年1月中国医学科学院血液病医院淋巴诊疗中心接受FCR和FC方案治疗并有完整随访资料的CLL患者共58例。58例患者中男性38例,女性20例,中位年龄52.5(33~72)岁,FCR组患者27例,初治者13例。FC组患者31例,初治者21例。诊断标准参照美国国立癌症研究所CLL工作组(NCI-WG)制定的1996版诊断指南和国际CLL工作组(IW-CLL)2008年更新NCI-WG 1996指南[2],根据外周血细胞计数、骨髓形态学和流式细胞术(FCM)免疫表型检测结果进行诊断。所有患者均达到一项治疗指征。标准采用NCCN的治疗指征[1]。
1.2 方法
1.2.1 治疗方案 全部患者均签署治疗知情同意书。FCR方案剂量为:利妥昔单抗375 mg/m2,第2个疗程起将利妥昔单抗剂量增至500 mg/m2,静脉滴注,第1天;氟达拉滨25 mg/m2,静脉滴注,第2~4天;环磷酰胺250 mg/m2,静脉滴注,第2~4天。28 d为1个周期。应用利妥昔单抗前30 min静脉注射地塞米松10 mg,肌肉注射非那根25 mg预防过敏反应。FC方案剂量为:氟达拉滨25 mg/m2,环磷酰胺250 mg/m2,静脉滴注,第1~3天。28 d为1个周期。患者至少接受3个或以上FCR或FC方案治疗。治疗过程中给予水化、碱化、利尿和护肝等措施,定期监测血常规,肝肾功能等指标。骨髓抑制期中性粒细胞<0.5×109/L给予粒细胞集落刺激因子(G-CSF)皮下注射,Hb<70 g/L或PLT<20×109/L,输注辐照后的红细胞或机采血小板悬液。
1.2.2 流式细胞术检测 检测CD5、CD23、sIg(κ和λ)、FMC7、CD22、CD25、CD19、CD20、CD10、CD11c等指标。单抗均为美国BD公司产品。采用美国BD公司的FACSCalibur流式细胞仪和Cell Quest分析软件进行分析。CD5+CD19+细胞比例<1%为MRD阴性,>1%为MRD阳性。
1.2.3 随访 所有病例均随访至2013年8月。PFS时间定义为开始FCR或FC治疗至疾病发生进展或死亡的时间。OS时间定义为开始FCR或FC治疗至随访终点或任何原因死亡的时间。疗效评价参照2008年IW-CLL推荐标准[2]。治疗反应分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。
1.3 统计学分析
采用SPSS 20.0软件包进行统计学分析。应用χ2检验和非参数检验进行差异性检验。Kaplan-Meier法计算PFS和OS时间,并绘制生存曲线。Log-rank法检验各组患者生存率的差异。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
除FC组中位血小板数较低外,两组患者其他临床特点无显著差异(P均>0.05),两组患者各种临床指标的差异性比较见表1。

表1 FCR组和FC组患者各项临床指标的比较Table 1 Comparison of clinical indicators between patients treated with FCR and FC regimen
2.2 临床疗效
FCR组患者接受治疗的中位疗程数为4(3~6)个,FC组为4(3~10)个。FCR和FC组患者CR率和ORR比较见表2。FCR组CR率和ORR均高于FC组(44.4%vs.19.4%,P=0.039;81.5%vs.51.6%,P=0.017)。由于病例数较少,初治组和复治组患者CR和ORR率无明显差异。

表2 两组方案疗效比较 例(%)Table 2 Comparison of the efficacy of treatment in FCR and FC groups n(%)
2.3 生存分析
随访至2013年8月,58例患者中位随访时间28(3~102)个月。FCR组达到CR者12例,中位PFS(未到达vs.15个月,P=0.000)和OS(未到达vs.48个月,P=0.002)明显优于未获得CR者;FC组6例,CR患者中位PFS(未到达vs.22个月,P=0.014)优于未获得CR者,OS(均未到达,P=0.055)无明显差别。由于样本量较小,未发现FCR和FC两组患者PFS和OS的差异。
58例中共有14例疗程结束后MRD检测为阴性,MRD阴性和阳性患者中位PFS时间为未达到和22(12.9~31.0)个月,中位OS时间为未达到和63(17.2~108.8)个月,MRD阴性组PFS和OS明显优于MRD阳性组(P值分别为0.002,0.003,图1)。其中FCR组MRD阴性患者10例(37.0%)高于FC组4例(12.9%),差异具有统计学意义(P=0.032)。
将FCR和FC两组患者分别按照高危遗传学因素[p53和ATM缺失,复杂核型(染色体异常累及到2条以上染色体或/和3个以上断裂位点)]将患者分为高危遗传学亚组和非高危遗传学亚组,行预后分析。结果FC组遗传学高危者12(38.7%)例,FCR组13例(48.1%),FCR和FC两组患者中,高危遗传学亚组患者中位PFS均短于非高危遗传学亚组患者(15个月 vs.未达到,P=0.011;22个月 vs.未达到,P=0.027,图2)。OS未发现差别。
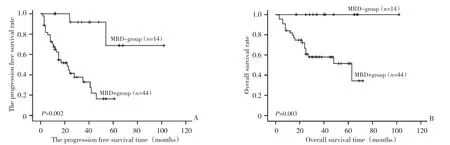
图1 MRD阴性组和阳性组患者PFS和OS的比较Figure 1 Comparison of PFS and OS between MRD-negative and MRD-positive patients
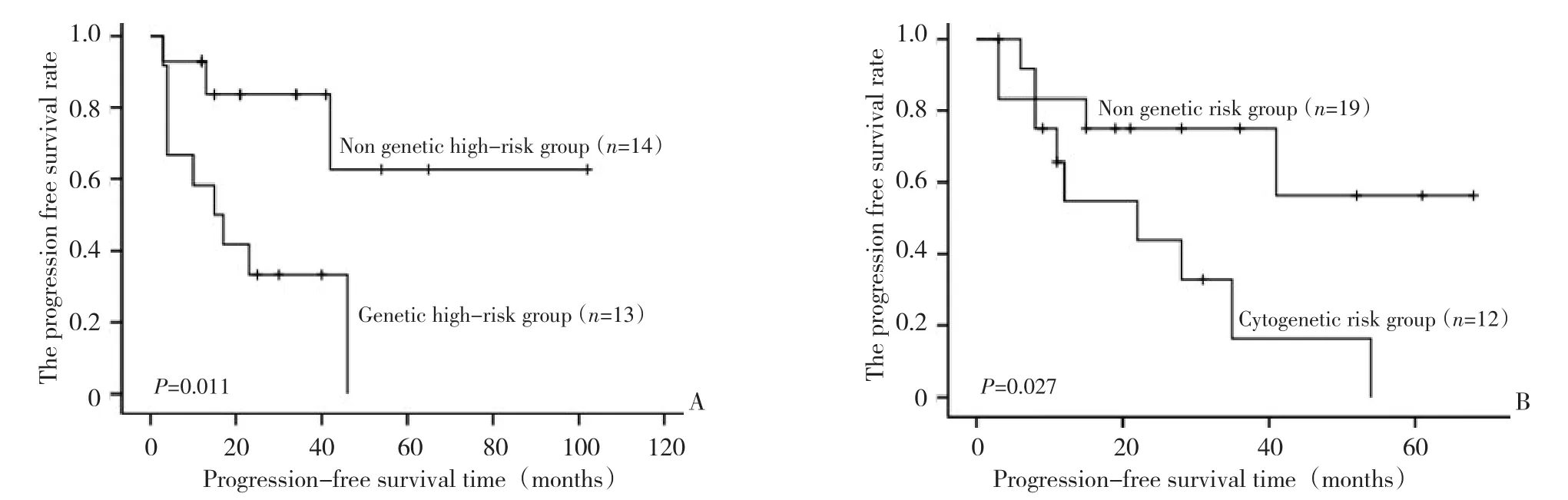
图2 FCR和FC组遗传学亚组患者PFS比较Figure 2 Comparison of PFS between the genetics subgroups patients in FCR and FC groups
3 讨论
总体上CLL是一种惰性疾病,中位生存10年左右。同时CLL又是一种异质性疾病,有些患者病情进展较快,生存期仅2~3年。传统治疗如瘤可宁或CHOP(长春新碱、环磷酰胺、阿霉素和泼尼松)不能使患者生存受益,且可能导致耐药形成,使患者对之后的挽救治疗失败。采用能提高患者治疗反应和延长生存的药物成为今后CLL治疗的趋势。
以氟达拉滨为代表的嘌呤核苷类似物的应用是近10年来CLL治疗上的重大进展。其代谢产物能抑制DNA和蛋白质合成,导致广泛的DNA断裂和细胞凋亡,对CLL患者特别是瘤可宁耐药的患者疗效较好[3]。多项研究表明相比传统药物,氟达拉滨单药或联合环磷酰胺能提高缓解率和PFS,且FC联合更优于F单用。美国E2997Ⅲ期随机临床试验[4]在288例初治CLL患者中比较了FC方案和单独F治疗的疗效,结果FC组CR率和ORR分别为23.4%和74.3%,单用F组CR率和ORR分别为4.6%和59.9%,两组CR率和ORR均有统计学差异,中位PFS时间FC组明显优于单独F组。
但无论是单用氟达拉滨还是联合环磷酰胺均不能改善患者的总生存期。利妥昔单抗能特异性靶向B淋巴细胞表面的糖蛋白CD20,通过抗体依赖的细胞毒作用(ADCC)和补体依赖的细胞毒(CDC)作用发挥抗肿瘤效应,还能直接诱导肿瘤细胞凋亡[5]。但CLL细胞CD20的表达较其他B细胞淋巴瘤低,利妥昔单抗在体内的半衰期短,因而其单药治疗CLL临床活性有限。体外实验证实氟达拉滨和利妥昔单抗联用具有协同作用。氟达拉滨能下调CLL细胞膜表面补体抑制蛋白CD46,CD55和CD59的表达水平,使CLL细胞对利妥昔单抗诱导的CDC作用更加敏感。反之利妥昔单抗能下调IL-10和BCL-2,使CLL细胞对氟达拉滨诱导的凋亡更加敏感[6]。利妥昔单抗联合FC(FCR)治疗能将初治患者的完全缓解率提高至44%~72%,总反应率提高至90%左右,且能延长患者的PFS和OS[7]。德国CLL研究组的一项多中心随机Ⅲ期临床研究[8]比较了FC联合或不联合利妥昔单抗治疗初治CLL患者的生存期和不良反应。其中FCR组患者3年PFS和OS率分别为65%和87%,FC组分别为45%和83%,前者3年PFS和OS均明显优于FC组。
FCR方案治疗复发难治CLL患者也优于FC方案,一项研究中评估了FCR方案治疗复发难治CLL患者的疗效,CR率约25%,ORR 73%左右,其中CR和PR患者中位至进展时间为39个月和15个月,中位总生存时间CR患者≥45个月,而PR患者为39个月[9]。一项国际、随机,Ⅲ期临床试验在552例复治CLL患者中比较了FCR和FC方案的疗效。FCR方案的CR率为24.3%,FC组CR率为13%(P<0.001),OR率为70%对58%(P=0.034),中位PFS FCR方案明显优于FC方案(30.6 vs.20.6个月,P<0.001),中位OS FCR方案和FC方案分别为未达到对52个月,但尚无统计学意义。目前各研究组认为FCR方案能改善初治CLL患者的PFS和OS,但对能否改善难治CLL患者OS时间报道不一[9-12]。
由于国内CLL发病率较低,缺乏使用FC或FCR的大样本的病例数报道,大多数单位仍采用将初治和复发的患者共同分析疗效。本研究两组患者中FCR组CR率44.4%,ORR 81.5%,FC组CR率19.4%,ORR 51.6%,结果介于国外报道的初治和复发患者的疗效之间。FCR组疗效明显优于FC组。国内李沛沛等[13]报道了21例FC方案治疗CLL患者的疗效,CR率为28.57%,ORR为57.14%。方成等[14]报道FCR方案治疗21例CLL患者的疗效,CR率为52.4%,ORR为85.7%。本组疗效略低于上述两组,主要原因可能为本组患者中高危遗传学患者较多(FC组:12/31例,FCR组:13/27例),李沛沛组病例中未涉及到遗传学结果,而方成组病例中高危遗传学患者仅为6例(6/21)。
治疗后缓解深度是预测PFS和OS的最重要的指标之一。德国CLL研究组(CLLSG)CLL8试验比较了493例随机接受FC和FCR方案治疗患者,结果显示FCR方案获得MRD阴性的患者数为FC方案的两倍。MRD低水平的患者PFS和OS优于MRD中高水平的患者,是预测PFS和OS的独立指标[14]。本组患者疗程结束后共有14例MRD检测阴性,MRD阴性组中位PFS和OS均明显优于阳性组,其中FCR组MRD阴性患者比例为37.0%,高于FC组12.9%(P=0.032)。本研究结果也显示两组患者中获得CR的患者PFS和OS优于未获得CR的患者,因而获得CR和治疗后MRD阴性是延长患者复发时间和总生存的重要因素。本研究结果FCR方案能使更多患者获得CR和深程度缓解,从而有可能进一步提高患者的PFS和OS。本组FCR和FC组患者的PFS和OS无明显差别,可能与本研究随访时间太短,病例数较少有关。
总之,本研究结果显示FCR方案治疗CLL患者完全缓解率和总反应率明显优于FC方案,且能使更多患者获得CR和深程度的治疗反应,是CLL患者的一种更为有效的治疗选择。但本组病例为回顾性研究,病例数尚少,随访时间尚短,今后还需更大样本研究结果来证实。
1 Lin TS.What is the optimal initial treatment for chronic lymphocyt⁃ic leukemia[J]?Oncology(Williston Park),2007,21(14):1641-1649.
2 Hallek M,Cheson BD,Catovsky D,et al.Guidelines for the diagno⁃sis and treatment of chronic lymphocytic leukemia:a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines[J].Blood,2008,111(12):5446-5456.
3 Guo B,Zhu HL,Fan H,et al.Individualized fludarabine-based regi⁃men in elderly patients with chronic lymphocytic leukemia/small lymphocytic lymphoma[J].Adv Ther,2012,29(2):178-186.
4 Flinn IW,Neuberg DS,Grever MR,et al.PhaseⅢ trial of fludara⁃bine plus cyclophosphamide compared with fludarabine for patients with previously untreated chronic lymphocytic leukemia:US Inter⁃group Trial E2997[J].J Clin Oncol,2007,25(7):793-798.
5 Keating MJ,O'Brien S,Albitar M,et al.Early results of a chemoim⁃munotherapy regimen of fludarabine,cyclophosphamide,and ritux⁃imab as initial therapy for chronic lymphocytic leukemia[J].J Clin Oncol,2005,23(18):4079-4088.
6 James DF,Kipps TJ.Rituximab in chronic lymphocytic leukemia[J].Adv Ther,2011,28(7):534-554.
7 Hillmen P.Using the biology of chronic lymphocytic leukemia to choose treatment[J].Hematology Am Soc Hematol Educ Program,2011,2011:104-109.
8 Hallek M,Fischer K,Fingerle-Rowson G,et al.Addition of ritux⁃imab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia:a randomised,open-label,phase 3 trial[J].Lancet,2010,376(9747):1164-1174.
9 Veliz M,Pinilla-Ibarz J.Treatment of relapsed or refractory chron⁃ic lymphocytic leukemia[J].Cancer Control,2012,19(1):37-53.
10 Robak T,Dmoszynska A,Solal-Céligny P,et al.Rituximab plus fludarabine and cyclophosphamide prolongs progression-free sur⁃vival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia[J].J Clin Oncol,2010,28(10):1756-1765.
11 Badoux XC,Keating MJ,Wang X,et al.Fludarabine,cyclophos⁃phamide,and rituximab chemoimmunotherapy is highly effective treatment for relapsed patients with CLL[J].Blood,2011,117(11):3016-3024.
12 Parikh SA,Keating MJ,O'Brien S,et al.Frontline chemoimmuno⁃therapy with fludarabine,cyclophosphamide,alemtuzumab,and rituximab for high-risk chronic lymphocytic leukemia[J].Blood,2011,118(8):2062-2068.
13 Li PP,Feng LL,Ge XL,et al.combination of cyclophosphamide and fludarabine in chronic lymphocytic leukemia treatment:21cases report[J].Journal of Leukemia&Lymphoma,2012,2(21):118-120.[李沛沛,封丽丽,葛学玲,等.氟达拉滨联合环磷酰胺方案治疗慢性淋巴细胞白血病21例[J].白血病·淋巴瘤,2012,2(21):118-120.]
14 Fang C,Xu W,Xu M,et al.Efficacy of combination chemoimmu⁃notherapy of fludarabine,cyclophosphamide and rituximab for chronic lymphocytic leukemia[J].Chinese Journal of Hematology,2011,32(1):3-7.[方成,徐卫,徐敏,等.氟达拉滨和环磷酰胺联合利妥昔单抗治疗慢性淋巴细胞白血病疗效分析[J].中华血液学杂志,2011,32(1):3-7.]
15 Böttcher S,Ritgen M,Fischer K,et al.Minimal residual disease quantification is an independent predictor of progression-free and overall survival in chronic lymphocytic leukemia:a multivariate analysis from the randomized GCLLSG CLL8 trial[J].J Clin On⁃col,2012,30(9):980-988.
