卵巢癌腹水CD4+CD25+调节性T细胞免疫抑制功能及机制的研究*
2014-05-25姚海荣李迎春张文琪
姚海荣 田 菁 李迎春 张文琪 郝 权
人体免疫系统正常情况下可以有效地维持抵抗外来病原侵袭、监视自身变异细胞及避免自身过度免疫反应的平衡状态。而肿瘤的形成可能是由于某些转化的细胞逃避机体免疫清除作用而得以持续发展[1]。CD4+CD25+调节性T细胞(regulatory T cells,Treg)是一群具有免疫调节功能的抑制性细胞亚群,在天然免疫和获得性免疫反应中均发挥重要的调节作用,在抗肿瘤免疫应答中也发挥抑制效应,介导肿瘤免疫逃逸[1-3]。目前许多研究发现,乳腺癌、卵巢癌、胃肠道肿瘤等多种肿瘤患者的外周血和肿瘤局部的Treg均增加[3]。本研究旨在探讨卵巢癌腹腔微环境内CD4+CD25+Treg发挥免疫调节功能与卵巢癌患者年龄、肿瘤病理类型、临床分期及分化程度是否相关,并探讨初治及复发卵巢癌腹水内Treg免疫调节功能差异,进一步分析Treg功能与患者疾病进展是否相关。并初步探讨卵巢癌腹水内Treg发挥作用的具体机制,为进一步针对卵巢癌的免疫治疗提供新的视角。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器 人CD4+Multisort kit、人CD25磁珠Ⅱ、MACS免疫磁珠分离仪(德国Miltenyi公司),人重组IL-2(美国Peprotech公司),人淋巴细胞CD3单克隆抗体、人淋巴细胞CD28单克隆抗体、CFSE(美国eBioscience公司),人中合性抗IL-10单克隆抗体、人中和性抗TGF-β1单克隆抗体(美国Ab⁃cam公司),鼠抗人CD4-FITC单克隆抗体、鼠抗人CD25-PE单克隆抗体、鼠FITC IgG 1同型对照抗体、鼠PE IgG 1同型对照抗体(美国BD Pharmingen公司),RPMI-1640培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),人外周血淋巴细胞分离液购自于天津灏洋生物公司。流式细胞分析采用FACScan分析(美国BD Biosciences公司),CFSE标记T细胞增殖采用Modfit软件进行数据分析。
1.1.2 病例收集 病例选自2012年3月至2013年8月期间就诊天津医科大学肿瘤医院28例卵巢癌患者,所有患者均经病理诊断或细胞学诊断证实,其中,浆液性卵巢癌20例,其他8例。根据FIGO分期,Ⅰ~Ⅱ期9例,Ⅲ~Ⅳ期标本19例。根据卵巢癌分化程度,G1级5例,G2级10例,G3级13例。根据采集标本时患者临床特征分为原发腹水标本(primary dis⁃ease,PD,初治患者)及复发腹水标本(recurrent dis⁃ease,RD,经过手术及化疗等抗肿瘤治疗后复发)。年龄在39~75岁,平均年龄60(60.04±9.04)岁(表1)。所有腹水标本收集于卵巢癌患者腹腔穿刺术后,采用无菌引流袋置于冰中运送进行后续实验,并于采集标本前取得了被采集人的知情同意,符合伦理学规定。
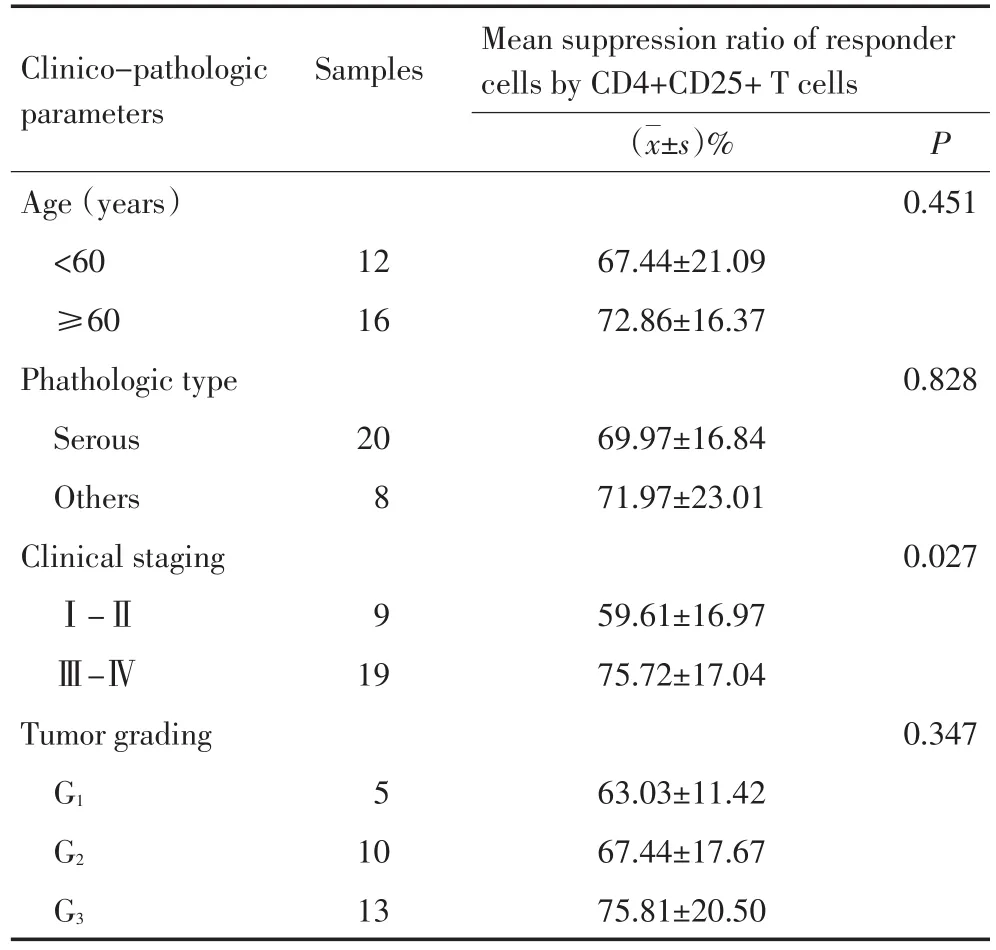
表1 卵巢癌腹水CD4+CD25+T细胞免疫抑制功能与临床病理特点的关系Table 1 Relationship between CD4+CD25+T cell-mediated immu⁃no-suppression in ascites of OC patients and clinico-pathologic features
1.2 方法
1.2.1 腹水内淋巴细胞的获取 卵巢癌患者无菌腹水标本于4℃,1 500 r/min离心10 min,PBS重悬,经40 μm滤器过滤去除细胞团。将75%Ficoll淋巴细胞分离液缓缓置于100%Ficoll淋巴细胞分离液上层,过滤后细胞悬液置于最上层,经密度梯度离心法分离腹水内淋巴细胞与肿瘤细胞[1],从而获取腹水内淋巴细胞用于后续实验。
腹水内CD4+CD25+T细胞的分选及鉴定 获取腹水内淋巴细胞悬液,经40μm滤器过滤后细胞计数,之后采用人CD4+Multisort kit获得CD4+T细胞,进一步对总CD4+T细胞通过人CD25的磁珠阳性分选,得到CD4+CD25+T细胞以及CD4+CD25-T细胞,操作严格按照试剂盒说明进行。分离所得的CD4+CD25+T细胞一部分经CD4-FITC单克隆抗体及CD25-PE单克隆抗体双标,流式检测浓度均>90%。
CD4+CD25+T细胞免疫抑制功能及其机制的探究 应用1.5 μmol/L的羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)标记分选所得CD4+CD25-T细胞(至少0.5×105个细胞),室温下孵育10 min,用预冷的胎牛血清终止标记反应,荧光显微镜下观察CFSE标记效果。将只含有CFSE标记的CD4+CD25-T细胞组作为对照组,其与自体CD4+CD25+Treg比例为1∶1或者1∶2下共培养,并分别加入/不加中和性抗IL-10单克隆抗体(2 μg/mL)、中和性抗TGF-β1单克隆抗体(20 μg/mL)及中和性抗IL-10单克隆抗体(2 μg/mL)和中和性抗TGF-β1单克隆抗体(20 μg/mL)作为实验组,其中每组共培养体系内均加入人淋巴细胞CD3单克隆抗体(1 μg/mL)、人淋巴细胞CD28单克隆抗体(1 μg/mL)以及人重组IL-2(150 IU/mL)作为激活因子。共培养5 d后,流式细胞仪检测CFSE表达,并使用Modfit软件分析CFSE数据计算各组增殖指数(PI),其中对照组抑制率为0,增值率为100%。
1.3 统计学方法
2 结果
2.1 卵巢癌腹水内CD4+CD25+调节性T细胞免疫抑制功能与临床病理特征的关系
28例卵巢癌患者腹水分选后所得CD4+CD25+调节性T细胞与CFSE标记的自体CD4+CD25-T细胞以1∶1的比例共培养,与仅有CFSE标记的自体CD4+CD25-T细胞的对照组增殖PI相比较,研究显示,腹水内CD4+CD25+Treg免疫抑制功能与患者年龄、病理类型及组织分化程度无关,而与患者肿瘤分期相关,且差异具有统计学意义。经Modfit软件测定各组CFSE标记T细胞增殖指数PI而得出Treg抑制率结果可见,19例Ⅲ~Ⅳ期卵巢癌患者腹水内Treg抑制自体CD4+CD25-T细胞增殖抑制率为(75.72±17.04)%,而9例Ⅰ~Ⅱ期卵巢癌患者腹水内Treg抑制率为(59.61±16.97)%,且差异具有统计学意义(P=0.027,图1,表1)。
2.2 初治与复发卵巢癌患者腹水CD4+CD25+T细胞免疫抑制功能的差异
15例复发卵巢癌患者腹水分选所得CD4+CD25+Treg对自体CD4+CD25-T细胞(比例为1∶1)增殖抑制率为(85.89±7.07)%,较13例初治卵巢癌患者腹水分选所得Treg免疫抑制能力(52.82±8.18)%显著增强,且差异具有统计学意义(P=0.000 1,图2,表2)。另外,卵巢癌患者在不同年龄、病理类型、肿瘤分期及肿瘤分化程度下,初治及复发卵巢癌患者腹水内Treg免疫抑制功能均有显著性差异,且差异有统计学意义(表3)。
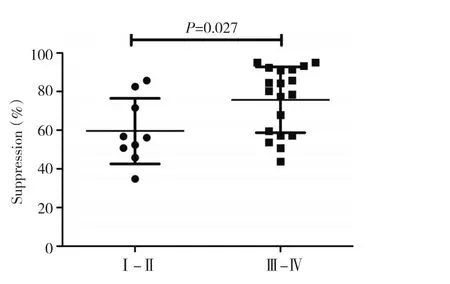
图1 不同肿瘤分期卵巢癌患者腹水内CD4+CD25+T细胞介导免疫抑制功能的差异Figure 1 Differences of CD4+CD25+Treg-mediated immuno-suppres⁃sion in ascites of OC patients with different tumor stages
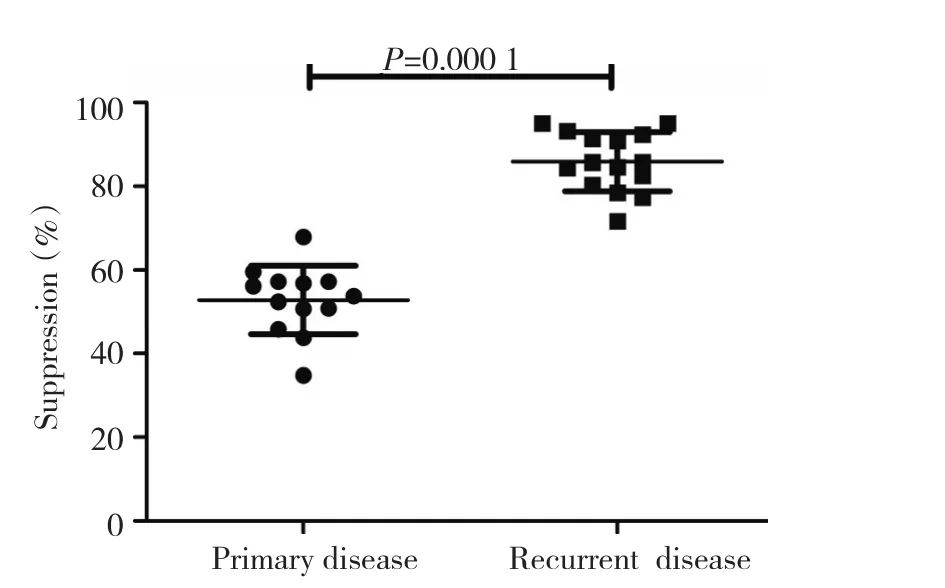
图2 初治与复发卵巢癌患者腹水CD4+CD25+T细胞介导免疫抑制功能的差异Figure 2 Differences of CD4+CD25+T cell-mediated immuno-suppres⁃sion in ascites of OC patients with primary and recurrent disease

表2 初治与复发卵巢癌患者腹水CD4+CD25+T细胞免疫抑制功能的差异Table 2 Differences of CD4+CD25+T cell-mediated immuno-suppres⁃sion in ascites of OC patients with the primary and recurrent diseases
2.3 卵巢癌患者腹水内CD4+CD25+Treg抑制功能机制的体外探究
本研究采用中和性抗IL-10抗体及中和性抗TGF-β1抗体探究卵巢癌腹水CD4+CD25+T细胞介导免疫抑制功能与抑制性细胞细胞因子IL-10及TGF-β1是否相关。结果显示,CD4+CD25+Treg与自体CD4+CD25-T细胞共培养体系内加入中和性抗IL-10抗体,在Treg/CD4+CD25-T细胞比例1∶1及1∶2下Treg对CD4+CD25-T细胞增殖抑制率为(44.30±12.04)% 及(55.42±5.11)% ,对 照 组 为(90.26±4.81)%及(76.78±6.11)%,且差异有统计学意义(n=3,P=0.004及 P=0.01,图 3A)。加入中和性抗TGF-β1抗体的实验组Treg对CD4+CD25-T细胞增殖抑制率(比例 1∶1,62.63%±6.76%;比例 1∶2,58.42%±3.31%)较对照组抑制率(比例1∶1,88.59%±2.75%;比例1∶2,74.45%±3.33%)增强,且差异有统计学意义(n=3,两组P=0.004,图3B)。另外,共同加入中和性抗IL-10抗体及中和性抗TGF-β1抗体的实验组内Treg对自体CD4+CD25-T细胞增殖抑制率在两者比例为 1∶1及 1∶2下分别为(18.26±2.42)%及(22.69±7.04)%,而对照组抑制率分别为(87.82±2.45)%及(73.15±3.39)%,差异有统计学意义(n=3,两组P=0.000 1,图3C)。
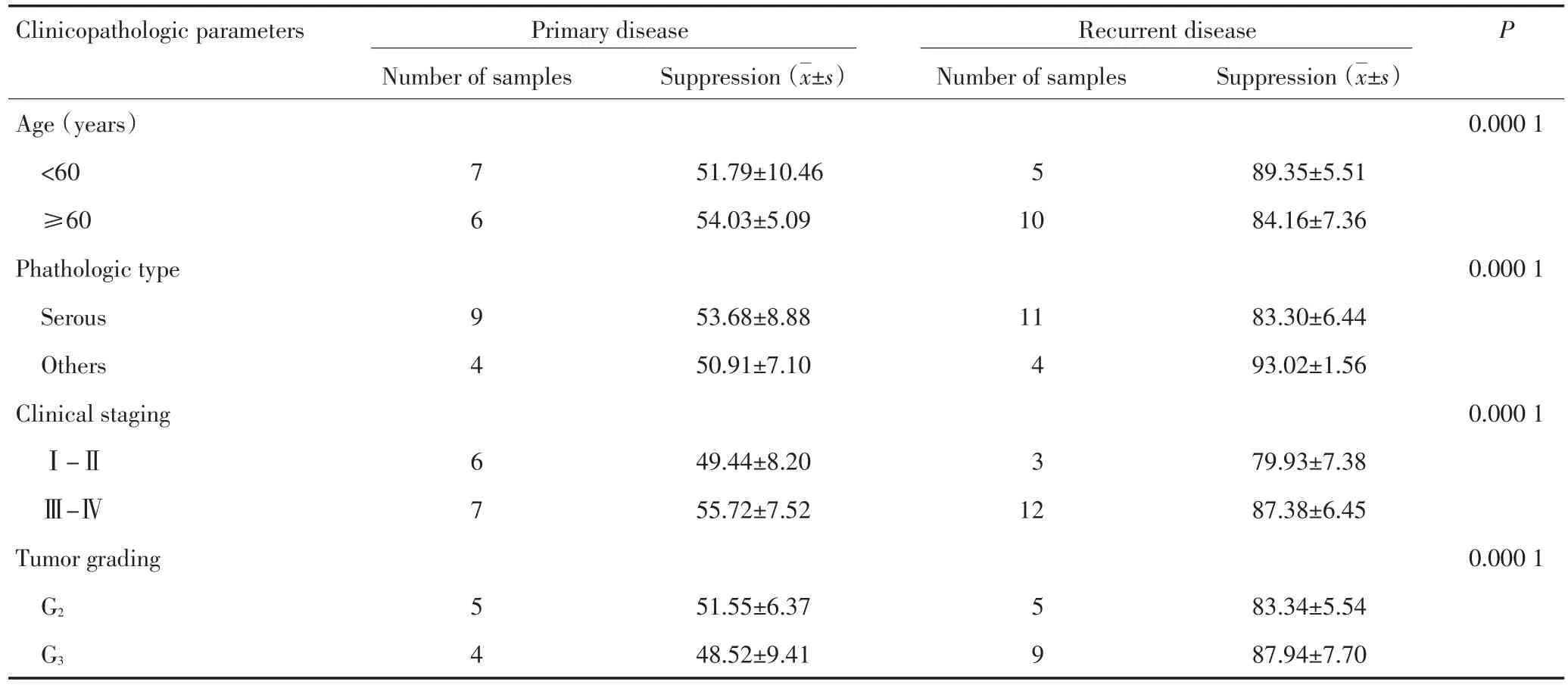
表3 不同临床病理特点下初治及复发卵巢癌腹水内CD4+CD25+T细胞免疫抑制功能的差异Table 3 Differences of CD4+CD25+T cell-mediated immuno-suppression in ascites of OC patients with primary and recurrent disease based on different clinico-pathologic features
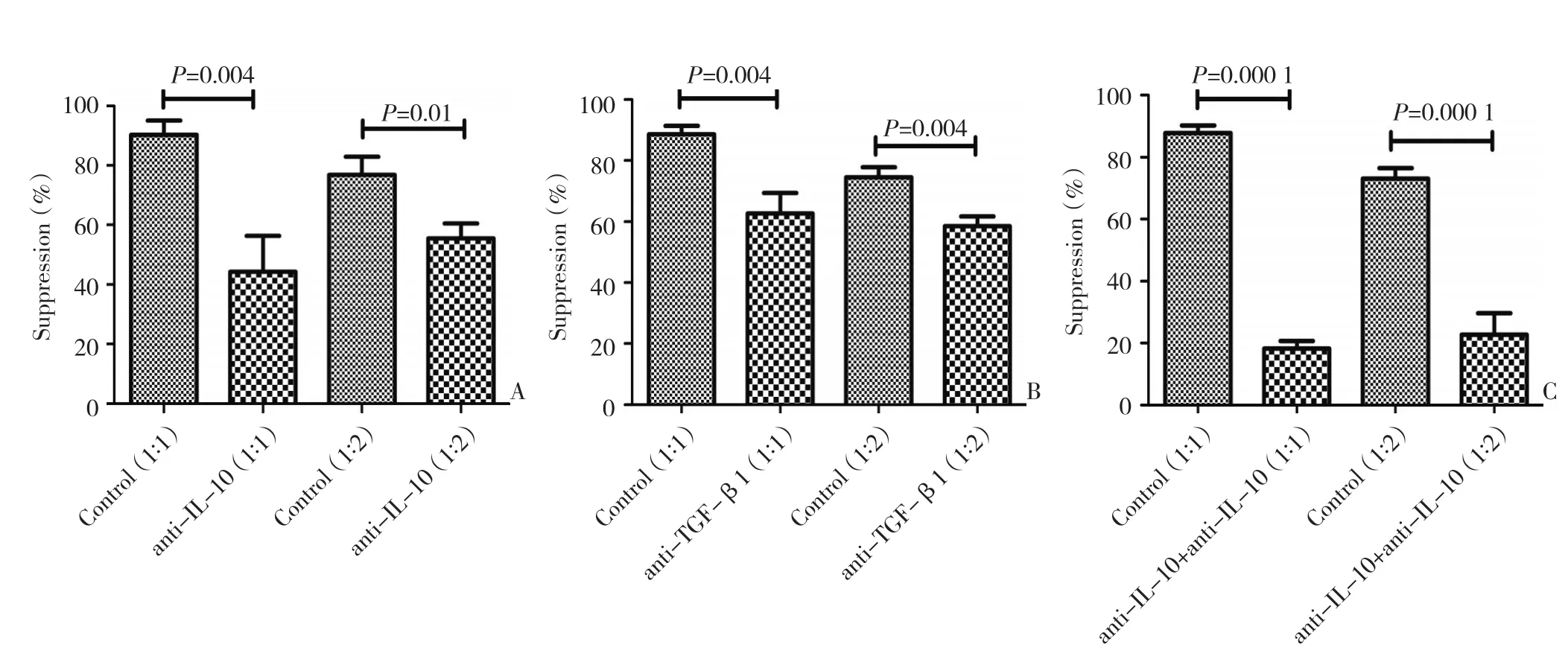
图3 卵巢癌腹水内Treg发挥免疫抑制功能机制Figure 3 Mechanism for suppression function of Treg obtained from ascites of OC patients
3 讨论
肿瘤患者体内许多可以被自体T细胞识别的肿瘤相关抗原目前已经被证明是自身的正常组分。通过外周耐受抑制自身反应性T细胞活性的机制,也同样影响着对肿瘤相关的自身抗原的应答,从而参与肿瘤在宿主体内发生和发展。而肿瘤细胞可以产生一系列逃避抗肿瘤免疫反应的机制,其中,CD4+CD25+Treg具有重要的免疫调节作用[1,5]。有研究表明,CD4+CD25+Treg可抑制机体的抗肿瘤免疫反应,减弱或抑制疫苗诱导的抗肿瘤免疫作用[6-7]。多种肿瘤患者外周血及肿瘤局部,调节性T细胞数量增多或比例增加,更是调节性T细胞参与肿瘤免疫逃逸的有力佐证[8-9]。有报道指出,观察卵巢癌患者肿瘤组织内CD8+T/Treg的比例比单独观察Treg细胞数量能更好地预测患者的存活率[10],预示Treg与效应T细胞相互作用对肿瘤发生、发展及预后有重要作用。
另外,在胃和食管癌的患者外周血中的动态监测发现晚期患者的CD4+CD25+Treg比例比早期患者高,手术切除后Treg比例降低,但是复发后Treg又上升[11]。而在头颈肿瘤研究中发现,经过手术、放化疗治疗的患者外周血Treg比例较原发肿瘤患者高,并且抑制功能增强[12]。有研究报道了从正常胰腺组织、不典型增生、原位癌直至进展期胰腺癌患者局部浸润Treg的表达分布情况,发现随着肿瘤的发生、进展,Treg数目、比例逐渐上升,而同时局部浸润的CD8+CTL则逐步减少乃至消失[13]。而在肝细胞癌的癌前病变、早期肿瘤和肿瘤的进展期,也有报道发现了完全一致的现象[14],提示Treg与肿瘤发生发展及预后之间的密切联系。本研究发现,28卵巢癌患者腹水内CD4+CD25+Treg经体外研究证实,在比例为1∶1下对自体CFSE标记的CD4+CD25-效应性T细胞增殖抑制率与肿瘤分期相关,Ⅲ~Ⅳ期患者腹水内Treg发挥免疫抑制功能明显强于Ⅰ~Ⅱ期卵巢癌患者腹水内Treg(P<0.05),且Treg发挥免疫调节功能与卵巢癌患者年龄、肿瘤病理类型及分化程度无关。另外,本研究证实复发卵巢癌患者腹水内CD4+CD25+Treg免疫抑制功能强于初治患者,且在各临床病理条件下,均具显著性差异(P<0.000 1),提示卵巢癌腹水CD4+CD25+Treg免疫调节功能与肿瘤进展相关。
已有研究表明,Treg抑制效应性T细胞的机制主要有两种,即细胞直接接触机制[15]和分泌抑制性细胞因子如IL-10及TGFβ1等的间接机制[12,15-17]。
在头颈肿瘤的研究中发现,肿瘤患者外周血及肿瘤微环境内Treg发挥免疫抑制功能与抑制性细胞因子IL-10及TGFβ1相关[17]。而卵巢癌患者腹腔微环境内Treg发挥作用的具体机制尚不明确。本实验通过体外实验证实,在CD4+CD25+Treg/CD4+CD25-T 细胞比例为1∶1及1∶2共培养体系内,无论是使用中合性抗IL-10抗体中和IL-10作用,还是使用中合性抗TGFβ1抗体中和IL-10阻断TGFβ1作用,或者共同封闭两种细胞因子作用,都明显解除了Treg细胞对效应性T细胞增殖的抑制作用(P<0.05),提示卵巢癌腹腔微环境内CD4+CD25+Treg可能通过分泌抑制性细胞因子IL-10及TGFβ1发挥作用。
综上所述,卵巢癌腹腔微环境内CD4+CD25+Treg发挥免疫抑制功能与卵巢癌分期及复发相关,且作用机制与分泌抑制性细胞因子IL-10及TGFβ1相关,为卵巢癌免疫治疗提供一种新的靶点。有关Treg的研究极大地丰富了人类对于肿瘤免疫和免疫逃逸机制的认识,也为以往多种肿瘤免疫治疗方案效果不佳的原因提供了新的解释,为肿瘤的免疫治疗提供更多新的思路。
1 Whiteside TL.What are regulatory T cells(Treg)regulating in can⁃cer and why[J]?Semin Cancer Biol,2012,22(4):327-34.
2 Weiss VL,Lee TH,Jaffee EM,et al.Targeting the right regulatory T-cell population for tumor immunotherapy[J].Oncoimmunolo⁃gy,2012,1(7):1191-1193.
3 Wolf AM,Wolf D,Steurer M.Increase of regulatory T cells in the peripheral blood of cancer patients[J].Clin Cancer Res,2003,9(2):606.
4 Lee SW,Kim YM,Lee HY,et al.Proliferation of CD4+CD25+Foxp3+regulatory T lymphocytes in ex vivo expanded ascitic fluid from primary and recurrent ovarian carcinoma[J].J Gynecol Oncol,2010,21(1):38-44.
5 Tanchot C,Terme M,Pere H,et al.Tumor-infiltrating regulatory T cells:phenotype,role,mechanism of expansion in situ and clini⁃cal significance[J].Cancer Microenviron,2013,6(2):147-157.
6 Cruriel TJ,Coukos G,Zou L,et al.Specific recruitment of regulato⁃ry T cells in ovarian carcinoma fosters immune privilege and pre⁃dicts reduced survival[J].Nat Med,2004,10(9):942-949.
7 Savage PA,Malchow S,Leventhal DS.Basic principles of tu⁃mor-associated regulatory T cell biology[J].Trends Immunol,2013,34(1):33-40.
8 Darrasse-Jèze G,Podsypanina K.How numbers,nature,and immune status of Foxp3+regulatory T-Cells shape the early immunological events in tumor development[J].Front Immunol,2013,4:292.
9 Shigematsu Y,Hanagiri T,Shiota H,et al.Immunosuppressive ef⁃fect of regulatory T lymphocytes in lung cancer,with special refer⁃ence to their effects on the induction of autologous tumor-specific cytotoxic T lymphocytes[J].Oncol Lett,2012,4(4):625-630.
10 Sato E,Olson SH,Ahn J,et al.Intraepithelial CD8+tumor-infiltrat⁃ing lymphocytes and a high CD8+/regulatory T cell ratio are associ⁃ated with favorable prognosis in ovarian cancer[J].Proc Natl Acad Sci USA,2005,102(51):18538-18543.
11 Zhao Y,Wu K,Cai K,et al.Increased numbers of gastric-infiltrat⁃ing mast cells and regulatory T cells are associated with tumor stage in gastric adenocarcinoma patients[J].Oncol Lett,2012,4(4):755-758.
12 Strauss L,Bergmann C,Gooding W,et al.The frequency and sup⁃pressor function of CD4+CD25highFoxp3+T cells in the circula⁃tion of patients with squamous cell carcinoma of the head and neck[J].Clin Cancer Res,2007,13:6301-3111.
13 Hiraoka N,Onozato K,Kosuge T,et al.Prevalence of FOXP3+reg⁃ulatory T cells increases during the progression of pancreatic ductal adenocarcinoma and its premalignant lesions[J].Clin Cancer Res,2006,12(18):5423-5434.
14 Kobayashi N,Hiraoka N,Yamagami W,et al.FOXP3+regulatory T cells affect the development and progression of hepatocarcinogen⁃esis[J].Clin Cancer Res,2007,13(3):902-911.
15 Hamza E,Gerber V,Steinbach F,et al.Equine CD4(+)CD25(high)T cells exhibit regulatory activity by close contact and cytokine-de⁃pendent mechanisms in vitro[J].Immunology,2011,134(3):292-304.
16 Kawakami Y1,Yaguchi T,Sumimoto H,et al.Improvement of can⁃cer immunotherapy by combining molecular targeted therapy[J].Front Oncol,2013,3:136.
17 Strauss L,Bergmann C,Szczepanski M,et al.A unique subset of CD4+CD25 high Foxp3+T cells secreting IL-10 and TGF-β1 me⁃diates suppression in the tumor microenvironment[J].Clin Cancer Res,2007,13:4345-4354.
