转移因子胶囊中多肽与核糖含量测定方法研究
2014-05-25周天琼俞保彬倪燕红周一峰毛建卫
周天琼,俞保彬,倪燕红,周一峰,毛建卫
(1.杭州华津药业股份有限公司,杭州 310013;2.浙江科技学院 生物与化学工程学院,杭州 310023;3.浙江省农产品化学与生物加工技术重点实验室,杭州 310023)
转移因子胶囊中多肽与核糖含量测定方法研究
周天琼1,俞保彬1,倪燕红1,周一峰2,3,毛建卫2,3
(1.杭州华津药业股份有限公司,杭州 310013;2.浙江科技学院 生物与化学工程学院,杭州 310023;3.浙江省农产品化学与生物加工技术重点实验室,杭州 310023)
研究了转移因子胶囊的多肽与核糖含量测定方法。分别对福林酚法和紫外-可见分光光度法测定转移因子胶囊多肽和核糖含量的方法进行了考察。福林酚法对牛血清白蛋白在30~300μg/mL范围内线性关系良好(r=0.999 0),平均加样回收率为99.77%,RSD为1.31%;紫外-可见分光光度法对D-核糖2~10μg/mL范围内线性关系良好(r=0.999 7),平均加样回收率99.99%,RSD为1.02%。以上分析方法简便、快速、准确,可作为转移因子胶囊多肽与核糖含量分析的方法。
转移因子胶囊;多肽;核糖;含量测定
转移因子(transfer factor,TF)是T淋巴细胞释放的一种能够转移致敏信息的物质,它能够特异地将供体的细胞免疫信息转移给受体,从而增强受体的免疫功能。转移因子为具有生物活性的非均一性的小分子混合物,其内含物包括游离氨基酸(16~18种)、核酸、多肽,以及K、Na、Ca、Mg、Zn等金属元素[1]。转移因子是小分子物质,不会被胃蛋白酶、胰蛋白酶分解,也不会被胃酸破坏,可口服,无抗原性,无毒副作用和种属差异性,是一种新型而又安全的免疫制剂[2]。转移因子胶囊中的主要有效成分为多肽和核苷酸(以D-核糖计),可特异或非特异性地调节机体免疫状态、增强其细胞免疫和骨髓造血功能。本研究对转移因子胶囊的多肽与核糖含量测定方法进行了探讨。
1 仪器与试药
紫外-可见分光光度计(TU-1800SPC)。牛血清白蛋白对照品、D-核糖对照品(中国食品药品检定研究院);转移因子胶囊(对照药:南京瑞尔医药有限公司,批号为20101101;自制供试样品:批号为110301、110302、110303);碳酸钠、氢氧化钠、酒石酸钾钠、硫酸铜均为分析纯;福林酚试液按中国药典2010年版二部附录XV B[3]配制;水为纯化水。
2 转移因子胶囊中多肽含量测定方法研究
2.1 对照品溶液的制备
取牛血清白蛋白对照品,用水制成1 mL中含0.292 mg的溶液,即得。
2.2 线性关系考察
精密量取上述对照品溶液0.0、0.1、0.3、0.5、0.7、0.9 mL,分别置具塞试管中,各加水至1.0 mL,再分别加入碱性铜试液(取氢氧化钠10 g,碳酸钠50 g,加水400 mL使其溶解,作为甲液;取酒石酸钾0.5 g,加水50 mL使其溶解,另取硫酸铜0.25 g,加水30 mL使其溶解,将两液混合作为乙液。临用前,合并甲、乙两液,并加水至500 mL)1.0 mL,混匀,各加入福林酚试液[3](取福林试液中的储备液1→16)4.0 mL,立即摇匀,置55℃水浴中准确反应5 min,置冷水浴中10 min,以相应的试剂为空白,在650 nm的波长处测定吸光度,结果见表1。以吸光度A为纵坐标,质量浓度值c为横坐标,绘制标准曲线,计算回归方程得A=0.003 2c+0.057 5(r=0.999 0)。结果表明,牛血清白蛋白在30~300μg/mL范围内,线性关系良好。

表1 牛血清白蛋白含量测定线性关系考察试验结果Table 1 Experimetal results for investigation of linear relationship of content determination for bovine serum albumin
2.3 专属性试验
为考察转移因子胶囊所用辅料对多肽含量测定的影响,制备了不含转移因子的空白辅料胶囊,按照2.2方法进行测定,结果未检出多肽,说明所用辅料对多肽含量测定无影响。
2.4 稳定性试验
取转移因子胶囊(批号:110301)内容物适量,加水溶解后稀释制成150μg/mL的溶液,过滤;精密量取滤液1.0 mL,按照2.2方法进行试验,每隔0.5 h测定吸光度,试验数据见表2。结果显示,供试品溶液在3 h内稳定。
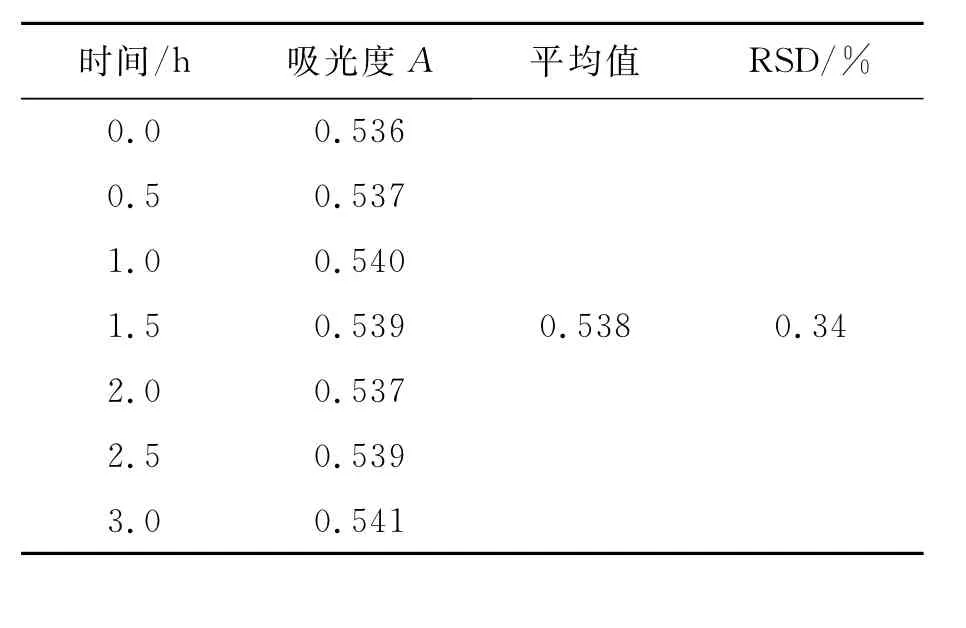
表2 转移因子胶囊中多肽分析的稳定性试验结果Table 2 Stability experimental results of polypeptide in transfer factor capsules
2.5 重复性试验
分别取供试品(批号:110301)内容物适量,加水溶解后稀释制成120、150、180μg/mL的溶液,过滤,精密量取滤液1.0 mL,按2.2方法分别重复测定6次,各质量浓度项下的RSD均小于2%,试验测定重复性好(表3)。
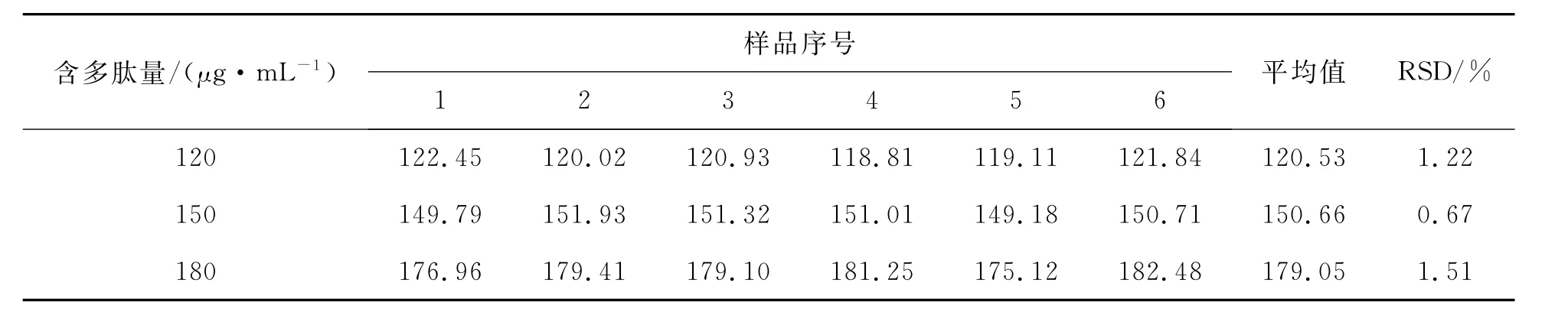
表3 转移因子胶囊中多肽分析的重复性试验结果(n=6)Table 3 Repeatability experimental results of polypeptide in transfer factor capsules(n=6)
2.6 加样回收率试验
精密称取供试品(批号:110301)内容物适量,加水溶解后稀释制成250μg/mL的供试品溶液;取牛血清白蛋白对照品适量,加水制成250μg/mL的对照品溶液;分别取供试品溶液和对照品溶液24、30、36 mL,混匀,加水稀释至100 mL,得多肽120、150、180μg/mL的溶液,按照2.2方法测定其多肽含量,计算平均回收率:

结果显示,平均回收率为99.77%,RSD 1.31%。试验数据见表4。
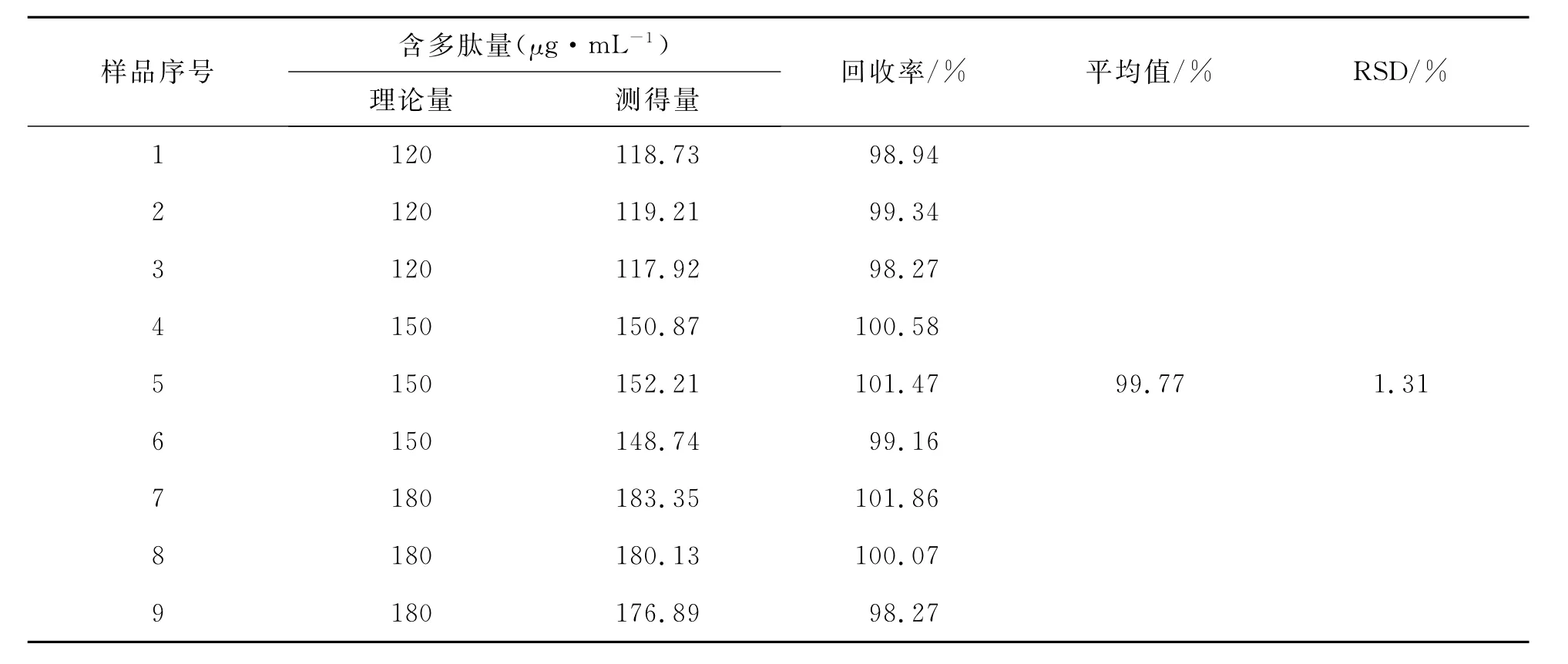
表4 转移因子胶囊中多肽分析的加样回收率试验结果(n=9)Table 4 Recovery experimental results of polypeptide in transfer factor capsules(n=9)
2.7 各批样品多肽含量测定
取转移因子胶囊对照品和供试品内容物适量(约相当于多肽15 mg),精密称定,置100 mL量瓶中,加水适量,振摇使其溶解,加水稀释至刻度,摇匀,过滤,取滤液作为供试品溶液。精密量取供试品溶液1.0 mL,按照2.2方法测定,由回归方程计算多肽含量,结果见表5。结果表明,各个供试样品的多肽含量均在标示量的90.0%~130.0%范围内,符合质量标准规定。

表5 转移因子胶囊多肽含量测定结果Table 5 Determination results of polypeptide in transfer factor capsules
3 转移因子胶囊中核糖含量测定方法研究
3.1 对照品溶液的制备
精密称取D-核糖对照品适量,用5%三氯醋酸溶液溶解并制成20μg/mL的溶液,摇匀。
3.2 线性关系考察
精密量取对照品溶液0.0、0.2、0.4、0.6、0.8、1.0 mL分别置具塞试管中,各加入5%三氯醋酸溶液适量至2.0 mL,各加入1%的3,5-二羟基甲苯溶液2.0 mL,摇匀,置沸水浴中准确加热30 min,迅速冷却至室温,以相应的试剂为空白,在650 nm的波长处测定吸光度,结果如表6所示。以吸光度A为纵坐标,质量浓度值c为横坐标,绘制标准曲线,计算得回归方程A=0.067 4c-0.025 2(r=0.999 7)。结果表明,D-核糖在2~10μg/mL范围内,线性关系良好。
3.3 专属性试验
为考察转移因子胶囊所用辅料对核糖含量测定的影响,制备了不含转移因子的空白辅料胶囊,按照3.2 方法进行含量测定,结果未检出核糖,说明所用辅料对核糖含量测定无影响。
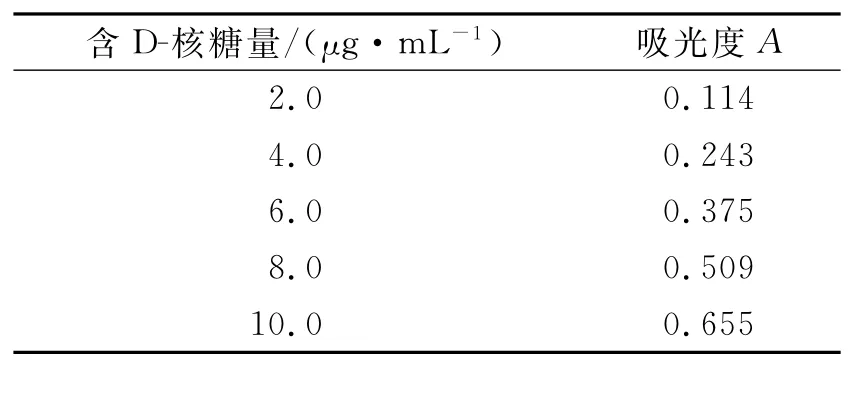
表6 D-核糖线性关系考察试验结果Table 6 Experimental results for investigation of linear relationship of D-ribose
3.4 稳定性试验
取供试品(批号:110301)内容物适量,加5%三氯醋酸溶液依法制成5μg/mL的供试品溶液,按照3.2进行核糖含量测定,每隔0.5 h测定吸光度A,数据见表7。结果显示,供试品溶液在3 h内稳定。
3.5 重复性试验
取供试品(批号:110301)内容物适量,加5%三氯醋酸溶液依法制成4、5、6μg/mL的供试品溶液,按照3.2方法分别重复测定6次,数据见表8。结果表明,该法测定核糖含量重复性良好。
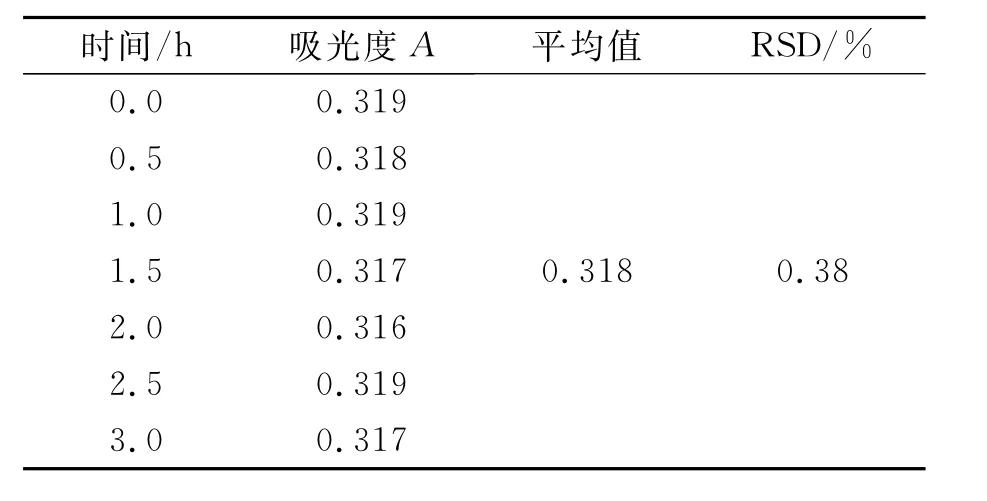
表7 转移因子胶囊中核糖分析的稳定性试验结果Table 7 Stability experimental results of ribose in transfer factor capsules
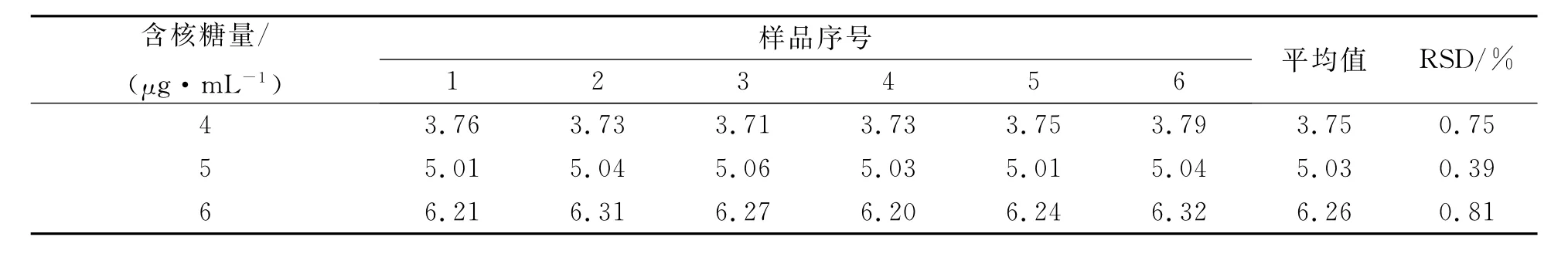
表8 转移因子胶囊中核糖分析的重复性试验结果Table 8 Repeatability experimental results of ribose in transfer factor capsules
3.6 加样回收率试验
精密称取供试品(批号:110301)内容物适量,加5%三氯醋酸溶液依法制成20μg/mL的样品溶液,取D-核糖对照品溶液(20μg/mL),与样品溶液按照1∶1比例制成含核糖量分别为4、5、6μg/mL的供试品溶液,按照3.2方法测定其核糖含量,计算核糖回收率,数据见表9。结果显示平均回收率为99.99%,RSD 1.02%。

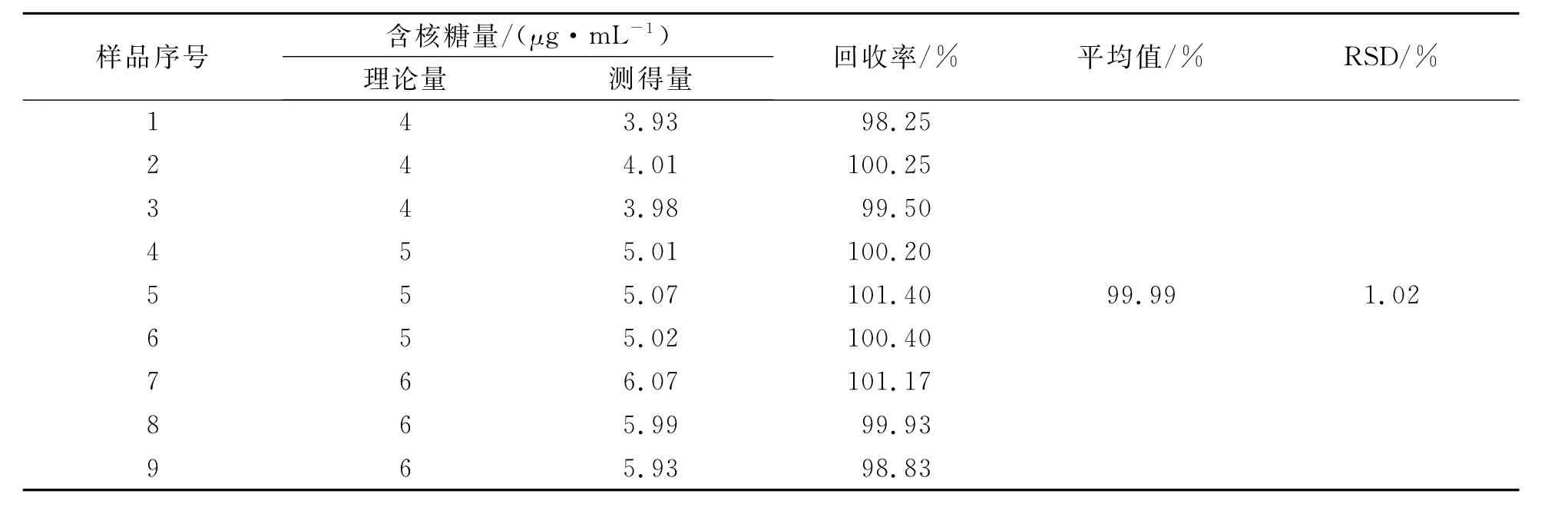
表9 转移因子胶囊中核糖分析的加样回收率试验结果(n=9)Table 9 Recovery experimental results of ribose in transfer factor capsules(n=9)
3.7 各批次样品核糖含量测定
取转移因子胶囊对照药和供试品的内容物适量进行精密称定,用5%三氯醋酸溶液制成5μg/mL的溶液,过滤,取滤液作为供试品溶液。精密量取供试品溶液2.0 mL,按照3.2 方法测定,由回归方程求出核糖含量结果见表10。结果表明,各个供试样品的核糖含量均高于标示量的80%,符合质量标准规定。
4 结 语
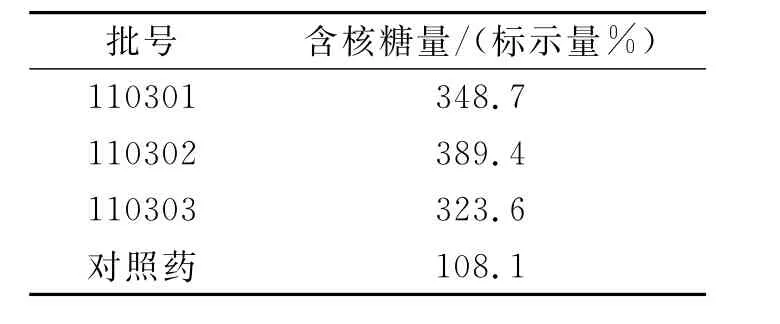
表10 转移因子胶囊中核糖含量测定结果Table 10 Determination results of ribose in transfer factor capsules
转移因子胶囊主要成分为从健康猪脾脏中提取的多肽、氨基酸和多核苷酸等。临床可用于辅助治疗抗生素难以控制的病毒性或霉菌性细胞内感染,如带状疱疹、流行性乙型脑炎、白色念珠菌感染和病毒性心肌炎等;对恶性肿瘤可作为辅助治疗剂;对免疫缺陷病,如湿疹、血小板减少、多次感染综合症及慢性皮肤黏膜真菌病,有一定的疗效[4-5]。
已有报道表明,转移因子类产品多肽和核糖含量测定常受到如试剂、制剂辅料等多种因素的影响[6-7]。本研究对福林酚法和紫外-可见分光光度法测定转移因子胶囊中多肽和核糖含量的方法进行了考察,试验结果显示,以上方法简便、快速、准确,具有重复性好、准确度高的优点,适用于转移因子胶囊中多肽和核糖含量的测定。
[1] 付旭彬,张少华,李守军.脾脏转移因子的研究进展[J].畜禽业,2003(7):10-11.
[2] 郭成留,程会昌.动物转移因子及其研究进展[J].河南农业科学,2003(6):46-48.
[3] 国家药典委员会.中华人民共和国药典:二部[M].北京:中国医药科技出版社,2010.
[4] 任建平.转移因子胶囊联合阿德福韦酯对慢性乙型肝炎患者肝功能及血清细胞因子的影响[J].医学综述,2013,19(7):1337-1338.
[5] 陈新平.依匹斯丁联合转移因子胶囊治疗慢性荨麻疹临床研究[J].亚太传统医药,2013,9(13):178-179.
[6] 杨威.转移因子的质量控制及影响因素分析[J].长春理工大学学报:自然科学版,2011,34(12):125-128.
[7] 蒋微琴,许晓燕,黄岩山,等.甘露醇对转移因子口服冻干粉制剂中多肽含量测定的影响[J].科技通报,2008,24(6):827-831.
Research on determination for polypeptide and ribose in transfer factor capsules
ZHOU Tianqiong1,YU Baobin1,NI Yanhong1,ZHOU Yifeng2,3,MAO Jianwei2,3
(1.Hangzhou Huajin Pharmaceutical Co.,Ltd.,Hangzhou 310013,China;2.School of Biological and Chemical Engineering,Zhejiang University of Science and Technology,Hangzhou 310023,China;3.Zhejiang Provincial Key Laboratory for Chemical and Biological Processing Technology of Farm Produce,Hangzhou 310023,China)
The analytical methods for polypeptide and ribose in transfer factor capsule were studied.The feasibility of Folin phenol method and UV-vis spectrophotometry method for polypeptide and ribose were investigated.The linear range of bovine serum albumin is 30-300 μg/m L(r=0.999 0),and the average recovery of bovine serum albumin is 99.77%(RSD 1.31%).The linear range of D-ribose is 2-10μg/m L(r=0.999 7),and the average recovery of D-ribose is 99.99%(RSD 1.02%).The methods reported in this paper are efficient,accurate and suitable for determination for polypeptide and ribose in transfer factor capsules.
transfer factor capsules;polypeptide;ribose;content determination
R927.2
A
1671-8798(2014)03-0172-05
10.3969/j.issn.1671-8798.2014.03.003
2014-03-05
浙江省农业科技成果转化项目(浙科发农[2013]171号-19)
周天琼(1981― ),女,四川省成都人,工程师,主要从事生物医药原料药、中间体和药物制剂的研究和开发。
毛建卫,教授,主要从事食品、生物活性物、医药合成等的生物化工研究和开发。
