添加辅酶前体及流加诱导物提高黄嘌呤氧化酶发酵产率
2014-05-21张玉然杨海麟
张玉然, 杨海麟, 辛 瑜, 张 玲, 王 武
(江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
黄 嘌 呤 氧 化 酶 (xanthine oxidase,XOD,EC 1.17.3.2),为胞内诱导酶,含钼蝶呤、铁硫簇及FAD辅因子。可将次黄嘌呤氧化酶黄嘌呤,继而氧化为尿酸,是嘌呤代谢的关建酶,与心血管疾病及系统先天免疫有关[1]。黄嘌呤氧化酶是一种重要的诊断用酶[2-3],在食品工业中,亦可用于检测肉类中嘌呤含量[4]。
国内外关于黄嘌呤氧化的研究,主要集中于酶在各物种中的分布[5-6]、活力调节[7]、与疾病的关系[8-9]等。关于黄嘌呤氧化酶发酵的研究报道也多集中于菌种选育及摇瓶水平上的发酵条件优化[10-11]。黄嘌呤氧化酶发酵的有效控制策略、合理流加发酵方法及产酶代谢等有待于研究。
当代谢产物的产量受某种组分浓度影响时,流加发酵法因可以解除底物的抑制、产物的反馈抑制等优势,被广泛应用[12-13]。相对于分批发酵,流加发酵可以提高有用产物的转化率。黄嘌呤属于胞内诱导酶,过量加入诱导物将抑制菌体生长和产酶,而对其流加发酵的研究报道较少。
由京都基因与基因组百科全书(KEGG)报道的节杆菌嘌呤代谢图知,嘌呤降解代谢需一系列酶系共同作用,黄嘌呤氧化酶参与前期次黄嘌呤、黄嘌呤的降解,后续酶系最终将尿酸降解为氨,中间代谢产物涉及尿酸、尿囊素、尿囊酸等。有关文献报道,在Neurospora crassa嘌呤降解代谢中,某些代谢产物达到一定浓度时,将抑制嘌呤降解酶系中相关酶的继续合成,进而抑制嘌呤降解[14]。关于节杆菌嘌呤降解代谢产物与黄嘌呤氧化酶合成之间的关系研究报道极少。
作者对黄嘌呤氧化酶产生菌进行分子鉴定,并构建系统发育进化树;添加辅酶前体(核黄素、硫胺素)不同程度提高了发酵产酶;在7.5 L发酵罐中,利用流加发酵方法,提高发酵液黄嘌呤氧化酶产率,并测定分批发酵过程中的代谢终产物铵根离子的变化,分析铵根离子与黄嘌呤氧化酶发酵的关系。研究提高黄嘌呤氧化酶发酵产率的方法,探索影响发酵产酶的关键因素,可为黄嘌呤氧化酶的进一步发酵放大生产奠定基础。
1 材料与方法
1.1 菌种来源
菌种为作者所在实验室保藏菌种,经形态及生理生化初步鉴定为节杆菌属,命名为ArthrobacterM3。
1.2 培养基
种子培养基 (g/L):氯化钠 5.0,酵母抽提物2.4,三水磷酸氢二钾 1.0,玉米浆 6.0 mL(pH 7.5)。
发酵基本培养基 (g/L):葡萄糖 13.0,氯化钠5.0,酵母抽提物 2.4,三水磷酸氢二钾 0.8,玉米浆6.0 mL,无水氯化钙 0.1,六水氯化镁 0.2,七水硫酸亚铁 1.0 mg,二水钼酸钠 15.0 μg,次黄嘌呤 3.0。
1.3 主要材料
细菌基因组DNA小量快速抽提试剂盒:北京博大泰克生物基因技术有限责任公司产品;黄嘌呤、次黄嘌呤:上海双向西巴斯科技发展有限公司产品;辣根过氧化物酶:上海生工生物工程有限公司产品;酵母粉:英国Oxford公司产品;玉米浆:山东菱花味精股份有限公司产品;其它化学试剂均为分析纯。
1.4 主要仪器
7.5 L 发酵罐(BioFlo 115):美国 New Brunswick Scientific公司产品;V1100D可见分光光度计:上海美谱达仪器有限公司产品;电热恒温水浴锅:金坛市城东科辉仪器厂产品;pH计(PB-10型):德国赛多利斯股份有限公司产品;HYL-A双层全温摇瓶柜:太仓市强乐实验设备有限公司产品;LaChrom C18-AQ反相色谱柱及日立高效液相色谱仪:日立高新技术公司产品。
1.5 培养方法
1.5.1 种子培养 从固体斜面培养基中,挑取3环菌泥接入30 mL种子培养基 (250 mL三角瓶),30℃、220 r/min摇瓶培养12 h。
1.5.2 发酵培养 摇瓶培养:将种子培养液接入发酵培养基,接种量为3%,发酵培养基装液量为120 mL/L,30 ℃、220 r/min摇瓶培养 18 h。
发酵罐培养:7.5 L全自动发酵罐中装液量共3.2 L(接种量3%),搅拌转速500 r/min,通气量1.0 L/(L·min),30 ℃。 前期不控制 pH(初始 pH 8.6),待菌体密度约2.0 g/L时,采用2.0 mol/L氢氧化钠和2.0 mol/L盐酸控制发酵液pH恒定7.6。
1.6 分析方法
1.6.1 菌体量测定 采用比色法(λ=600 nm)和细胞干重法,取一定量发酵液于8 000 g下离心10 min,菌泥于105℃烘至恒重,称重,计算菌体浓度。1.6.2 诱导物浓度测定 采用日立LaChrom C18-AQ (4.6 mm×250 mm,5 μm)反相柱进行测定。 测定条件:流动相V(磷酸二氢钾缓冲液,20 mmol/L,pH 7.5)∶V (乙腈)=95∶5, 流量 0.4 mL/min, 进样量 20 μL,检测波长254 nm。
1.6.3 铵根离子浓度测定 采用苯酚-次氯酸方法[15],向 2 mL A 液(10 g/L苯酚,0.029 g/L亚硝基铁氰化钠)中加入稀释适当倍数的发酵液样品100 μL,混匀,加入2 mL B液(6 g/L氢氧化钠,6 mL/L次氯酸钠),37℃水浴反应20 min,于550 nm下测定吸光值。
1.6.4 XOD酶活测定 黄嘌呤氧化酶测定方法详见参考文献[16]。酶活力单位定义:在37℃下,每分钟形成1 μmol过氧化氢所需的酶量定义为1个酶活单位(U)。
定义:黄嘌呤氧化酶产率即为菌体破壁后测得的对应发酵酶活(U/L);平均产率系数即为发酵t小时单位菌体产酶量(U/g)。
1.7 菌株16S rDNA序列分析及系统进化树构建
以提取的Arthrobacter M3总DNA为模板,通用引物27F和1492R为引物,进行16S rDNA的PCR扩增。PCR程序设定:94℃预变性5 min;94℃45 s,55 ℃ 45 s,72 ℃ 90 s, 循环扩增 30 次,72 ℃延伸10 min。电泳检测,扩增产物通过上海生工生物工程有限公司测序。测序结果提交至NCBI,进行BLAST同源序列搜索比对,利用CLUSTAL X 2.0及MEGA 4.0软件进行构建系统进化树。
1.8 流加发酵方式
补料方式1:补料1次,添加4.0 g/L葡萄糖、补次黄嘌呤质量浓度至3.6 g/L。
补料方式2:分批补料3次,每次添加4.0 g/L葡萄糖及补次黄嘌呤质量浓度至3.6 g/L。
2 结果与讨论
2.1 16S rDNA序列分析及系统进化树构建
将PCR扩增产物,割胶测序得到16S rDNA序列,通过NCBI进行同源比较,结果显示同源性较高的菌为Arthrobacter sp.,同源性均为99%,这与前期经形态及生理生化初步鉴定结果一致。采用CLUSTAL X 2.0及MEGA 4.0软件进行系统发育树分析,结果见图1。结果显示,与此Arthrobacter M3菌株同源性较高的菌株为Arthrobacter globiformis strain DSM 20124,因此进一步鉴定菌株Arthrobacter M3为球形节杆菌(Arthrobacter globiformis)。

图1 基于16S rDNA序列同源性构建菌株的系统发育进化树Fig.1 Phylogenetic tree based on 16S ribosomal DNA sequences of M3
2.2 诱导物浓度对XOD分批发酵的影响
经前期研究发现,Arthrobacter M3黄嘌呤氧化酶为诱导型酶,最佳诱导物为次黄嘌呤。由图2可知,最佳诱导物质量质量浓度为3.6 g/L,相对于未添加诱导物时,XOD产率提高了7.3倍。但过高次黄嘌呤的添加对菌体生长及产酶都有抑制作用。后期将采用流加发酵的方法,以进一步提高发酵产酶。

图2 次黄嘌呤质量浓度对菌体发酵产酶的影响Fig.2 Influence of different hypoxanthine concentrations on XOD fermentation
2.3 辅酶前体添加提高分批发酵产酶
2.3.1 核黄素添加影响发酵产酶 由图3可知,添加不同浓度的核黄素影响Arthrobacter M3产黄嘌呤氧化酶。最佳添加质量浓度为0.3 mg/L,黄嘌呤氧化酶产率提高了25.5%。这可能是由于黄嘌呤氧化酶含有FAD辅因子,核黄素作为FAD的前体物质,添加入培养基后,有利于菌体快速合成足够的FAD,从而提高菌体产酶。
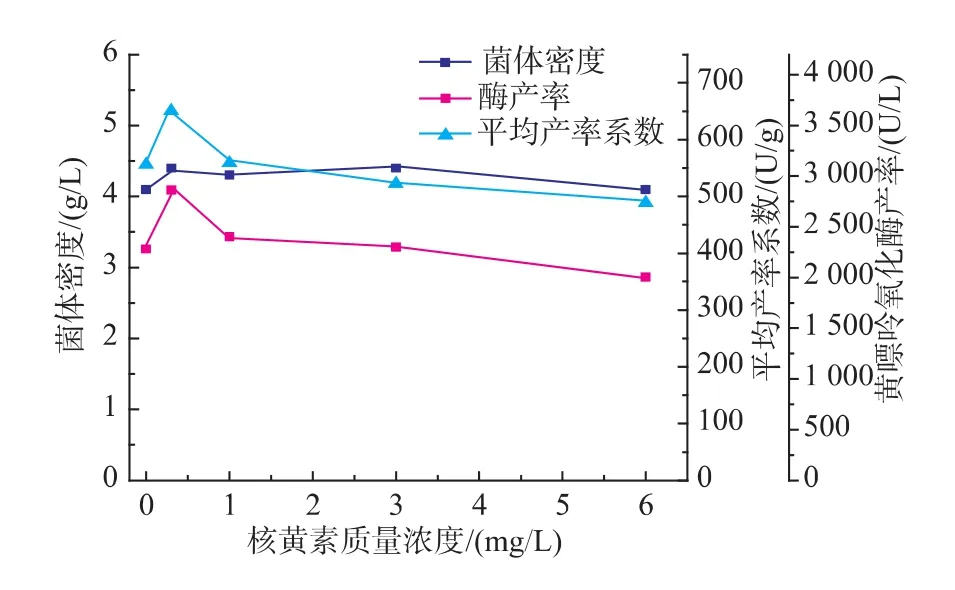
图3 核黄素添加对黄嘌呤氧化酶发酵的影响Fig.3 Effectofriboflavin concentrationson XOD fermentation
2.3.2 硫胺素添加影响发酵产酶 由图4可知,硫胺素的添加不同程度的影响菌体产酶,最佳添加质量浓度为6 mg/L,黄嘌呤氧化酶产率提高了30.7%,这可能是由于硫胺素以硫胺素焦磷酸辅酶(TPP)的形式参与碳水化合物代谢过程中α-酮酸的氧化脱羧反应,是整个能量代谢过程和支链氨基酸代谢所必需的维生素。节杆菌生长及产黄嘌呤氧化酶需耗能,且黄嘌呤氧化酶参与的嘌呤降解代谢,与某些氨基酸的代谢相关。
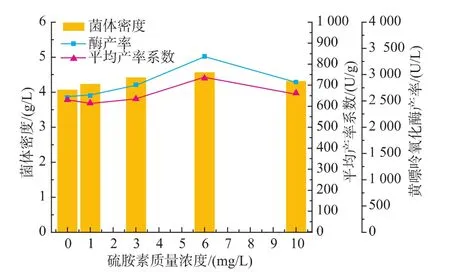
图4 硫胺素添加对黄嘌呤氧化酶发酵的影响Fig.4 Effectofthiamineconcentrationson XOD fermentation
2.4 流加发酵提高发酵产黄嘌呤氧化酶
上述研究表明直接添加过高质量浓度次黄嘌呤将抑制菌体生长及产酶,为获得更高水平的产酶,需对黄嘌呤氧化酶发酵进行流加诱导物。在7.5 L发酵罐,pH阶段控制条件下,测得发酵至24 h,发酵液次黄嘌呤约剩余0.3 g/L,葡萄糖浓度约剩余3 g/L。此时进行补料,两种补料方式下发酵过程参数变化如图5及图6所示。
结果表明,采用方式1补料后,发酵至28 h时,发酵液酶产率提高25.7%。而采用方式2补料时,在第28 h第二次继续补料后,发酵液产酶水平变化不大;在第31 h第三次再补料时,发酵液产酶水平反而下降(下降9.8%)。综合比较,采用方式1补料较好。
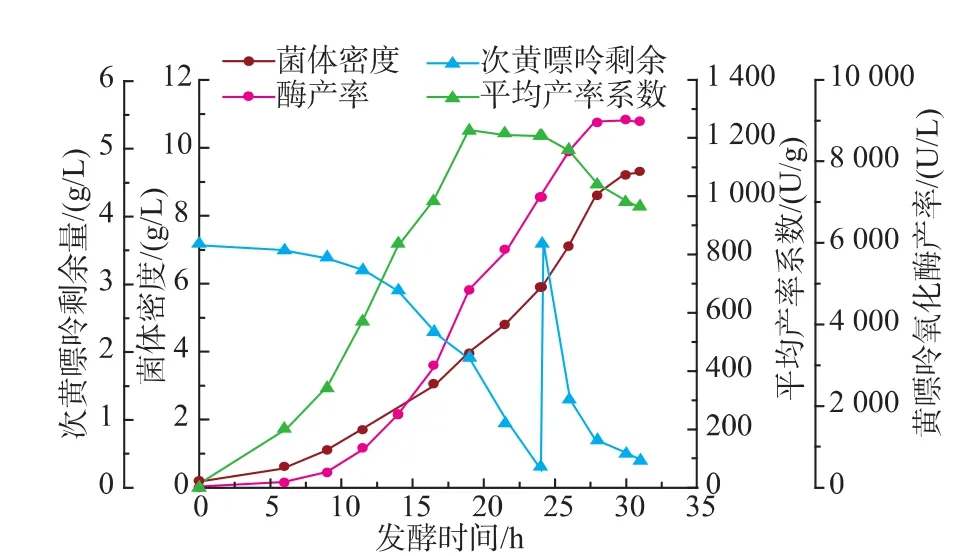
图5 补料方式1下黄嘌呤氧化酶流加发酵过程曲线Fig.5 Timecourseofxanthineoxidasefed-batch fermentation via the method one
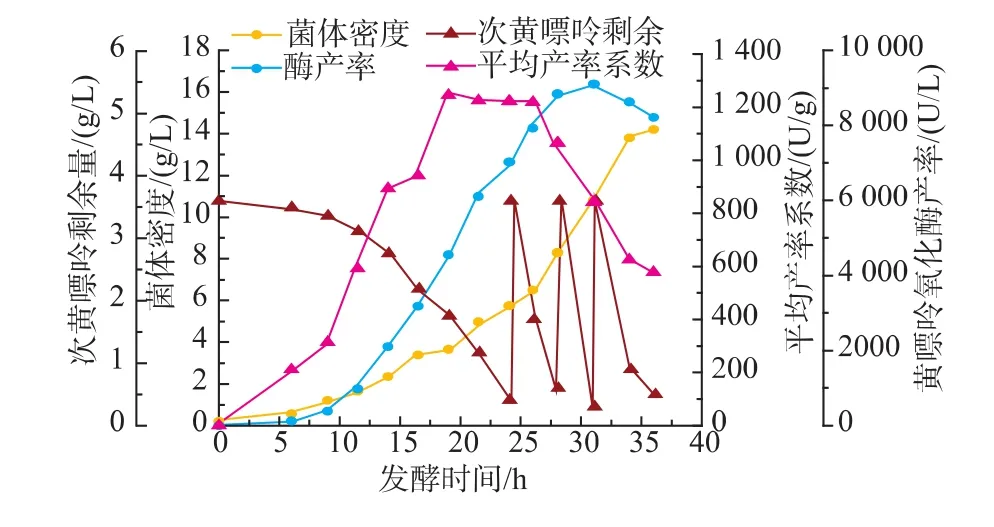
图6 补料方式2下黄嘌呤氧化酶流加发酵过程曲线Fig.6 Timecourseofxanthineoxidasefed-batch fermentation via the method two
2.5 嘌呤代谢产物氨与黄嘌呤氧化酶发酵的关系
2.5.1 发酵过程中铵根离子浓度的变化分析 由图6知,在采用补料方式2进行补料时,虽然后两次补料对发酵产酶不利,但发酵液中所补次黄嘌呤却已被菌体消耗,发酵终点时次黄嘌呤质量浓度剩余不足0.5 g/L。进一步分析,补料方式2的3次补料过程中,其平均产率系数一直下降,发酵终点时平均产率系数仅为补料前的47.3%。
黄嘌呤氧化酶为嘌呤降解代谢酶系中关键酶之一,由京都基因与基因组百科全书(KEGG)报道的节杆菌嘌呤代谢图知,次黄嘌呤、黄嘌呤经黄嘌呤氧化酶作用后产生尿酸,尿酸再经尿酸酶、尿囊素酶等酶系作用,降解为终产物氨。有文献报道,嘌呤降解时产生的大量中间代谢产物及终产物氨会对嘌呤降解途径的酶系造成抑制[17],降低嘌呤降解速率,从而影响黄嘌呤氧化酶的合成。氨在发酵液中以铵根离子的形式存在,对节杆菌Arthrobacter M3流加发酵过程中铵根离子浓度进行测定,发现发酵液中铵根离子浓度随着诱导物的补料而持续增加(图7)。推测,在补料方式2下,铵根离子达到一定浓度时,节杆产菌黄嘌呤氧化酶受到抑制,第二次补料后产率基本不增加,但菌体仍在生长,导致平均产率系数开始下降;铵根离子的进一步积累加剧了对产酶的抑制,从而导致最后一次补料后,酶产率随着菌体密度的增加而减小,平均产率系数下降速率加快。
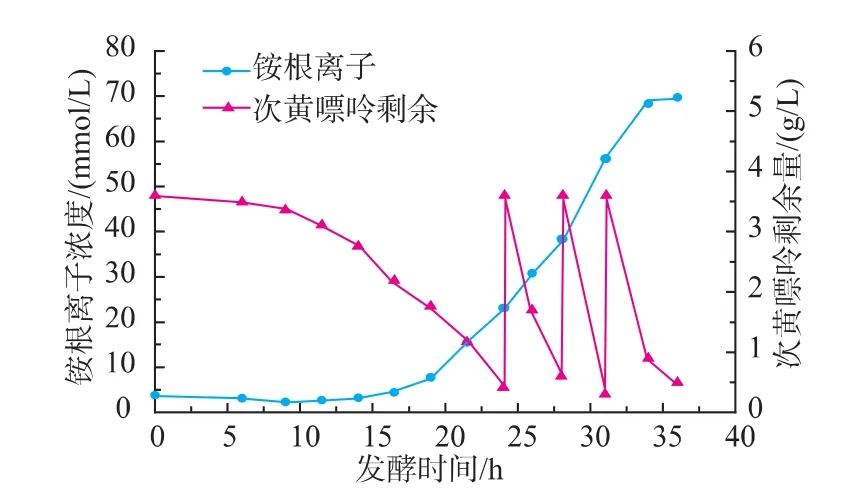
图7 补料方式2下流加发酵过程中铵根离子变化曲线Fig.7 Time course of ammonium concentrations under XOD fed-batch fermentation via the method two
2.5.2 铵根离子浓度抑制发酵产酶的验证 有关文献报道[14],嘌呤降解代谢相关酶的合成受Amr基因表达的调节蛋白的正调控作用,而Amr基因控制相关氮源代谢,受到铵根离子的负调控作用。高浓度的铵根离子将抑制Amr基因的表达,从而抑制嘌呤降解代谢相关酶的合成。为验证嘌呤代谢终产物氨对节杆菌Arthrobacter M3发酵产黄嘌呤氧化酶是否有抑制作用,分别向发酵培养基中添加不同浓度的氯化铵,研究二者的关系。如图8所示,当向发酵液中添加15 mmol/L以上的铵根离子时,发酵液平均产率系数逐渐减小,进而导致黄嘌呤氧化酶产率降低,说明嘌呤代谢产物氨对Arthrobacter M3发酵产黄嘌呤氧化酶有抑制作用。即黄嘌呤氧化酶的产率与发酵液中氮源含量及种类有关,发酵过程中应使用亚适量氮源,避免使用氨水调节pH,以减少对发酵产酶的抑制。
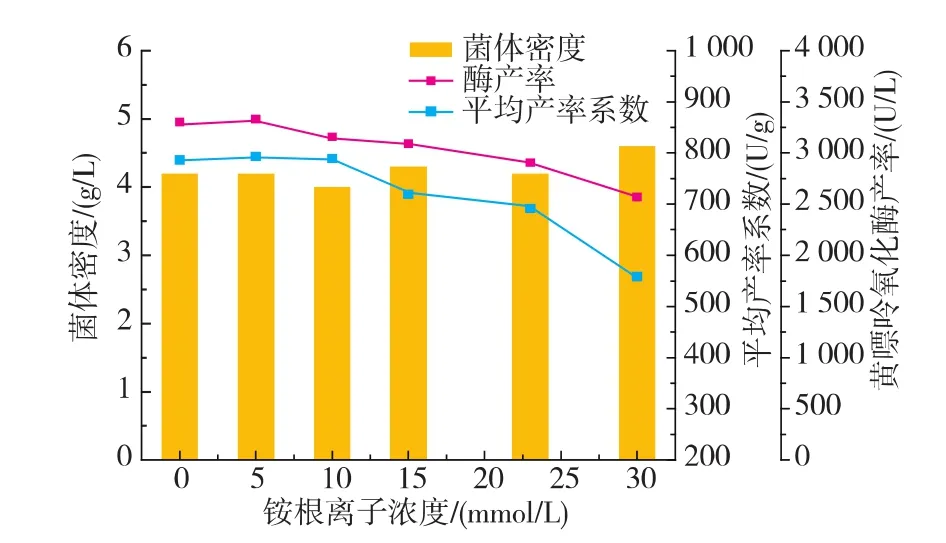
图8 添加铵根离子对发酵产酶的影响Fig.8 Effect of ammonium concentrations on XOD fermentation
3 结语
依据菌株16S rDNA序列(1438 bp)构建系统进化树,确定此菌株为球形节杆菌(Arthrobacter globiformis);添加辅酶前体(核黄素、硫胺素)不同程度上提高了发酵产酶;为解除诱导物抑制效应,采用两种流加发酵方式,结果表明,在发酵液中一次性补入4.0 g/L葡萄糖,并补诱导物次黄嘌呤至终质量浓度为3.6 g/L,可提高发酵液黄嘌呤氧化酶产率25.7%。补料方式2下流加发酵时,发现后期随诱导物的补料,酶产率反而下降,且平均产率系数一直呈下降趋势。测定知流加发酵过程中铵根离子浓度持续增加,推测发酵后期嘌呤代谢终产物氨可能抑制发酵产酶。通过向发酵中添加一定浓度的铵根离子,发现嘌呤代谢终产物氨抑制发酵产黄嘌呤氧化酶。以上研究表明,辅酶前体添加及适当的诱导物补料可有效提高黄嘌呤氧化酶发酵产率,适当减少氨氮添加量,避免使用氨水调节pH等又可减少对发酵产酶的抑制,间接提高发酵产酶量。
[1]Vorbach C,Harrison R,Capecchi M R.Xanthine oxidoreductase is central to the evolution and function of the innate immune system[J].Trends Immunol,2003,24:512-517.
[2]Groot H D,Noll T.Enzymic determination of inorganic phosphates,organic phosphates and phosphate-liberating enzymes by use of nucleoside phosphorylase-xanthine oxidase (dehydrogenase)-coupled reactions[J].Biochem J,1985,230:255-260.
[3]Heinz F,Pilz R,Reckel S,et al.A new spectrophotometric method for the determination of 5'-nucleotidase[J].J Clin Chem Clin Biochem,1980,18:781-788.
[4]Nakatani H S,dos Santos L V,Pelegrine C P,et al.Biosensor based on xanthine oxidase for monitoring hypoxanthine in fish meat[J].Am J Biochem Biotechnol,2005,doi:10.3844/ajbbsp.2005.85.89.
[5]Woolfolk C A,Downard J S.Distribution of xanthine oxidase and xanthine dehydrogenase specificity types among bacteria[J].J Bacteriol,1977,130:1175-1191.
[6]Chris A P.Cellular distribution,metabolism and regulation of the xanthine oxidoreductase enzyme system[J].Chem Biol Interact,2000,129:195-208.
[7]Poss W B,Huecksteadt T P,Panus P C,et al.Regulation of xanthine dehydrogenase and xanthine oxidase activity by hypoxia[J].Am J Physiol Lung Cell Mol Physiol,1996,270:941-950.
[8]Higgins P,Dawson J,Lees K R,et al.Xanthine oxidase inhibition for the treatment of cardiovascular disease:a systematic review and meta-analysis[J].Cardiovasc Ther,2012,30(4):217-226.
[9]Higgins P,Ferguson L D,Walters M R.Xanthine oxidase inhibition for the treatment of stroke disease:a novel therapeutic approach[J].Expert Rev Cardiovasc Ther,2011,9(4):399-401.
[10]夏小花,杨海麟,王武.产黄嘌呤氧化酶节杆菌X7产酶条件优化[J].河南工业大学学报:自然科学版,2007,28(2):51-54.XIA Xiaohua,YANG Hailin,WANG Wu.Study on optimization of xanthine oxidase producing conditions of Arthrobacter X7[J].Journal of Henan University of Technology:Natural Science Edition,2007,28(2):51-54.(in Chinese)
[11]李忠琴,许小平,夏小花,等.黄嘌呤氧化酶产生菌的产酶条件优化[J].中国医药工业杂志,2007,38(12):842-845.LI Zhongqin,XU Xiaoping,XIA Xiaohua.Optimization of conditions for production of xanmine oxidase by Arthrobacter sp.[J].Chinese Journal of Pharmaceuticals,2007,38(12):842-845.(in Chinese)
[12]徐学明,金征宇,刘当慧.法夫酵母产虾青素的补料发酵[J].食品与生物技术学报,2005,24(5):21-24.XU Xueming,JIN Zhengyu,LIU Danghui.Fed-batch culture of astaxanthin producing strain Phaffia rhodozyma[J].Journal of Food Science and Biotechnology,2005,24(5):21-24.(in Chinese)
[13]杜郭君,张一平,王红连,等.鸟嘌呤核苷补料发酵条件研究[J].食品与生物技术学报,2001,24(5):21-24 DU Guojun,ZHANG Yiping,WANG Honglian,et al.Studies on feeding condition of guanosine fermentation[J].Journal of Food Science and Biotechnology,2001,24(5):21-24.(in Chinese)
[14]Reinert W R,Marzluf G A.Genetic and metabolic control of the purine catabolic enzymes of Neurospora crassa[J].Mol Gen Genet,1975,139(1):39-55.
[15]Ngo T,Phan A,Yam C,et al.Interference in determination of ammonia with the hypochlorite-alkaline phenol method of Berthelot[J].Anal Chem,1982,54:46-9.
[16]李忠琴,许小平,王武.辣根过氧化物酶分光光度法测定黄嘌呤氧化酶的活性[J].分析化学,2006,34(6):821-824.LI Zhongqin,XU Xiaoping,WANG Wu.Spectrophotometic determination of activity of xanthine oxidase by horseradish peroxidase[J].Chinese Journal of Analytical Chemistry,2006,34(6):821-824.(in Chinese)
[17]Reinert W R,Marzluf G A.Regulation of the purine catabolic enzymes in Neurospora crassa[J].Arch Biochem Biophys,1975,166:565-574.
