mGluR5拮抗剂MPEP抑制大鼠NPCs增殖
2014-05-21赵雪超童东东王晓霏赵凌宇西安市北方医院康复科西安70043西安交通大学医学院医学遗传学与分子生物学系通讯作者maillingyuzhaoaliyuncom
赵雪超,韩 佳,郭 波,童东东,王晓霏,赵凌宇(西安市北方医院康复科,西安 70043;西安交通大学医学院医学遗传学与分子生物学系;通讯作者,E-mail:lingyuzhao@aliyun.com)
神经祖细胞(neural precursor cells,NPCs)具有自我更新、不断增殖及多向分化潜能的生物学特性[1]。NPCs存在于哺乳动物发育期和成熟期的中枢神经系统(central nervous system,CNS)中[2]。目前,NPCs已经被研究用来治疗帕金森氏病、Huntington病、缺血性中风、脱髓鞘病及脑、脊髓损伤等CNS疾病,NPCs治疗已经被广泛认为能改善脑缺血、神经损伤和神经变性紊乱疾病后的神经功能[3,4]。在NPCs替代治疗过程中,基因调控对NPCs的增殖起着非常重要的作用。因此,阐明NPCs增殖的分子机制在修复神经系统损伤和治疗神经退行性疾病方面有非常重要的作用。
研究报道,谷氨酸可能通过代谢型谷氨酸受体(metabotropic glutamate receptors,mGluRs)调控脑损伤后的神经发生[5]。mGluRs包括8种成员,分别是mGluR1-8,分为三组,其中 mGluR5属于Ⅰ组mGluRs。Castiglione等[6]研究报道,mGluR5 可促进成年侧脑室下区(subventricular zone,SVZ)的NPCs存活和增殖。2-甲基-6-(苯乙炔)吡啶盐酸盐[6-methyl-2-(phenylethynyl)pyridine hydrochloride,MPEP]是一个非竞争性的mGluR5拮抗剂,为研究不同疾病动物模型提供了一个有效的选择性的系统的活性化合物,它可以抑制 mGluR5 的激活[6,7]。NPCs的增殖和分化受到多个信号转导通路的调控,RAS MAPK信号转导通路就参与了NSCs的增殖和分化过程。ERK,JNK和 p38 MAPKs是主要的MAPK家族成员,它们在CNS发育和分化过程中扮演着重要的角色[8]。本实验应用mGluR5的特异性拮抗剂MPEP,分析MPEP对大鼠 NPCs增殖的影响,观察ERK,JNK和p38 MAPKs信号通路激活的变化,探讨MPEP抑制大鼠NPCs增殖的分子机制。
1 材料与方法
1.1 实验动物
Sprague-Dawley(SD)大鼠由西安交通大学医学院实验动物中心提供。孕鼠饲养至受孕后15 d,分离胚胎鼠,进行大鼠胚胎NPCs培养。
1.2 主要试剂
DMEM/F12(1∶1)培养基、N2 添加剂、B27 添加剂、碱性成纤维细胞生长因子(bFGF)购于美国Gibco公司;MPEP、表皮生长因子(EGF)、肝素、MTT、RnaseA、胰蛋白酶、碘化丙啶(PI)购于美国Sigma公司;AnnexinⅤ-FITC凋亡试剂盒购于美国BD Bioscience公司;兔抗大鼠ERK1/2多克隆抗体、兔抗大鼠P-ERK 1/2多克隆抗体、小鼠抗大鼠JNK2单克隆抗体、小鼠抗大鼠P-JNK单克隆抗体、小鼠抗大鼠p38单克隆抗体、兔抗大鼠P-p38单克隆抗体均购于美国Cell Signaling公司;ECL化学发光底物试剂盒购于美国Pierce公司;RIPA裂解液购于碧云天公司。
1.3 主要仪器
二氧化碳培养箱Galaxy S(英国RS Biotech公司);高通量多功能微板测试系统(德国 BMG Labtechnologies公司);倒置相差显微镜(日本OLYMPUS公司);低速离心机TDL-5(上海安亭科学仪器厂);FASCalibar流式细胞仪(美国 FALS CALIBAR BD公司);GBOX-HR全自动凝胶成像分析系统(英国SYNGENE公司);湿法蛋白电转印系统DYCZ-40D(北京六一仪器厂);水平电泳仪DYCZ-31N(北京六一仪器厂);垂直电泳系统SE260(美国Amersham公司)。
1.4 实验方法
1.4.1 大鼠胚胎皮质NPCs的分离和培养 取孕15 d大鼠,麻醉,取出胚胎,将分离的脑组织移到基础培养基(DMEM/F12)中;剥离脑膜,分离大脑皮质,然后用基础培养基洗涤2次;将分离的大脑皮质快速剪50次,使组织分散为小块,移入消化液中,置入37℃培养箱,消化细胞5 min;加入胰蛋白酶抑制剂终止消化,用吸管吹打100-150次,使组织分散为单细胞;用200目筛网过滤;将获得的细胞悬液移至离心管中,800 r/min离心5 min,弃掉上清液;再用基础培养基洗细胞1次;用完全培养基(DMEM/F12基础培养基中加入20 ng/ml EGF,10 ng/ml bFGF,1 × B27 supplement,1 × N2 supplement,100 U/ml链霉素,100 U/ml青霉素,0.4 U/ml肝素)重悬细胞;将细胞密度调节为1×105/ml,按照4 ml/瓶将细胞种入T50培养瓶中,置入37℃,5%CO2孵箱中培养,第2天每瓶细胞补加1 ml完全培养基,培养5-7 d后传代培养(本研究所用的NPCs均为传1代的细胞)。
1.4.2 MTT比色法检测MPEP对大鼠NPCs增殖的影响 将传1代的NPCs按照约20 000个/孔种入96孔板中,每孔为200 μl的单细胞悬液,正常培养2 d后加药物干预。实验分组:对照、MPEP(1 μmol/L)、MPEP(10 μmol/L)和 MPEP(100 μmol/L)组。加入药物后继续分别培养1,2,3 d。培养细胞在收获前4 h,每孔加入20 μl MTT(5 mg/ml)溶液,使MTT的终浓度为0.5 mg/ml,然后继续于孵箱中培养至收获时间。1 000 r/min离心5 min弃去培养上清液,再加入150 μl DMSO,震荡5 min,促使结紫色晶充分溶解。在POLARstar+OPTIMA微板测试仪上检测光吸收值,检测波长为490 nm。
1.4.3 测量神经球直径分析MPEP对大鼠 NPCs神经球增长的影响 将传1代的NPCs按照约20 000个/孔种入96孔板中,每孔为200 μl的单细胞悬液,放入37℃,5%CO2孵箱中培养2 d后加药物干预。实验分组同上。加入药物后继续分别培养1,2,3 d。培养细胞在各时间点时,利用倒置相差显微镜,在200倍镜下每孔按时钟的3点、6点、9点、12点和圆心5个方位选取5个视野,用Image-Pro Express(IPP)图像分析软件照相并分析比较各组神经球直径的变化。
1.4.4 流式细胞仪检测MPEP对大鼠NPCs细胞周期的影响 将传1代的NPCs按照约200 000个/孔种入6孔板中,每孔为2 ml的单细胞悬液,培养2 d后加药物干预。实验分组:对照组、MPEP(100 μmol/L)组。加入药物后继续培养2 d后,收集各组神经球,用复合消化液消化,300目筛网过滤,收集单细胞悬液;800 r/min离心8 min,弃上清,PBS洗涤1次;加入250 μl PBS以重悬细胞,再逐滴加入750 μl无水乙醇并同时不断摇动离心管,从而使酒精浓度缓慢上升,其终浓度为75%,放置4℃过夜固定;PBS洗涤1次;加入浓度为100 μg/ml的无DNase的RNaseA 0.5 ml,重悬细胞;再加入浓度为100 μg/ml PI染液 0.5 ml,混合均匀,室温下避光孵育15 min;用流式细胞仪(FACS)检测,每个样品检测细胞数量为2×104个,激发波长为488 nm,PI的红色荧光通过630 nm的滤光片收集,用BD FACSort Cell Quest软件获取数据,最后用Modfit LT软件分析DNA的含量变化。
1.4.5 AnnexinⅤ -PI法检测 MPEP对大鼠 NPCs细胞凋亡的影响 传1代的NPCs按照约200 000个/孔种入6孔板中,培养2 d后加药物干预(MPEP 100 μmol/L),继续培养2 d后,消化,制备成单细胞悬液,PBS洗涤2次。用250 μ1结合缓冲液重新悬浮细胞,使其浓度为1×105/ml。加100 μ1的细胞悬液入5 ml流式管中,每管加入5 μ1 AnnexinⅤ/FITC 和 5 μ1 20 μg/ml的碘化丙锭,避光混匀,标记15 min。在流式管中加入400 μ1 PBS。用流式细胞仪(FACS)检测,光源为488 nm氩离子激光器,FITC受激发后发绿色荧光,PI发红色荧光,结果用随机软件分析。
1.4.6 免疫蛋白印迹 (Western blot)分析 MPEP对MAPKs信号通路的影响 传1代的NSCs培养1 d后,加药物干预(MPEP 100 μmol/L),继续培养1 d,置入RIPA细胞裂解液中,低温裂解细胞30 min,12 000 r/min,4℃离心15 min,取上清液。以BCA试剂盒检测蛋白浓度。将蛋白煮沸变性。取50 μg总蛋白,在10%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳后,电转移至硝酸纤维素膜上,依分子量大小切取条带,加入封闭液室温下震荡2 h后,取相应条带分别加入兔抗大鼠ERK1/2多克隆抗体(1∶1 000稀释)、兔抗大鼠P-ERK 1/2多克隆抗体(1∶1 000稀释)、小鼠抗大鼠JNK2单克隆抗体(1∶1 000稀释)、小鼠抗大鼠P-JNK2单克隆抗体(1∶1 000稀释)、小鼠抗大鼠p38 MAPK单克隆抗体(1∶1 000稀释)、兔抗大鼠P-p38 MAPK单克隆抗体(1∶1000稀释),4℃孵育过夜,TBST洗膜3次,10 min/次。然后与HRP标记的羊抗兔/羊抗鼠二抗(1∶2 500稀释)室温孵育1 h,TBST洗膜3次,10 min/次。加入免疫印迹化学发光剂,置于Syngene G Box凝胶成像仪的暗箱中拍照。应用英国SYNGENE公司的GeneTools软件分析,计算条带的积分光密度(optic density,OD)值,半定量分析。所有细胞实验重复3次。
1.5 统计学分析
采用SPSS16.0统计软件进行统计学分析,各组实验数据均以±s表示,用单因素方差分析(One-Way,ANOVA)进行总体差异的检验,应用GraphPad Prism 5软件进行绘图。以P<0.05表示差异有统计学意义。
2 结果
2.1 MPEP对大鼠NPCs增殖的影响
应用MTT比色法分析了mGluR5拮抗剂MPEP(1,10,100 μmol/L)分别在处理大鼠 NPCs 1,2,3 d后对细胞增殖活力的影响。与对照组比较,MPEP 100 μmol/L 分别在作用1,2,3 d 后降低了 NPCs增殖活力(P <0.01,图 1);与1 μmol/L MPEP 组及10 μmol/L MPEP 组相比较,100 μmol/L MPEP 组 NPCs增殖活力显著下降(均 P<0.05);1 μmol/L MPEP组及10 μmol/L MPEP组与对照组之间无显著差异。神经球直径测量结果显示,100 μmol/L MPEP分别在作用1,2,3 d后神经球的平均直径依次为(48.65 ±4.12)μm,(61.39 ±5.23)μm,(74.96 ±5.79)μm,与对照组相比神经球均显著减小(P<0.05,图 2);与 1 μmol/L MPEP 组及 10 μmol/L MPEP组相比较,100 μmol/L MPEP组神经球显著减小(均P <0.05);1 μmol/L MPEP 组及10 μmol/L MPEP组与对照组之间无显著差异。
2.2 MPEP对大鼠NPCs细胞周期的影响

图1 MPEP对大鼠NPCs增殖的影响(MTT比色分析)Figure 1 Effect of MPEP on rat NPC proliferation by MTT assay

图2 MPEP对大鼠神经球增殖的影响(神经球直径测量)Figure 2 Effect of MPEP on rat neurosphere diameters
将培养的神经球用药物处理2d后,消化分散为单个细胞,应用流式细胞仪检测细胞周期。mGluR5拮抗剂MPEP(100 μmol/L)组与对照组相比,G0/G1期细胞数量显著增加(P<0.01),S期细胞数量显著减少(P<0.01),G2/M期细胞数量也有减少,表明mGluR5拮抗剂MPEP将大鼠NPCs阻滞在G0/G1期,抑制了细胞进入S期进行DNA复制(见图 3)。

图3 MPEP对大鼠NPCs细胞周期的影响Figure 3 Effects of MPEP on cell cycle of rat NPCs
2.3 MPEP对大鼠NPCs凋亡的影响
培养的神经球用药物处理2 d后,消化分散为单个细胞,应用AnnexinⅤ+PI试剂盒染色,流式细胞仪检测分析。对照组正常细胞为(87.25±4.78)%,早期凋亡细胞为(6.46 ±1.89)%,晚期凋亡细胞为(3.37±1.55)%。与对照组相比,mGluR5拮抗剂MPEP组正常细胞显著减少(P<0.01),为(60.78±4.22)%;早期凋亡细胞显著增加(P<0.01),为(23.45 ±2.45)%;晚期凋亡细胞也明显增加(P <0.01),为(11.83 ±2.23)%;坏死细胞没有显著差异(见图4)。
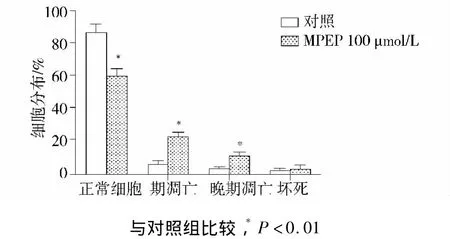
图4 MPEP对大鼠NPCs凋亡的影响Figure 4 Effect of MPEP on apoptosis of rat NPCs
2.4 MPEP抑制大鼠NPCs MAPKs信号通路的激活
应用Western blot分析MPEP对大鼠NPCs内的MAPKs信号通路的3个主要成员ERK、JNK和p38的磷酸化激活的影响。结果显示,体外培养的大鼠NPCs内总的ERK、JNK和p38表达水平无显著性差异(见图5)。应用P-ERK1/2比总ERK1/2、P-JNK2比总JNK2、P-p38比总p38光密度积分比值来表示ERK1/2、JNK2和p38激活的变化,达到了半定量分析的目的。结果显示,与对照组相比,MPEP组的ERK1/2和JNK2的磷酸化水平显著降低(P<0.05),但是p38的磷酸化水平显著增高(P<0.05,图5)。
3 讨论
mGluR5在调节成年人侧脑室下区(SVZ)NPCs的存活和增殖中发挥着重要作用。研究报道,在大鼠胚胎期的所有脑区均有mGluR5蛋白表达,在出生后的脑部神经发生区也有表达[9]。Di Giorgi Gerevini等[10]研究发现,mGluR5 在培养的小鼠 NPCs中有表达并且具有生物学活性,当利用阻断剂阻断这两种受体以后,结果发现NPCs的增殖与存活明显减少,但是将mGluR5激活以后,能够显著地促进细胞增殖。在基因敲除mGluR5的成年小鼠或利用阻断剂阻断mGluR5以后,在侧脑室下区(SVZ)和齿状回颗粒下层(SGZ)区域增殖的NPCs数量显著降低。这些研究证明mGluR5能够调控NPCs的存活与增殖。在本试验中,MPEP通过抑制mGluR5激活,降低了体外培养的大鼠NPCs的细胞活力和神经球的大小,表明MPEP可显著的抑制体外培养的大鼠胚胎皮质NPCs增殖。

图5 MPEP对大鼠NPCs的MAPKs信号通路磷酸化水平的影响(与对照组比较,*P<0.01)Figure 5 Effects of MPEP on phosphorylated-MAPKs expression of rat NPCs(*P <0.01 vs control group)
细胞周期中从G1到S期的转换是调节细胞周期的最主要作用节点,在细胞跨越G1/S节点后,细胞周期将依照细胞周期内部的程序进行,逐渐回到G1期前,在这个阶段将不容易受到其他增殖调控因素的影响[11]。M期细胞的比例大小,可以表明处于增殖分裂期细胞的多少。S期细胞所占比例大小可以表明开始新一轮DNA复制合成和分裂的细胞数量的多少。在正常培养的NPCs中,大部分细胞处于静息期(约80%),只有大约20%的细胞处于DNA复制合成期和分裂期。在 mGluR5拮抗剂MPEP处理NPCs后,细胞的DNA复制合成与细胞分裂显著减少。因此,推测MPEP可能通过抑制mGluR5,影响NPCs的DNA复制合成与细胞分裂来抑制NPCs的增殖。
RAS-MAPK信号转导通路涉及到多种生物学和生理学的进程,例如细胞增殖、存活、凋亡、分化和转化。ERK,JNK和p38 MAPKs是主要的MAPK家族成员,在CNS发育和分化过程中扮演着一个重要的角色[12]。据报道,mGluR Ⅰ组激动剂3,5- 二羟基苯甘氨酸(DHPG)可以刺激体外的皮质神经元的ERK1/2 的磷酸化激活[13]。Tian 等[14]报道激活mGluR7,可能通过影响RAS MAPK信号转导通路磷酸化激活促进 NPCs增殖和分化。ERK是一个mGluR5的下游调节子[15]。ERK1/2级联反应在CNS结构和功能改变过程中通过调节细胞活动和基因转录来转导细胞内和细胞外信号活动[16]。有研究报道表明,JNK2也调节NPCs的增殖[17]。在本研究中,我们发现mGluR5的拮抗剂MPEP下调了体外培养的大鼠NPCs的p-ERK和p-JNK表达。因此,我们推测MPEP抑制 mGluR5后通过抑制ERK和JNK信号转导通路来抑制NPCs的增殖。有研究表明mGluR5的激活通过增加EGF受体酪氨酸自磷酸化致使EGF受体处于动态的转活状态,这依次激活下游的信号通路进而上调JNK的磷酸化[18],这与我们的研究一致。
p38的磷酸化激活能够诱导细胞凋亡,用p38的选择性抑制剂SB203580能减少细胞的死亡[19]。Kim等[20]的研究表明p38 MAPK信号通路在NPCs增殖上起着负调节因子的作用。本研究中,用MPEP处理大鼠NPCs后,p38 MAPK的磷酸化水平上调,细胞凋亡增加。这些结果说明mGluR5拮抗剂MPEP可以通过调节p38 MAPK信号通路的磷酸化水平增加大鼠胚胎皮质NPCs的凋亡。
总之,mGluR5拮抗剂MPEP通过抑制ERK和JNK的磷酸化激活抑制体外培养的大鼠胚胎皮质NPCs增殖,促进了细胞凋亡。然而,关于mGluR5下游的级联反应是非常复杂的,需要进一步探讨mGluR5调控NPCs增殖的确切分子机制。
[1] Santilli G,Lamorte G,Carlessi L,et al.Mild hypoxia enhances proliferation and multipotency of human neural stem cells[J].PLoS One,2010,5:e8575 - e8586.
[2] De Filippis L,Delia D.Hypoxia in the regulation of neural stem cells[J].Cell Mol Life Sci,2011,68:2831 -2844.
[3] Marshall CT,Lu C,Winstead W,et al.The therapeutic potential of human olfactory - derived stem cells[J].Histol Histopathol,2006,21:633 -643.
[4] Chaturvedi RK,Shukla S,Seth K,et al.Zuckerkandl’s organ improves long-term survival and function of neural stem cell derived dopaminergic neurons in Parkinsonian rats[J].Exp Neurol,2008,210:608 -623.
[5] Schlett K.Glutamate as a modulator of embryonic and adult neurogenesis[J].Curr Top Med Chem,2006,6(10):949 -960.
[6] Castiglione M,Calafiore M,Costa L,et al.Group I metabotropic glutamate receptors control proliferation,survival and differentiation of cultured neural progenitor cells isolated from the subventricular zone of adult mice[J].Neuropharmacology,2008,55:560-567.
[7] Gasparini F,Lingenhohl K,Stoehr N,et al.2 - Methyl- 6 -(phenylethynyl)- pyridine(MPEP),a potent,selective and systemically active mGlu5 receptor antagonist[J].Neuropharmacology,1999,38:1493 -1503.
[8] Yang SR,Cho SD,Ahn NS,et al.The role of p38 MAP kinase and c-Jun N-terminal protein kinase signaling in the differentiation and apoptosis of immortalized neural stem cells[J].Mutat Res,2005,579:47 -57.
[9] Cappuccio I,Spinsanti P,Porcellini A,et al.Endogenous activation of mGlu5 metabotropic glutamate receptors supports self-renewal of cultured mouse embryonic stem cells[J].Neuropharmacology,2005,49(Suppl 1):196 -205.
[10] Di Giorgi- Gerevini V,Melchiorri D,Battaglia G,et al.Endogenous activation of metabotropic glutamate receptors supports the proliferation and survival of neural progenitor cells[J].Cell Death Differ,2005,12(8):1124 -1133.
[11] Liu KJ,Hoopes PJ,Rolett EL,et al.Effect of anesthesia on cerebral tissue oxygen and cardiopulmonary parameters in rats[J].Adv Exp Med Biol,1997,411:33 -39.
[12] Yang SR,Cho SD,Ahn NS,et al.The role of p38 MAP kinase and c-Jun N-terminal protein kinase signaling in the differentiation and apoptosis of immortalized neural stem cells[J].Mutat Res,2005,579:47 -57.
[13] Wang Y,Zheng F,Zhou X,et al.Converging signal on ERK1/2 activity regulates group I mGluR-mediated Arc transcription[J].Neurosci Lett,2009,460:36 - 40.
[14] Tian Y,Liu Y,Chen X,et al.AMN082 promotes the proliferation and differentiation of neural progenitor cells with influence on phosphorylation of MAPK signaling pathways[J].Neurochem Int,2010,57:8 -15.
[15] Yang L,Mao L,Tang Q,et al.A novel Ca2+- independent signaling pathway to extracellular signal regulated protein kinase by coactivation of NMDA receptors and metabotropic glutamate receptor 5 in neurons[J].J Neurosci,2004,24(50):10846 -10857.
[16] Valjent E,Corvol JC,Trzaskos JM,et al.Role of the ERK pathway in psychostimulant- induced locomotor sensitization[J].BMC Neurosci,2006,7:20 -32.
[17] Chen X,Tian Y,Yao L,et al.Hypoxia stimulates proliferation of rat neural stem cells with influence on the expression of Cyclin D1 and c-Jun N-terminal protein kinase signaling pathway in vitro[J].Neuroscience,2010,165:705 - 714.
[18] Yang L,Mao LM,Chen H,et al.A signaling mechanism from G qprotein-coupled metabotropic glutamate receptors to gene expression:role of the c-Jun N-terminal kinase pathway[J].J Neurosci,2006,18:971 -980.
[19] Kim HJ,Oh JE,Kim SW,et al.Ceramide induces p38 MAPK-dependent apoptosis and Bax translocation via inhibition of Akt in HL - 60 cells[J].Cancer Lett,2008,260:88 - 95.
[20] Kim J,Wong PK.Loss of ATM impairs proliferation of neural stem cells through oxidative stress-mediated p38 MAPK signaling[J].Stem Cells,2009,27:1987 -1998.
