股骨内髁软骨缺损对膝关节软骨、半月板应力的影响
2014-05-19李彦林唐一萍
李 青 李彦林 唐一萍
膝关节软骨损伤是骨科领域近年来研究的热门,因为关节软骨损伤不仅常见,而且会继发性引起膝关节软骨及半月板的退行性改变。关节软骨一旦遭受可致损伤的冲击后,软骨损伤难以修复,从而造成几何曲面完整性的丧失,引起临床症状。软骨损伤还会引起半月板的急、慢性损伤,Christoforakis等在研究时发现这一现象:半月板破裂能导致软骨损伤,同时软骨损伤能加重半月板损伤。磁共振成像是观察膝关节蜕变的可靠方法,尤其是其关节内组织[1],为探讨软骨缺损后继发半月板损伤的原因,本文在磁共振二维图像基础上用有限元分析法研究股骨髁软骨缺损对关节软骨、半月板应力的影响,可为临床提供理论依据,指导临床治疗与康复。
方 法
1. 建模
1.1 材料及建模方法:基于正常成人志愿者的膝关节的磁共振二维图像和既往不同屈曲角度膝关节有限元模型初步建立的结果,确定正常膝关节模型包含股骨、胫骨、腓骨、髌骨、关节软骨、半月板、前交叉韧带、后交叉韧带,内、外侧副韧带,髌腱等伸膝装置。有限元模型的建立通过以下步骤实现:二维图像采集—导入医学建模软件—设定阈值—阈值分割—编辑蒙板—生成三维模型—以STL格式导出并导入逆向工程软件—刨光除噪—拟合NURBS曲面—以IGES格式导出并导入ABAQUS6.9软件—建立有限元模型。
1.2 正常膝关节有限元模型的建立:在研究中利用3.0T磁共振仪(GE General Electric Company,美国)对一名健康男性右膝关节进行伸直位扫描,获取膝关节各组织的二维图像在Mimics软件导入5个不同的序列的图像,分别建立正常膝关节各部分模型。然后将膝关节各部分模型以STL格式导入Geomagic Studio软件中除噪和刨光,拟合NURBS曲面(图1)并以IGES格式输出。最后将其导入ABAQUS有限元分析软件建立正常膝关节三维有限元模型,网格化分的单元类型选用为C3D10[2],整个有限元模型网格参数为:节点总数为44318、单元总数为152866(图2)。
1.3 股骨内髁软骨缺损模型的建立:根据临床关节镜下膝关节软骨损伤常见部位及大小的研究确定软骨损伤模型为缺损发生在股骨内侧髁的最低点为中心,以8mm为直径的圆形区域上。将股骨髁模型以STL格式导入Geomagic逆向工程软件,应用其雕刻刀功能,虚拟股骨内髁软骨8mm直径的缺损,并NURBS曲面并以IGES格式输出。最后将其导入ABAQUS有限元分析软件,进行装配网格化后得到了股骨内髁软骨缺损的有限元模型,模型的节点总数为2384、单元总数为9591(图3)。
2. 计算
2.1 假设和约束:在有限元分析软件允许计算的范围内以及符合膝关节各结构的解剖关系下进行计算前的假设:骨、软骨、半月板、韧带均采用经典材料属性。骨质材料对比其他软组织刚度很大,结合本实验的目的可不考虑骨质的变形;软骨定义为线弹性材料,弹性模量为20M Pa[3],泊松比为0.46[4]半月板定义为线弹性材料,弹性模量为59M Pa[5],泊松比为0.49(表1)。为了减轻计算负荷同时避免降低准确性,所有韧带均采用hyperelasticity材料,材料本构关系是Neo-Hooke模型(表2)。Neo-Hooke函数如下[6-7]:
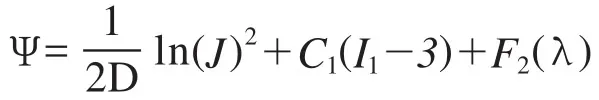
(C1:Neo-Hooke常数即为体积模量Bulk Modulus)胫骨及腓骨被完全固定,股骨完全自由,关节软骨与软骨下骨相连,半月板的触角固定于胫骨平台,各条韧带固定在与股骨、胫骨、髌骨、腓骨的连接处。在膝关节模型中,股骨髁软骨和胫骨平台软骨之间,股骨髁软骨与半月板之间,胫骨平台软骨和半月板处于接触状态,且无相互错动;本研究的载荷条件以文献[8]作为参考,分别向模型施加350N,方向为垂直于胫骨平台软骨向肢体远端。
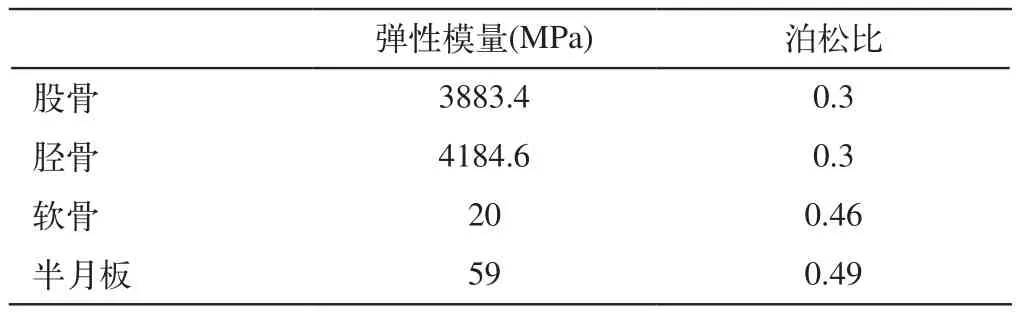
表1 股骨、胫骨、软骨和半月板材料力学属性

表2 韧带材料参数
2.2 计算步骤:第一步 对伸直位正常膝关节模型进行有限元分析计算,得到正常组膝关节软骨、半月板的应力云图;第二步 对股骨内髁软骨缺损的伸直位膝关节模型进行有限元分析计算,得到缺损组膝关节软骨、半月板的应力云图。
2.3 模型的验证:为了能够验证模型的有效性,在完全伸直位的正常膝关节有限元模型上固定胫骨及腓骨并且设定股骨完全自由,在膝关节完全伸直状态下,设置350N平行于股骨长轴向肢体远端作用于股骨近端,将股骨髁软骨面上的应力值与其他国内外学者在类似实验时得到的结果进行比较,验证模型的准确性及有效性。
结 果
1.验证模型的有效性
在该模型中模拟应用350N平行于股骨长轴向肢体远端作用于股骨近端上并计算出股骨髁软骨面上的应力值为3.47 MPa,将得到股骨髁软骨面上的应力值与其他学者在各种体内外实验中类似条件下得到的数据进行比较。与D’Lima等[8]研究结果相符,并且股骨髁在350N压力负荷下峰值应力(3.47MPa)非常接近人尸体膝盖在相同负荷下实验测量值的平均值[9]。在模型中得到的结果能够基本与既往结果和临床经验相符,从而验证了本模型的有效性。
2.结果分析与对比
股骨髁软骨、胫骨平台软骨与半月板是膝关节内主要的接触面,三者紧密的接触,共同承受着身体负荷。任何一个结构的损伤必然会引起其他结构负荷的增加,导致相应损伤,最终引起关节退变。为了更好地理解股骨髁软骨缺失几何光滑度后对股骨髁软骨,胫骨平台软骨及半月板应力的影响,针对股骨内髁软骨完整和缺损(8mm直径软骨缺损)这两种情况,在股骨近端受到350N的重力负荷时,分析股骨髁软骨缺失几何光滑度后对股骨髁软骨,胫骨平台软骨及半月板应力的影响
模拟结果显示,健康膝关节在350N的重力负荷下,股骨髁软骨、胫骨平台软骨及半月板的最大应力均出现在内侧,分别是3.4M Pa,6.2M Pa和6.7 M Pa。胫骨平台软骨承受了37%的应力,而股骨髁软骨承受了20%的应力,而半月板承受了40%的应力,其他结构(前、后交叉韧带,内、外侧副韧带等)此时所起作用非常小(承受约3%的应力)股骨髁软骨,
当股骨内髁软骨发生直径为8mm的软骨缺损时,在同样作用力下,股骨髁软骨,胫骨平台软骨及半月板的最大应力仍出现在内侧并且都有相应增大,股骨髁软骨的最大应力增大到5.7M Pa,比股骨髁软骨正常时增加了67%;胫骨平台软骨最大应力增大到11.5M Pa,比股骨髁软骨正常时增加了85%;半月板的最大应力增大到11.0M Pa,比股骨髁软骨正常时增加了64%。相比之下,胫骨平台软骨承受了41%的应力,而股骨髁软骨承受了20%的应力,而半月板承受了38%的应力,其他结构(前、后交叉韧带,内、外侧副韧带等)此时所起作用非常小(承受约1%的应力)。从分析结果发现,股骨内髁软骨发生缺损后,应力更集中在股骨髁软骨,胫骨平台软骨及半月板的内侧,其最大Mises应力也有不同程度的增加(图4),而股骨髁软骨,胫骨平台软骨及半月板所承受应力的比例基本保持不变。所以,股骨内髁软骨一旦发生缺损就会造成自身和胫骨平台软骨、半月板应力显著增加。
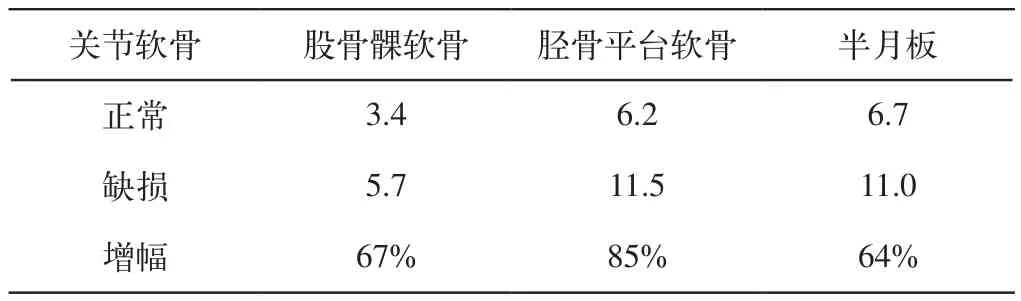
表3 股骨髁软骨,胫骨平台软骨及半月板在两种情况下的应力峰值

图1 拟合的全膝关节三维数字化模型的NURBS曲面。图2 膝关节三维数字化有限元模型。图3 股骨内髁软骨缺损的三维有限元模型。

图4 股骨髁软骨,胫骨平台软骨及半月板的Mises应力所占比例示意图。
讨 论
股骨髁软骨损伤在临床上十分常见,不仅给人类健康带来了极大地危害,而且加重了社会医疗负担。10年前国外学者提供的数据表明,关节软骨损伤的发生率为5%,特定人群如运动员,发生率可达22%~50%[10]。在美国每年大约有4300万软骨损伤的患者,治疗软骨损伤及并发症的医疗费用可达640亿美元。该损伤特点是局部创伤轻微,损伤处软骨修复条件差,恢复时间长。目前国外学者报道关节软骨损伤比我们之间认为的更普遍,A røen等[11]回顾993例软骨损伤的关节镜手术发现:术前X线片显示退行性改变占13%。术后进行关节软骨病理学检查的占66%,其结果发现有非全层软骨缺损的占20%。全层软骨损伤(ICRS等级达到3级和4级)的占11%,其中损伤大小超过2cm2的占55%(占全部患者的6%)。我国学者报道股骨髁软骨损伤常伴有半月板损伤,尚平等[12]在分析研究关节软骨损伤与半月板破裂的关系时发现:半月板破裂能导致软骨损伤,同时软骨损伤能加重半月板损伤。目前修复软骨损伤的方法有很多,包括微骨折术、自体或异体骨软骨移植术、自体软骨细胞移植术、基因治疗和干细胞治疗等。无论哪一种软骨修复技术,其目的均是恢复关节软骨的几何平整度,减少关节软骨及半月板的继发性损伤。但目前尚未发现哪一种技术在这方面优于其他技术。
本研究首先从临床实际出发,构建了股骨髁虚拟软骨损伤的模型,并优化出研究细微结构损伤后生物力学变化的方法。通过有限元分析发现,对于直径大小为8mm的股骨髁软骨损伤,股骨髁软骨,胫骨平台软骨及半月板所承受的应力同比例的显著增加。这一实验结果与Guettler等[13]得出的结论相符,膝关节骨软骨的缺损会引起应力的集中,以10mm直径大小的缺损为界限,但其膝关节屈曲角度和软骨缺损的部位与本实验不同,故以10mm直径大小的缺损为界限尚存争议,需要进一步研究。临床上已经应用多种手术方法恢复关节软骨的几何平整度,达到了减少关节软骨及半月板的继发性损伤的目的,并具有较好的疗效[14-15]。据此分析,恢复关节软骨的几何平整度是减少关节软骨及半月板继发性损伤的主要方法,建议临床上应尽量恢复受损软骨的几何平整度,以减少关节软骨及半月板继发性损伤。
不过,膝关节的实际受力情况相当复杂,并不是单一方向的单一载荷,而是多方向多重载荷相叠加,影响因素众多。同时股骨髁软骨损伤的位置及大小不一,本结论是否适于其他损伤情况有待于进一步研究。但是通过有限元法研究关节软骨损伤后局部应力情况是一个科学而可行的方法,具有重要的临床指导意义。
[1] 李 梅,姚伟武,杨世埙,等. 膝关节损伤的前瞻性研究:MRI 诊断与关节镜对照 . 中国医学计算机成像杂志, 2004, 10 : 258-262.
[2] Yang N H, Nayeb‐Hashemi H, Canavan P K, et al. Effect of frontal plane tibiofemoral angle on the stress and strain at the knee cartilage during the stance phase of gait . J Orthop Res, 2010, 28 : 1539-1547.
[3] Curl W W, K rome J, Gordon E S, et al. Cartilage injuries: a review of 31,516 knee arthroscopies . A rthroscopy, 1997, 13 : 456-460.
[4] Hjelle K, Solheim E, Strand T, et al. Articular cartilage defects in 1,000 knee arthroscopies . Arthroscopy, 2002, 18: 730-734.
[5] Bobic V, Morgan C D, Carter T. Osteochondral autologous graft transfer . Oper Tech Sports Med, 2000, 8: 168-178.
[6] Chow J C Y, Hantes M E, Houle J B, et al. Arthroscopic autogenous osteochondral transplantation for treating knee cartilage defects: a 2-to 5-year follow-up study . A rthroscopy, 2004, 20 : 681-690.
[7] Marcacci M, Kon E, Delcogliano M, et al. Arthroscopic autologous osteochondral grafting for cartilage defects of the knee prospective study results at a minimum 7-year follow-up . Am J Sports Med,2007, 35 : 2014-2021.
[8] D’Lima D D, Chen P C, Colwell C J. Osteochondral grafting:effect of graft alignment, material properties, and articular geometry . Open Orthop J, 2009,3:61-68.
[9] Guettler JH, Demetropoulos CK, Yang KH, et al. Osteochondral defects in the human knee: influence of defect size on cartilage rim stress and load redistribution to surrounding cartilage . Am J Sports Med, 2004,32 :1451-1458.
[10] Piasecki D P, Spindler K P, Warren T A, et al. Intraarticular injuries associated with anterior cruciate ligament tear: findings at ligament reconstruction in high school and recreational athletes an analysis of sex-based differences . The American Journal of Sports Medicine, 2003, 31: 601-605.
[11] A røen A, Løken S, Heir S, et al. Articular cartilage lesions in 993 consecutive knee arthroscopies . Am J Sports Med, 2004, 32 : 211.
[12] 尚 平, 许永涛, 廖全明, 等. 85 例半月板损伤与关节软骨损伤相关性研究. 生物骨科材料与临床研究, 2005, 1: 14-15.
[13] Guettler J H, Demetropoulos C K, Yang K H, et al. Osteochondral defects in the human knee influence of defect size on cartilage rim stress and load redistribution to surrounding cartilage. Am J Sports Med, 2004, 32 : 1451-1458.
[14] Jakob R P, Franz T, Gautier E, et al. Autologous osteochondral grafting in the knee: indication, results, and reflections. Clinical orthopaedics and related research, 2002, 401: 170-184.
[15] Gross C, M all N, Dwyer T. Outcomes of osteochondral allograft transplantation in the knee. Arthroscopy,2013, 29 :575-588.
