经颅彩色多普勒超声对帕金森病早期诊断的研究
2014-05-17周鹏翔陈晓旭周欣彤
张 玲 周鹏翔 符 颖 陈晓旭 周欣彤
帕金森病(Parkinson disease ,PD) 又称震颤麻痹,研究表明PD患者黑质铁增加对超声波反射形成特定的图像起重要作用[1],随着超声设备及信号处理技术的进步,超声检查中图像分辨率不断提高,采用经颅彩色多普勒超声(transcranial Doppler sonography,TCS)检查中脑和黑质等脑深部结构可以获得高分辨率图像。应用TCS技术检测帕金森病(PD)患者中脑黑质,了解其成像的特异性表现,初步探讨该技术在我国帕金森病患者诊断中的临床价值。本研究依据PD患者黑质回声增强这一超声特异性表现结合医学图像分析软件,通过对灰度值的测定,对PD患者黑质病变进行定量分析,旨在为PD的早期诊断提供客观依据。
方 法
1.一般资料
选择我院神经内科诊断为帕金森病(PD)的患者作为研究对象,PD的标准诊断均符合2006年中华医学会神经病学分会运动障碍及帕金森病学组的诊断[2],存在运动减少及至少下列特征之一:肌肉僵直、静止性震颤或姿势不稳(非原发性视觉、前庭、小脑及本体感受功能障碍造成)。按照病程对患者进行分组,5年内PD患者30例定义为5Y-PD组,其中年龄48~78岁,男16人,女14人;10年以上PD患者33例定义为10Y-PD组,其中年龄58~83岁,平均男18人,女15人;同期选择无PD家族史,且排除帕金森综合征及其他锥体外系疾病的年龄与性别相匹配的健康志愿者35例定义为对照组,其中年龄57~80岁,男18人,女17人。排除标准:明确的脑卒中、脑外伤和脑炎史;痴呆、精神疾病、脑病及其他严重的中枢神经系统疾病病前曾应用抗精神药物;多巴胺耗竭药或明确神经毒素接触史。
2.检查方法
2.1 仪器:应用荷兰Philips IE33型彩色多普勒超声诊断仪,应用医学图像分析软件,采用MATLAB 平台,麦克奥迪数码医学图像分析系统(Motic Med 6.0,北京麦克奥迪图像技术有限公司生产) 软件。应用S5-1探头(频率1~5MHz),设置穿透深度14~16cm,动态范围45~55dB,图像亮度及时间增益补偿根据需要调整。
图1 黑质定量分析软件。图2 手工描记黑质回声增强区。
2.2 方法:首先沿眶听线轴向扫描中脑水平横断面,中脑位于图像的中间部位。正常情况下,蝴蝶状的中脑除中线部位的脑干中缝核和导水管呈强回声外,一般表现为相对均质的低回声,周围环绕的脚间池为强回声。感兴趣区(ROI) 以直径0.3~0.5 cm的圆形进行选取,避开异常强回声,用“手动分析”测得该区域的平均灰度值,并以大脑左右半球相同部位的平均灰度值作为回声强度的量化指标。所有入组患者均为双侧颞窗至少一侧透声良好,结构显示尚清晰,面积包络完整者,从该侧取得的图像进行两侧黑质(SN)回声信号的评定 (见图1,2)。
3.统计学方法
采用SPSS 13.0分析软件,所有计量数据均数±标准差表示,相关性分析采用Pearson相关分析法。
结 果
1.灰度值在PD病人中,与年龄、性别、病程做相关分析
灰度值与年龄无显著相关性(r=0.019,P=0.849);灰度值与性别无显著相关性(r=0.032,P=0.753);灰度值与病程呈显著正相关(r=0.903,P=0.000)(见图3)。
2.对照组与5Y-PD组、10Y-PD组灰度值比较
对照组与5Y-PD组、10Y-PD组灰度值比较中,病程越长、灰度值越高(见表1,图4)。
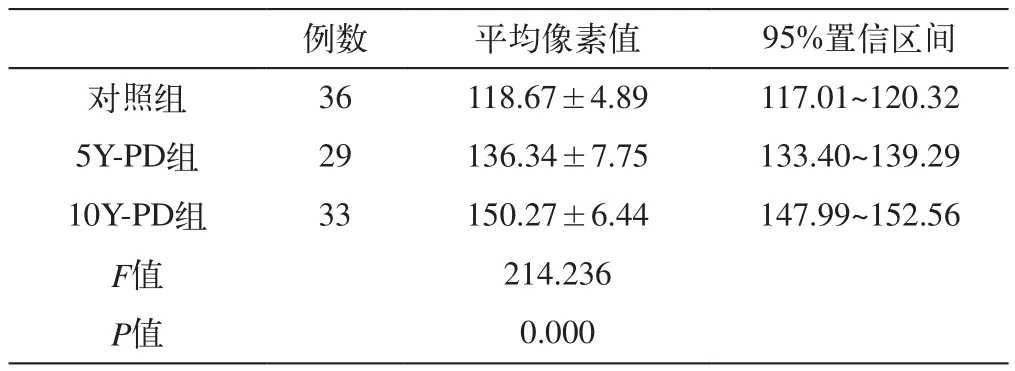
表1 对照组与5Y-PD组、10Y-PD组灰度值比较
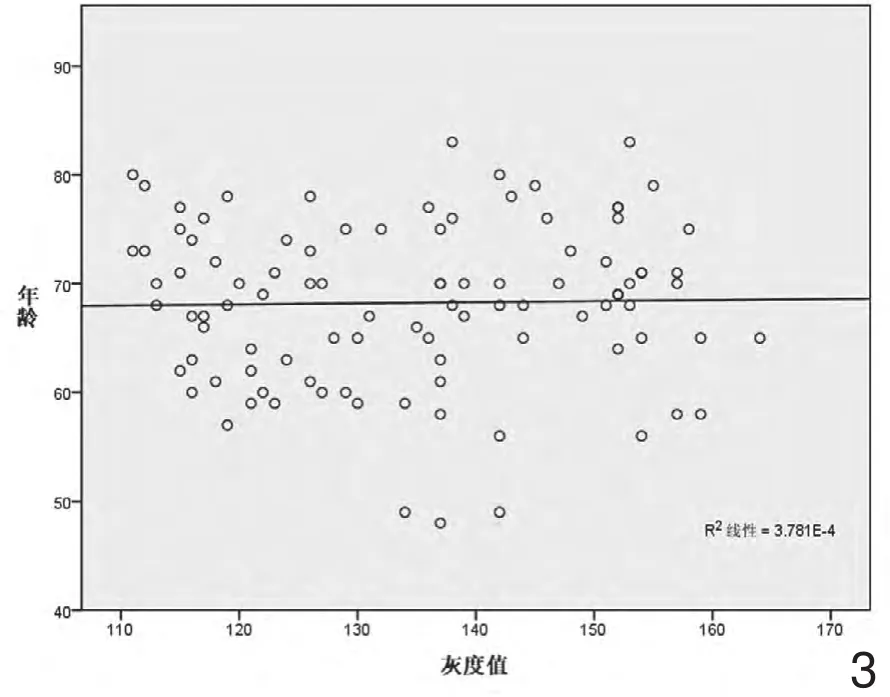
图3 灰度值与年龄相关分析。
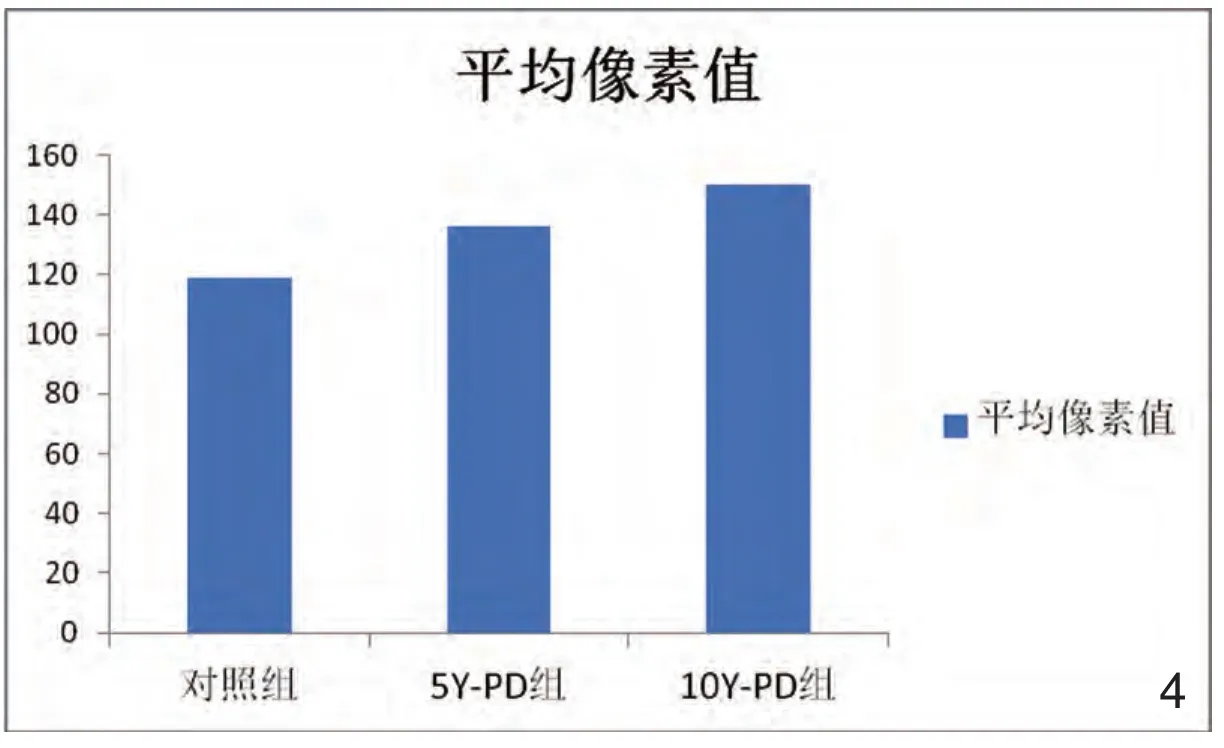
图4 对照组与5Y-PD组、10Y-PD组灰度值比较。
讨 论
帕金森病 是最常见的神经系统变性疾病之一,其特点是进行性黑质多巴胺能神经元变性缺失及路易小体形成[3]。随着对PD患者发病机制、发病过程的认识,认为PD在出现临床症状之前已存在器质性病变。Becker 等[4]在1995年首次报道PD患者经颞窗行TCS 检查可见中脑黑质区回声增强这一特异性表现,并且有研究对TCS证实黑质回声增强的正常人进行随访,发现大多数在2年的随访中被诊断为PD。
目前黑质回声增强原因尚不明确,一项对黑质回声增强的人群和黑质回声正常的人群的头部MRI进行研究发现黑质回声增强人群在MRI上的T 2信号延长[5],这表明黑质回声增强可能与铁含量有关。Riederer等[6]还发现这种铁蛋白水平的增高与PD病程的进展相一致,在PD的病程早期,铁的增高最初定位于DA能神经元的黑色素颗粒上。根据超声成像原理,图像中回声强弱的不同所反映的是各像素灰度值的不同,如果将所选定的某一区域中的每个像素点上的灰度数字化并加权平均, 就可以得出该区域的平均灰度值,其大小反映的是所测区域的组织密度及组织含量[7]。在中脑区域中,蝴蝶状中脑除中线部位的脑干中缝核和导水管呈强回声外,一般表现为相对均质的低回声,周围环绕的脚间池为强回声,而新月形的黑质正常情况下为均质低回声,当出现铁蛋白反映在图像上为回声增强,以往对于回声强度的判断仅通过肉眼观察,会造成一定的主观判断误差;本研究应用麦克奥迪数码医学图像分析系统(Motic Med 6.0,北京麦克奥迪图像技术有限公司生产),利用数码图像分析软件进行灰度值测定,这一技术一方面融入MRI 的后期计算机处理技术,使得超声显像更清晰,另一方面超声定量分析目前已应用于临床检查, 主要是进行灰度值测定。国外有将灰度值测定用于肩部和股部肌肉特性的研究[8],国内有用于肝脏疾病和心肌病变的定量研究报道[9],本研究对PD患者的中脑的黑质致密部进行手动勾画,可测得轮廓范围内面积及轮廓范围内的平均像素值(灰度值)。PD病程在5年内、10年以上,与健康对照组比较,二者与健康对照组有显著性差异。此结果与大多数研究一致,本研究也支持SN强回声的程度与患者的性别、年龄无关[10],但通过对灰度值的测量得出回声强度与病程的呈明显正相关(r=0.903,P=0.000),这与以往Gaenslen 等[11]的一项研究不但证实PD患者TCS检查见中脑黑质回声增强这一特性,同时发现黑质回声不随病程进展而发生改变[11]相矛盾,这说明图像实际测量的灰度值与肉眼判断有一定的差异。通过灰度值的测定在一定程度上可以将肉眼判断差别不大的黑质回声增强区分开来,对于减少操作者主观判断造成的误差更有意义。灰度值的测定可以预测PD的发生、发展程度,对于临床早期干预,加强监测具有重要意义。在正常对照组与病变组比较中,正常组为中等偏低回声、灰度值均在118.67±4.89;而病变组灰度值5年内136.34±7.751,10年以上150.27±6.44。通过肉眼判断得到的黑质回声是否异常的结论与灰度值测定结果有一致性, 但亦存在差异, 对照组的灰度值范围与病例组的灰度值范围存在部分交叠, 除实验误差外, 考虑图像实际灰度值与肉眼判断有一定的差异。在5年内、10年以上比较中黑质灰度值的差异,可能是黑质部位多巴胺能神经元丢失或轴突功能受损以及小胶是黑质体积较小,且易受到桥前池脑脊液的影响,导致该处细胞纤维排列和结构紊乱,意味着细胞功能异常的状态仍在持续, 进而发生坏死、凋亡的细胞增多, 发生软化和钙化的机会增加, 后期遗留神经功能损伤的机会就更大, 损伤就严重, 临床症状也更明显。也为PD的疾病严重程度的评估提供了研究方向,因此在黑质程度判断时, 超声灰度值分析有重要意义,在正常组与病例组对照中可以得出黑质回声越强、灰度值越高、患者病情严重程度越重。由于灰度值会因仪器之间的差别、参数的设定、操作者的手法等因素的影响而不同, 故本实验所有入选患者均采用同一台超声仪、同一操作者, 在保持超声参数条件相同的情况下。
TCS对PD的诊断高敏感性及特异性,超声灰度值定量的分析,因此有必要使其成为PD的常规检查,并可应用于大规模的人群筛查,使易患人群得以实施早期干预,从而更好地改变PD的预后。本文将进一步扩大样本量,更加广泛认识提高PD早期诊断的准确度。
[1] Almeida OP, Burton EJ, McKeith I, et al . MRI study of caudate nucleus volume in Parkinson's disease with and without dementia with Lewy bodies and Alzheimer's disease. Dement Geriatr Cogn Disord, 2003, 16: 57~ 63.
[2] 中华医学会神经病学分会运动障碍及帕金森病学组. 帕金森病的诊断. 中华神经科杂志,2006,39:408- 409.
[3] Berg D, Roggendorf W, Sch roder U, et al. Echogenicity of thesubstantia nigra:association with increased iron content and marker for susceptibility to nigrostriatal injury .A rch Neurol,2002,59:999–1005.
[4] Becker G, Berg D. Neuroimaging in basal ganglia disorders:perspectives for transcranial ultrasound. Mov Disord, 2001, 16: 23-32.
[5] Boelm ans K, Bodamm er NC, Suchorska B, et al. Diffusion tensor imaging of the corpus callosum differentiates corticobasal syndrome from Parkinson’s disease. Parkinsonism Relat Disord,2010, 16: 498-502.
[6] Riederer P,Dirr A,Goetz M,et al. Distribution of iron in different brain regions and subcellular compartments in Parkinson’s disease. J Ann Neurol,2012,32 (Suppl): S101- S104.
[7] Nielsen PK, Jensen BR, Darvann T, et al. Quantitativeultrasound tissue characterization in shoulder and thighmuscles: a new approach. BMC Musculoskelet Disord, 2006, 18: 2.
[8] 汪小毅, 林江莉, 李德玉, 等. 基于纹理分析的脂肪肝B超图像识别.航天医学与医学工程, 2004, 17 : 144-148.
[9] 吴江苇, 潘翠珍, 王宜杰. 扩张型心肌病心肌组织灰阶定量的临床应用价值 . 同济大学学报: 医学版, 2002,23 : 320- 322.
[10] Behnke S, Berg D, Naumann M, et al .Differentiation of Park in son,s disease and atypical parkinsonian synromes by transcran ialultrasound. Jneurol Neurosurg Psychiatry, 2005, 76 : 423-425.
[11] Gaenslen A, Unmuth B, Godau J, et al. The specificity and sensitivity of transcranial ultrasound in the differential diagnosis of Parkinson’s disease: a prospective blinded study . Lancet Neurol,2008, 7: 417-424.
