白芍总苷对糖尿病大鼠肾组织中内质网应激的影响
2014-05-18武晓旭章超群徐兴欣吴永贵
武晓旭,章超群,许 坤,徐兴欣,吴永贵
近年来研究[1-2]表明炎症机制是糖尿病肾病(diabetic nephropathy,DN)发生、发展的主要机制之一,而内质网应激 (endoplasmic reticulum stress,ERS)反应可以引起一系列压力信号的传导,其中包括氧化应激和炎症反应。在体外培养的实验[3]中,有学者用不同浓度的晚期终末产物刺激鼠足细胞,发现葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)的表达增加,同时诱导ERS。在用链脲佐菌素(streptozotocin,STZ)建立大鼠1型糖尿病模型的动物实验[4]中,显示模型组肾组织GRP78和CHOP/GADD153表达升高,表明ERS和DN相互联系。白芍总苷(total glucosides of paeony,TGP)是从中国传统中药芍药的干燥根中提取的混合物,具有抗炎和抑制自身免疫反应的作用[5]。TGP在临床上已用于类风湿性关节炎患者改善病情;在大量人及动物实验[6-9]中,也表明其对系统性红斑狼疮、强直性脊柱炎、变应性接触性皮炎及佐剂性关节炎具有治疗作用,且无明显毒副作用。有研究[10]表明TGP对DN有明显的保护作用,在此基础上,该实验从ERS通路观察TGP对DN大鼠的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 50只Munich-Wistar大鼠(购自安徽医科大学实验动物中心),昆明种,普通级,180~200 g。
1.1.2 主要试剂 STZ(美国Sigma公司);尿白蛋白测定试剂盒(法国SPI公司);兔抗大鼠GRP78多克隆抗体(美国Santa Cruz公司);兔抗大鼠磷酸化的蛋白激酶样内质网激酶(protein kinase R-like ER kinase,p-PERK)多克隆抗体及兔抗大鼠磷酸化的真核细胞翻译起始因子2α(eukaryotic initiation factor 2α,p-eIF2α)多克隆抗体(美国 Cell Signaling 公司);山羊血清、3%H2O2去离子水、二氨基联苯胺(DAB)显色试剂盒、二步法免疫组化检测试剂盒PV-9000(北京中杉金桥生物技术公司)。
1.1.3 干预药物 TGP由安徽医科大学魏伟教授惠赠。
1.2 方法
1.2.1 饲养条件 实验前所有大鼠均在室温(22±2)℃、相对湿度(55±5)%、光照周期12~12 h的环境中适应饲养1周。实验期间保证所有大鼠饮水、标准饮食充足,定时更换敷料,不予胰岛素治疗,连续观察8周。
1.2.2 糖尿病大鼠分组和模型制备 大鼠适应饲养1周后,被随机分为对照组(n=10)、模型组(n=10)和 TGP给药组(n=30)。STZ使用前用0.01 mmol/L的无菌柠檬酸缓冲液配制为6.5 g/L,pH 4.5,模型组和TGP给药组大鼠腹腔单次注射STZ(65 mg/kg),对照组注射等量柠檬酸缓冲液。2~3 d后用血糖仪经尾静脉采血测血糖,随机血糖≥16.7 mmol/L者视为糖尿病大鼠,TGP给药组再随机分为3组(n=10),TGP使用前溶于1%羧甲基纤维素钠溶液中,每天按50、100、200 mg/kg灌胃给药,对照组和模型组给予等量蒸馏水。
1.2.3 标本收集 实验8周末,用代谢笼收集所有大鼠24 h尿液,记尿量,置于-80℃冰箱保存待测尿白蛋白。称量大鼠体重,腹腔注射戊巴比妥麻醉大鼠,行右颈总动脉插管取血,置于-20℃冰箱中待测血糖。再通过右颈总动脉插管注入生理盐水反复灌洗肾脏,去除包膜后称量肾重。
1.2.4 生化指标的检测 尿白蛋白含量使用酶联免疫法测定,尿白蛋白含量与24 h尿量乘积即为UAER。血糖使用葡萄糖氧化酶法,用全自动生化分析仪测定。
1.2.5 免疫组化测定 GRP78、p-PERK 及 p-eIF2α的表达 肾组织用4%多聚甲醛溶液固定,石蜡包埋,制成2 μm厚经多聚赖氨酸处理的切片,采用PV两步法,石蜡切片烤片后常规脱蜡至水,微波热修复抗原,3%H2O2去离子水室温孵育以阻断内源性过氧化物酶,PBS冲洗,甩干后滴加山羊血清37℃孵育封闭非特异性抗原,甩去山羊血清,分别滴加GRP78一抗(1∶1 000),p-PERK一抗(1∶100)及p-eIF2α一抗(1∶100),用PBS代替一抗作为阴性对照,4℃过夜,PBS冲洗,依次滴加聚合物辅助剂和辣根酶标记山羊抗兔/小鼠IgG多聚体37℃孵育,应用二氨基联苯胺(DAB)显色,自来水充分冲洗、复染、脱水、透明、封片,镜下观察,阳性细胞呈棕黄色。
1.2.6 半定量分析 高倍镜视野(×400倍)下每张切片随机采集5个肾皮质区,使用Image Pro Plus 6.0图像分析软件处理图像,用平均光密度(mean optical density,MOD)值判定结果。
1.3 统计学处理 采用SPSS 17.0统计软件进行分析,计量资料以±s表示,UAER为非正态分布资料,采用对数转换后以几何均数×/÷耐受因子表示。采用单因素方差分析。
2 结果
2.1 各组一般情况及生化指标的变化 实验期间,模型组及TGP给药组大鼠均出现体重减轻,多饮、多尿、多食。实验8周末,TGP不能阻止大鼠血糖增高和体重减低。与对照组相比,模型组大鼠相对肾重(肾重/体重)明显增加 (P<0.05),血糖、UAER显著升高(P<0.01)。与模型组相比,各TGP给药组大鼠相对肾重有所下降,但差异无统计学意义;各TGP给药组大鼠 UAER明显下降(P<0.05,P<0.01),见表1。
表1 各组大鼠一般指标变化(n=10,±s)
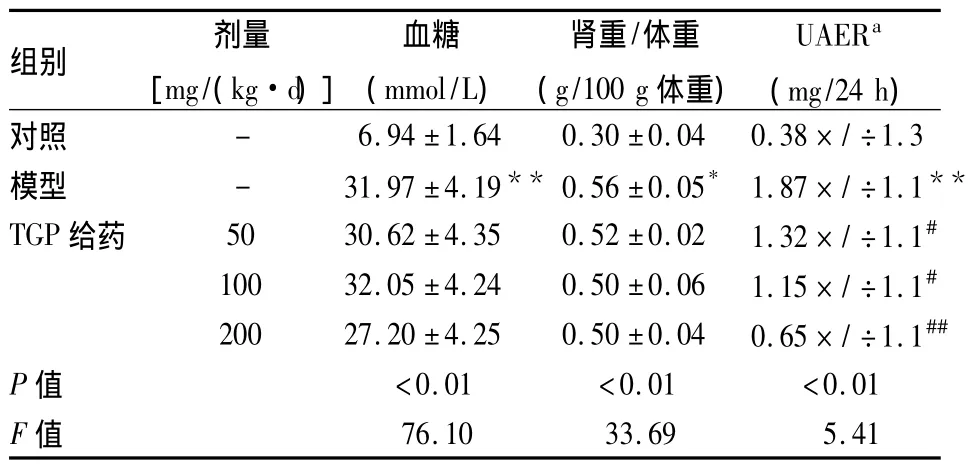
表1 各组大鼠一般指标变化(n=10,±s)
与对照组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01;a表示为几何均数×/÷耐受因子
?
2.2 各组GRP78蛋白的表达 GRP78在对照组远曲小管和集合管上皮细胞胞质中呈弱表达,在模型组表达增强,主要在近曲小管胞质中,部分肾小球细胞胞质也呈强阳性表达。与对照组相比,模型组大鼠GRP78蛋白在肾小球和肾小管-间质中表达明显升高(P<0.01)。与模型组相比,TGP各组大鼠GRP78在肾小球中表达低于模型组,但差异无统计学意义;但在肾小管-间质中表达明显降低(P<0.01)。见表2,图1A1~E1。
表2 各组大鼠肾组织免疫组化指标GRP78变化(n=10,±s)
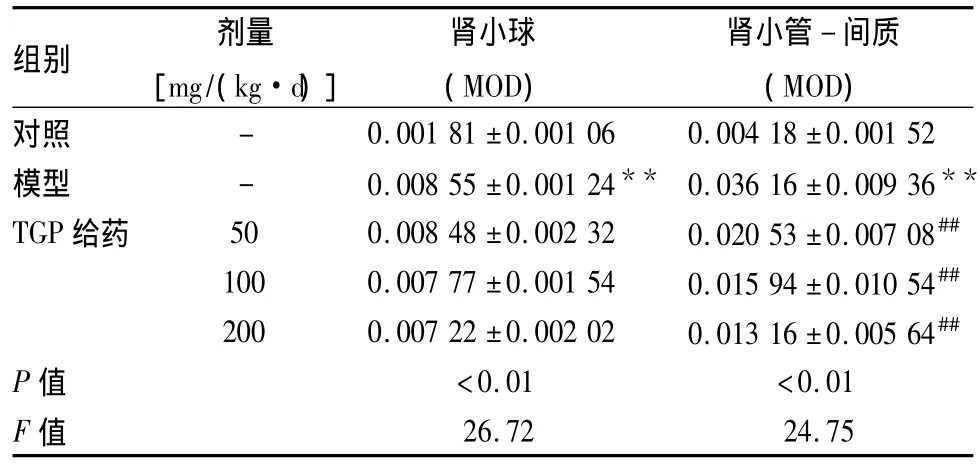
表2 各组大鼠肾组织免疫组化指标GRP78变化(n=10,±s)
与对照组比较:**P<0.01;与模型组比较:##P<0.01
?
2.3 各组p-PERK蛋白的表达 p-PERK在对照组大鼠肾小管上皮细胞内呈弱表达,肾小球内无表达。与对照组相比,模型组大鼠p-PERK蛋白在肾小管上皮细胞胞质中表达明显增强(P<0.01)。与模型组相比,TGP各组p-PERK蛋白在肾小管-间质中表达明显降低(P<0.01)。见表3,见图1A2~E2。
2.4 各组 p-eIF2α蛋白的表达 对照组 p-eIF2α蛋白少量表达于肾小球与肾小管-间质。与对照组相比,模型组大鼠p-eIF2α蛋白在肾小球及肾小管-间质中表达均显著增加 (P<0.01)。与模型组相比,TGP各组p-eIF2α蛋白在肾小球及肾小管-间质中表达均明显降低 (P<0.01)。见表4、图1A3~E3。
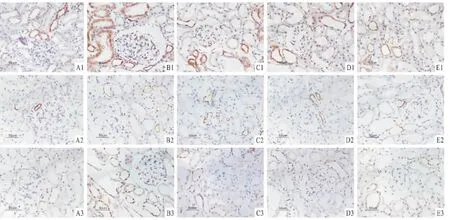
图1 各组肾组织中GRP78、p-PERK、p-eIF2α的表达 PV二步法×4001:GRP78;2:p-PERK;3:p-eIF2α;A:对照组;B:模型组;C:TGP 50 mg/(kg·d)组;D:TGP 100 mg/(kg·d)组;E:TGP 200 mg/(kg·d)组
表3 各组大鼠肾组织免疫组化指标p-PERK变化(n=10,±s)
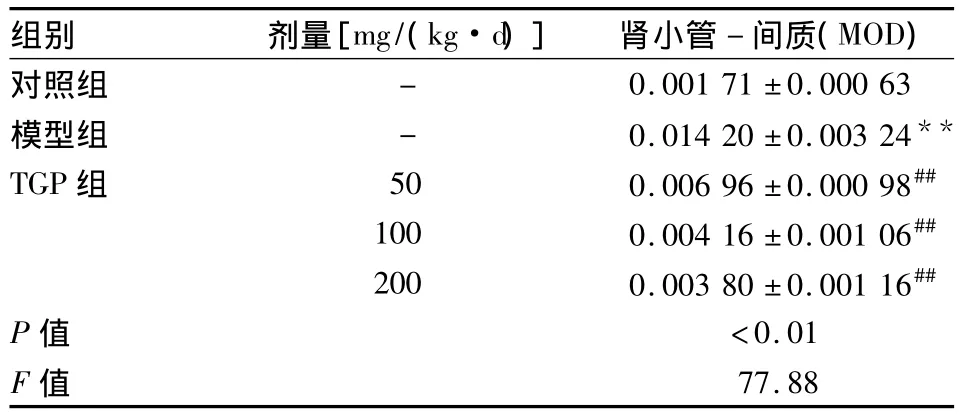
表3 各组大鼠肾组织免疫组化指标p-PERK变化(n=10,±s)
与对照组比较:**P<0.01;与模型组比较:##P<0.01
?
表4 各组大鼠肾组织免疫组化指标p-eIF2α变化(n=10,±s)

表4 各组大鼠肾组织免疫组化指标p-eIF2α变化(n=10,±s)
与对照组比较:**P<0.01;与模型组比较:##P<0.01
?
3 讨论
内质网稳态情况下,内质网膜上有3种ERS元件与内质网分子伴侣GRP78结合,这些蛋白分别是肌醇需求酶1,蛋白激酶样内质网激酶(protein kinase R-like ER kinase,PERK)和活化转录因子6。ERS发生时,为使细胞适应应激,GRP78离开上述3种跨膜蛋白,触发未折叠蛋白反应(unfolded protein response,UPR)[11]。PERK 是一种丝氨酸/苏氨酸蛋白激酶,当未折叠蛋白及错误蛋白在内质网内腔内积聚时,PERK发生自身二聚化和磷酸化,继而使eIF2α发生磷酸化,从而衰减大部分蛋白翻译,消除不成熟蛋白,减轻内质网负荷[12]。
近年来越来越多的研究[13-14]显示ERS与肾脏疾病联系紧密。Lindenmeyer et al[15]以 DN 患者为研究对象,行肾穿刺或组织检查,发现DN患者肾组织中UPR相关基因GRP78等的mRNA较对照组患者显著增高,且ERS水平与DN的病变程度密切相关。另一研究中,研究者用STZ处理的9个月和22个月年龄的小鼠,经过4个月的DM病程后,这些小鼠出现蛋白尿,肌酐升高,肾小球硬化,肾小管炎症浸润和纤维化,同时糖尿病组小鼠肾组织中GRP78、CHOP、p-PERK 和 p-eIF2α 表达增加,而在22个月的小鼠中表达更加明显[16]。
对肾组织中ERS的抑制可能延缓DN的发展。4-苯基丁酸是一种分子伴侣,研究者用4-苯基丁酸处理糖尿病大鼠,结果显示用药组UAER较糖尿病组显著降低,同时肾组织中GRP78和p-PERK的表达较糖尿病组明显降低,炎症因子及纤维化因子也显著降低[17]。国内也有动物模型实验表明糖尿病大鼠肾小管中p-PERK和p-eIF2α较正常组增多,经血管紧张素转换酶抑制剂治疗可明显降低二者的表达[18]。均提示中断ERS反应在防治DN病程进展中具有重要的意义。
TGP为毛茛科植物芍药的干燥根中提取的一组糖苷类物质,对T、B淋巴细胞的增殖有双向调节作用,具有抗炎、抗氧化和免疫调节的作用,对类风湿性关节炎、系统性红斑狼疮及免疫性肝损害等疾病有明确疗效。大量国内研究[6-9]证实TGP对控制急慢性及免疫炎症性疾病有明显的作用,在对系膜增生性肾小球肾炎(mesangial proliferative glomerulonephritis,MsPGN)大鼠的实验研究中,发现TGP可以改善MsPGN大鼠肾小球系膜细胞增生和系膜基质聚积,同时减轻蛋白尿和血肌酐、尿素氮,提示TGP可以部分逆转受损的肾小球病理改变[19]。该课题组前期研究[20-22]显示 TGP既可减少 ICAM-1、IL-1及TNF-α,也可抑制氧化应激,从而推测TGP对糖尿病大鼠肾脏的保护反应与其抑制炎症免疫反应及氧化应激有关。本实验中,TGP给药可以显著降低模型组大鼠UAER,明显减少肾组织中ERS相关蛋白 GRP78、p-PERK和 p-eIF2α的表达,提示TGP有保护DN大鼠肾脏的作用,并且可能与抑制DN大鼠肾组织中的UPR反应,抑制PERK-eIF2α通路有关。提示TGP对DN肾脏的保护作用可能与抑制ERS反应有关,但因ERS与炎症反应通过一系列信号传导通路包括产生活性氧、内质网钙离子的释放、核因子κB和有丝分裂原激活蛋白激酶等相互关联[2],其具体机制尚不明确,可在今后的研究中得以阐述。
[1]Lenz O,Fornoni A,Ijaz A,et al.Role of inflammation in diabetic nephropathy[J].Curr Diabetes Rev,2008,4(1):10 -7.
[2]Zhang K,Kaufman R J.From endoplasmic-reticulum stress to the inflammatory response[J].Nature,2008,454(7203):455 -62.
[3]Fukami K,Yamagishi S,Ueda S,et al.Role of AGEs in diabetic nephropathy[J].Curr Pharm Design,2008,14(10):946 -52.
[4]Liu G,Sun Y,Li Z,et al.Apoptosis induced by endoplasmic reticulum stress involved in diabetic kidney disease[J].Biochem Biophys Res Commun,2008,370(4):651-6.
[5]周金黄,刘干中.中药药理与临床研究进展(第1册)[M]//徐叔云,陈敏珠,魏 伟,等.免疫药理与临床.北京:中国科学技术出版社,1992:49-59.
[6]陈 静.白芍总苷对系统性红斑狼疮治疗作用及不良反应[J].中国医疗前沿,2013,6:19.
[7]李志军,刘 雁,梅永君,等.白芍总苷治疗强直性脊柱炎的疗效及其机制探讨[J].中药药理与临床,2009,25(3):68-70.
[8]王 春,李传应,袁 君,等.白芍总苷联合强的松治疗豚鼠变应性接触性皮炎[J].安徽医科大学学报,2012,47(11):1316-20.
[9]徐 红,窦学荣,王伯松.白芍总苷对兔佐剂性关节炎滑膜细胞增殖的影响[J].泰山医学院学报,2007,28(2):110-2.
[10]Su J,Zhang P,Zhang J J,et al.Effects of total glucosides of paeony on oxidative stress in the kidney from diabetic rats[J].Phytomedicine,2010,17(3):254 -60.
[11]Inagi R.Endoplasmic reticulum stress in the kidney as a novel mediator of kidney injury[J].Nephron Exp Nephrol,2009,112(1):e1-9.
[12]Cunard R,Sharma K.The endoplasmic reticulum stress response and diabetic kidney disease[J].Am J Physiol Renal Physiol,2011,300(5):F1054-61.
[13]Dickhout J G,Krepinsky J C.Endoplasmic reticulum stress and renal disease[J].Antioxid Redox Signal,2009,11(9):2341 -52.
[14]Inagi R.Endoplasmic reticulum stress as a progression factor for kidney injury[J].Curr Opin Pharmacol,2010,10(2):156 -65.
[15]Lindenmeyer M T,Rastaldi M P,Ikehata M,et al.Proteinuria and hyperglycemia induce endoplasmic reticulum stress[J].J Am Soc Nephrol,2008,19(11):2225 -36.
[16]Wu J,Zhang R,Torreggiani M,et al.Induction of diabetes in aged C57B6 mice results in severe nephropathy:an association with oxidative stress,endoplasmic reticulum stress,and inflammation[J].Am J Pathol,2010,176(5):2163 -76.
[17]Qi W,Mu J,Luo Z F,et al.Attenuation of diabetic nephropathy in diabetes rats induced by streptozotocin by regulating the endoplasmic reticulum stress inflammatory response[J].Metabolism,2011,60(5):594-603.
[18]Sun H L,Sun L,Li Y Y,et al.ACE-inhibitor suppresses the apoptosis induced by endoplasmic reticulum stress in renal tubular in experimental diabetic rats[J].Exp Clin Endocr Diab,2009,117(7):336-44.
[19]周登余,徐星铭,戴 宏,等.白芍总苷对大鼠系膜增生性肾小球肾炎的保护作用[J].安徽医科大学学报,2006,41(2):146-9.
[20]袁 亮,吴永贵,郝 丽,等.白芍总苷对糖尿病大鼠肾脏保护作用及部分机制[J].中国药理学通报,2007,23(6):421 -6.
[21]任克军,吴永贵,方 芳,等.白芍总苷对糖尿病大鼠肾组织IL-1与TNF-α表达的影响及机制[J].中华肾脏病学,2007,23(11):747-8.
[22]方 芳,吴永贵,董 婧,等.白芍总苷对糖尿病大鼠肾组织氧化应激的影响[J].中国药理学与毒理学杂志,2008,22(3):199-204.
