NO水平下降通过氧化应激引起人胎盘滋养细胞凋亡
2014-05-18王艳华张慧萍周龙霞陈久凯马文斌孔繁琪刘现梅韩学波杨晓玲姜怡邓
王艳华,张慧萍,田 珏,周龙霞,陈久凯,马文斌,孔繁琪,赵 丽,刘现梅,韩学波,杨晓玲,姜怡邓
(宁夏医科大学1.检验学院、2.基础医学院、3.总医院,宁夏 银川 750004)
妊娠期高血压疾病(hypertension disorder complicating pregnancy,HDCP)是孕妇因妊娠后内环境改变致滋养细胞功能障碍为主要病理特征的妊娠期特有疾病之一[1],是导致孕产妇和围生儿死亡的重要原因,但其病因至今未明。研究发现,细胞凋亡在滋养细胞的浸润、迁移及胎盘种植的过程中可能发挥重要作用,且与HDCP发病机制密切相关[2]。胎盘是母体与胎儿间进行物质交换的关键靶器官,滋养细胞凋亡在胎盘形成、发育以及整个妊娠过程中起重要作用。目前,研究认为NO在调节胎盘血管阻力,保持子宫胎盘血液循环畅通及调节滋养细胞分化等方面具有重要作用[3]。另外,有研究报道,胎盘局部NO水平下降,可直接导致胎盘组织发生上述影响滋养细胞的病理改变,因此,可认为胎盘局部NO合成下降与胎盘滋养细胞病理改变密切相关。同时,研究表明,NO参与细胞凋亡的生物调节[4],氧化应激是造成细胞凋亡的重要环节[5]。然而,NO是否可以通过氧化应激调控滋养细胞凋亡未见报道。因此,本实验选取人胎盘滋养细胞为研究对象,通过一氧化氮合酶(NOS)抑制剂N-硝基-L-精氨酸甲酯(L-NAME)有效抑制NO的合成,观察NO水平下降对人胎盘滋养细胞凋亡的影响,并探讨氧化应激在其中所起的作用。
1 材料与方法
1.1 试剂及细胞培养 人胎盘滋养细胞株(HTR-8)来源于复旦IBS细胞库;DMEM F12培养基、胎牛血清、100 kU·L-1青霉素和0.1 g·L-1链霉素均购自Gibco公司;L-NAME购自Sigma公司;Annexin VFITC细胞凋亡检测试剂盒购自贝博试剂公司;一氧化氮(NO)、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒均购自南京建成生物工程研究所;BCA蛋白含量检测试剂盒购自南京凯基生物科技发展有限公司。采用DMEM F12培养基培养细胞(含10%胎牛血清、100 kU·L-1青霉素和0.1 g·L-1链霉素),培养条件为37℃,5%的CO2。
1.2 实验设计及分组 将HTR-8细胞分为对照组(0μmol·L-1的 L-NAME)和实验组,每组 3例样品。实验组分别用不同浓度的L-NAME(10、100、500、1 000μmol·L-1)干预。
1.3 四甲基偶氮唑蓝染色法(M TT法)测定细胞存活率 取对数生长期的细胞,制成每毫升5×104个细胞的悬液接种,培养24 h后,各组分别加入相应药物孵育24、48 h,吸弃液体,加入终浓度0.5 g·L-1MTT 100μl,继续培养4 h,弃去上清液,加入DMSO 150μl,微量震荡10min,于酶标仪上490 nm测定各孔吸光度(A)值,通过与对照组比较求出存活率。存活率/%=实验组吸光度(A)值/对照组吸光度(A)值×100%。
1.4 Annexin V-FITC检测细胞凋亡 用不含EDTA的胰酶消化细胞,300×g,2~8℃,离心5min,弃培养基。冷PBS洗涤细胞2次。用400μl 1×Annexin V结合液悬浮细胞,浓度大约为1×109cells·L-1。在悬液中加入5μl Annexin V-FITC染色液,轻轻混匀后,于2~8℃避光孵育15 min,加入10μl PI染色液后混匀,避光孵育5min,立即用美国BD公司FACSCalibur流式细胞仪检测。
1.5 细胞电镜标本制备 细胞经胰酶消化后,收集于离心管中,800 r·min-1离心沉淀,用预冷的2.5%戊二醛磷酸缓冲液(pH 7.4)固定30 min,0.1 mol·L-1磷酸缓冲液洗15 min,重复3次;1%锇酸(pH 7.4)固定30 min,再用0.1 mol·L-1磷酸缓冲液洗 15 min,共 3次;乙醇逐级脱水后,浸透,Epon812胶囊内包埋,聚合;超薄切片,醋酸铀、柠檬酸铅双重染色;采用日立HITACHIH-7650透射电镜观察并取图。
1.6 NO、T-AOC、SOD和MDA的检测 用橡皮刮子刮下细胞,1 000 r·min-1,离心 10 min,弃上清,1 ml PBS轻轻吹打,1 000 r·min-1,离心 10 min,弃上清,重悬于0.5 ml缓冲液中,超声破碎细胞。上述样本用凯基BCA蛋白含量检测试剂盒测定蛋白浓度,按相应试剂盒说明书检测NO、T-AOC、SOD和MDA水平,并计算结果。
1.7 统计学处理 用Prism 5.0统计软件进行统计学分析,结果以¯x±s表示,多样本均数间比较采用One-way ANOVA检验,组间两两比较用 Student-Newman-Keuls检验,两个变量相关性分析采用Pearson相关系数分析。
2 结果
2.1 L-NAME对人胎盘滋养细胞存活率的影响不同浓度的L-NAME干预HTR-8细胞24、48 h后,MTT法检测并计算各组细胞存活率。干预24 h对细胞的存活率无明显影响,然而,干预HTR-8细胞48 h后,与对照组比较,从 100μmol·L-1的 LNAME组开始细胞增殖受到明显抑制,其细胞存活率呈现随着剂量增大而逐渐下降的趋势,结果提示L-NAME对HTR-8细胞生长有抑制作用。见Fig 1。
2.2 L-NAME引起人胎盘滋养细胞NO水平下降与对照组比较,100、500、1 000μmol·L-1的 LNAME组滋养细胞中NO水平明显降低(P<0.01)。见Fig 2。
2.3 L-NAME对人胎盘滋养细胞凋亡的影响 不同浓度的L-NAME干预HTR-8细胞后,Annexin-V FITC染色、流式细胞定量定性分析结果显示:随着L-NAME浓度的增加,细胞凋亡数也逐渐增加(P<0.01),呈剂量依赖关系。以上提示,L-NAME可诱导HTR-8细胞发生凋亡。见Fig 3。

Fig 1 Effect of L-NAME on survival rate of HTR-8 cells*P<0.05 vs control group
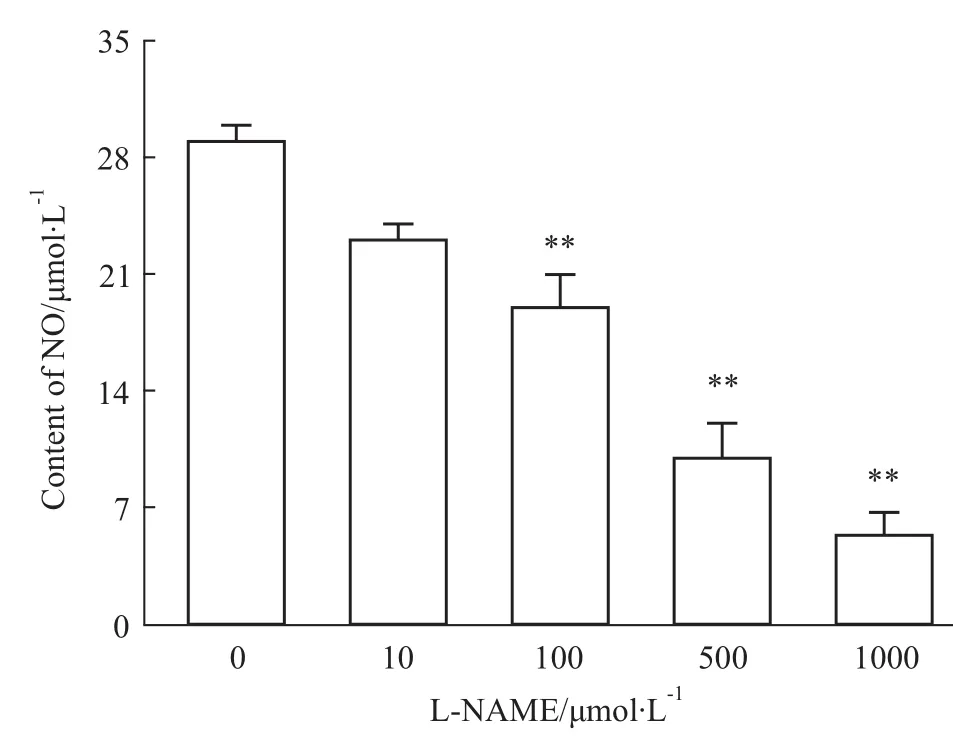
Fig 2 Levels of NO after different concentrations of L-NAME intervenes HTR-8 cells**P<0.01 vs control group
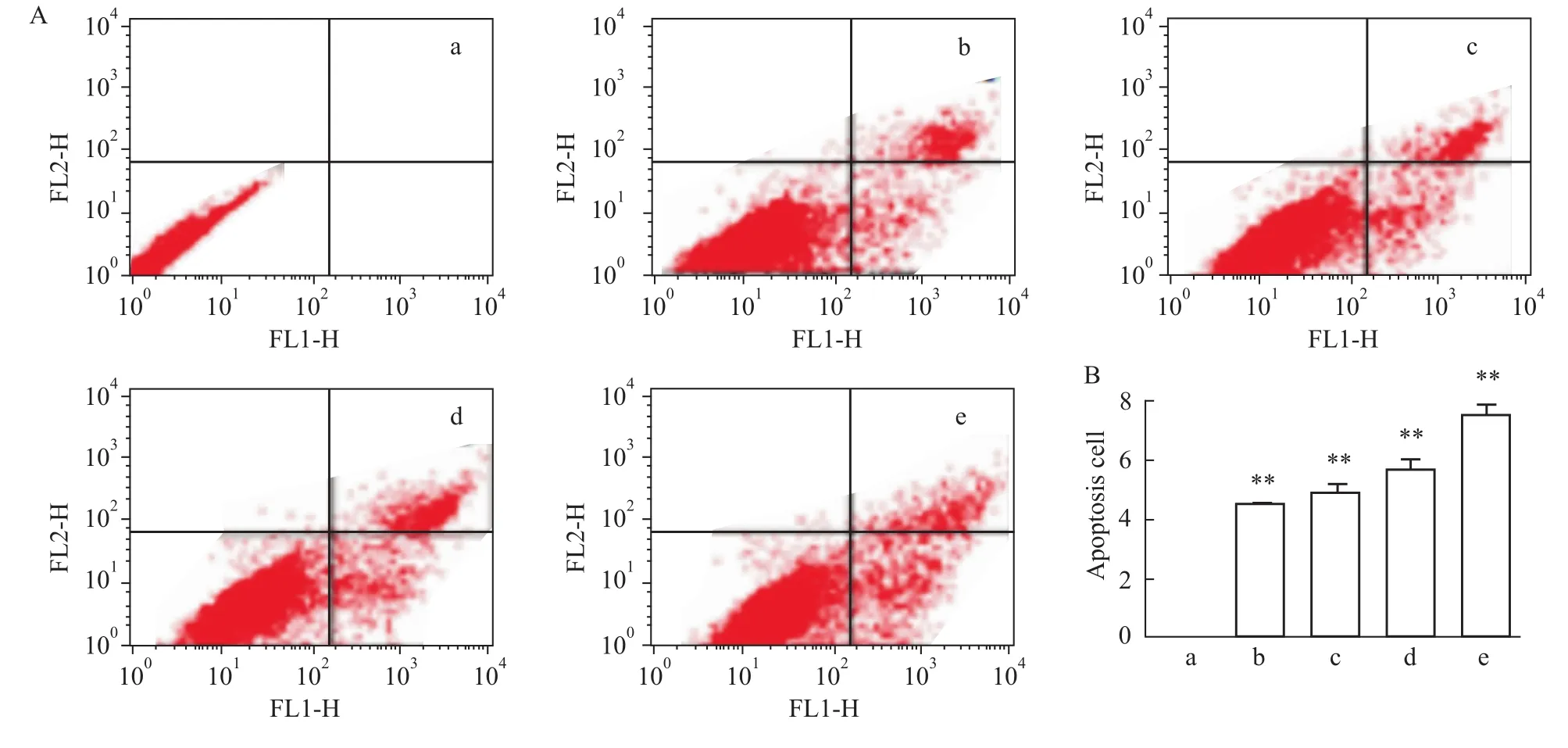
Fig 3 Effects of L-NAME on HTR-8 cells apoptosisA,B:Quantification of cell apoptosis by flow cytometer.In each panel,the lower rightquadrant indicated the apoptotic cells.a:Control group;b:10 μmol·L-1 L-NAME group;c:100μmol·L-1 L-NAME group;d:500μmol·L-1 L-NAME group;e:1 000μmol·L-1 L-NAME group.**P<0.01 vs control group
2.4 NO水平与细胞凋亡数相关性分析 为了进一步明确NO水平降低与凋亡的关系,将NO水平与细胞凋亡数进行相关性分析,结果显示:NO水平与细胞凋亡数(r=-0.5210)呈负相关,因此,NO水平降低与滋养细胞凋亡存在因果关系。见Fig 4。
2.5 透射电镜观察滋养细胞超微病理结构改变对照组细胞膜完整,细胞核核膜光滑,染色质均匀,粗面内质网及高尔基器丰富,线粒体内外膜完整,嵴结构清楚;10μmol·L-1L-NAME组可见细胞膜完整,细胞核核膜完整,核仁明显,细胞器有轻度扩张或可见致密型线粒体;100μmol·L-1L-NAME组染色质凝集或边集,线粒体肿胀或浓缩、嵴断裂或溶解,甚至消失,形成空泡,可见凋亡小体(箭头所指);500μmol·L-1L-NAME组细胞膜完整,染色质略微聚集凝固,细胞质内有大量空泡,线粒体肿胀、嵴断裂或溶解,甚至消失;1 000μmol·L-1L-NAME组细胞核形态不规则,核膜固缩不规则,染色质凝集或边集,似凋亡前体(箭头所指),细胞质内有大量空泡。见Fig 5。
2.6 不同浓度L-NAME干预HTR-8细胞后TAOC、SOD及MDA的变化 结果显示,与对照组比较,100、500、1 000μmol·L-1的 L-NAME组细胞中T-AOC、SOD水平明显降低(P<0.05),而 500、1 000μmol·L-1的L-NAME组细胞中MDA的含量明显升高(P<0.05)。见Fig 6。
2.7 T-AOC、SOD及MDA含量与细胞凋亡数相关性分析 为了进一步确定氧化应激在HTR-8细胞凋亡中起作用,将细胞内T-AOC、SOD及MDA含量与细胞凋亡数进行相关性分析,结果显示:细胞凋亡数与 T-AOC(r=-0.3212)、SOD(r=-0.2779)水平呈负相关,与MDA(r=0.2807)含量呈正相关。见Fig 7。
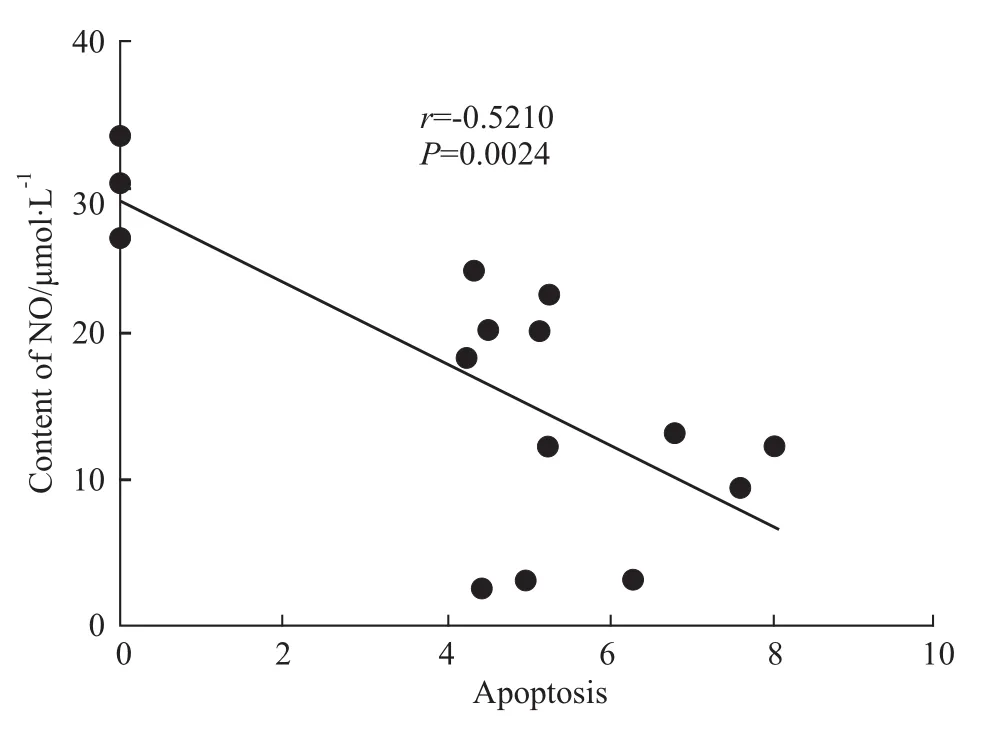
Fig 4 Scatter p lots of Spearman correlation coefficient corresponding between apoptosis and NO content in HTR-8 cells

Fig 5 Characteristics of trophoblast cell ultrastructure under electron m icroscopeA:Control group;B:10μmol·L-1 L-NAME group;C:100μmol·L-1 L-NAME group;D:500μmol·L-1 L-NAME group;E:1 000μmol·L-1 L-NAME group
3 讨论
近年来研究已证实,妊娠过程中胎盘组织存在滋养细胞凋亡现象,且对滋养细胞迁移、浸润及胎盘种植有重要调节作用。胎盘滋养细胞凋亡过度可能导致胎盘浅着床,造成子宫螺旋动脉重建失败,最终出现胎盘血液灌注量减少而引发HDCP的发生,提示胎盘滋养细胞的凋亡现象可能是HDCP发生、发展的核心环节[2],但滋养细胞凋亡的机制有待研究。研究表明[6],HDCP患者血浆NO较正常孕妇明显下降,其下降的程度与病情严重程度呈正比,提示,妊娠期间NO分泌不足可能是HDCP的重要致病因素之一。适量的NO水平是保证子宫胎盘循环低阻、低压、高流量的关键,这是机体对正常妊娠的保护性机制。另外,有研究报道,NO对细胞凋亡起着双向调控作用,在某些细胞中,NO可以促进凋亡,而在另外一些细胞(如肝细胞)中却可以抑制凋亡。例如,NO可介导一些细胞保护性基因如热休克蛋白HSP70和 HSP32的表达,从而抵抗 TNF-α、氧离子和亚硝酸盐离子等诱导的细胞凋亡[7]。NO水平下降是否可调控滋养细胞凋亡及其机制有待进一步研究,因此,本研究采用 NOS抑制剂(LNAME)干预人胎盘滋养细胞,间接观察NO水平降低对人胎盘滋养细胞凋亡的影响。研究结果显示:不同浓度的L-NAME干预HTR-8细胞后,导致细胞存活率及NO水平的降低,并引起HTR-8细胞发生凋亡,电镜结果在100、1 000μmol·L-1L-NAME组可见凋亡小体及凋亡前体,而500μmol·L-1LNAME组凋亡不明显,这可能由于电镜有其局限性,样品定位和图像分析困难,观察视野小,视野可能没有捕捉到,结合流式细胞仪检测细胞凋亡结果,500 μmol·L-1L-NAME组存在明显的凋亡。为了进一步明确NO水平与滋养细胞凋亡的关系,将HTR-8细胞内NO水平与细胞凋亡数进行相关性分析,NO水平与细胞凋亡数呈负相关。因此,NO水平降低与滋养细胞凋亡存在因果关系,但其机制有待探讨。
已有证据表明,氧化应激在HDCP发病机制中也起着关键作用,和正常妊娠相比,HDCP患者胎盘中脂质过氧化物增加,抗氧化酶减少[8]。研究表明,活性氧所致的氧化应激是造成细胞凋亡的重要环节。正常情况下,机体内活性氧的产生和清除处于动态平衡状态,所以对机体并无有害影响。而多种有害刺激可打破这种平衡,致活性氧大量生成而超过抗氧化系统的清除能力,机体就会形成氧化应激状态,促进细胞凋亡甚至导致病理损伤。NO是体内产生的血管舒张因子,除可调节血压外,在清除自由基等方面也起着重要作用。研究表明[9],NO以多种形式保护细胞免受过氧化损伤,包括与多种脂质过氧化产物以近扩散速率进行反应,阻止脂质过氧化链,甚至抑制细胞凋亡。为了证实NO水平降低引起滋养细胞凋亡是否通过氧化应激,我们检测了氧化应激指标。正如结果所示,100、500、1 000 μmol·L-1的L-NAME组 T-AOC、SOD水平降低,而MDA的含量升高。SOD是体内抗氧化防御系统的第一道防线,在阻止自由基和脂质过氧化对机体的损害方面起关键作用[10]。SOD活性下降引发脂质过氧化物在金属离子存在下催化裂解产生MDA。通常MDA用来间接反映氧自由基的存在及对细胞的损伤程度,MDA对细胞有毒性作用,可与蛋白质分子内和分子间交联,诱发细胞凋亡[11]。为了进一步确定氧化应激在HTR-8细胞凋亡中起作用,将HTR-8细胞内T-AOC、SOD及MDA含量与细胞凋亡数进行相关性分析,结果显示,细胞凋亡数与HTR-8细胞内T-AOC、SOD含量呈负相关,与MDA含量呈正相关,提示NO水平降低引起HTR-8细胞发生氧化应激,促进滋养细胞凋亡可能是HDCP致病的机制之一。
综上所述,NO水平降低能够诱导人胎盘滋养细胞发生凋亡,而NO水平降低引起的氧化应激可能是其重要机制之一,这对于深入探讨NO分泌不足引起HDCP提供了一定的实验依据。

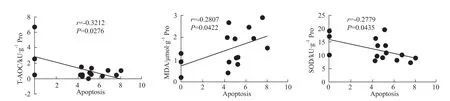
Fig 7 Scatter p lots of Spearman correlation coefficient corresponding between apoptosis and T-AOC,SOD and MDA content in HTR-8 cells
参考文献:
[1] Longtine M S,Barton A,Chen B,et al.Live-cell imaging shows apoptosis initiates locally and propagates as a wave throughout syncytiotrophoblasts in primary cultures of human placental villous trophoblasts[J].Placenta,2012,33(12):971-6.
[2] 刘美玲,彭景梗.滋养层细胞凋亡调控的研究[J].生理科学进展,2004,35(4):335-7.
[2] Liu M L,Peng JG.Study on the regulation of apoptosis of trophoblast cells[J].Progr Physiol Sci,2004,35(4):335-7.
[3] Sladek SM,Magness RR,Conrad K P.Nitricoxide and pregnancy[J].Am JPhysiol,1997,272(2Pt2):R441-63.
[4] Kim YM,Talanian R V,Billiar TR.Nitric oxide inhibits apoptosis bypreventing increases in caspase-3-like activity via two distinct mechanisms[J].JBiol Chem,1997,272(49):31138-48.
[5] 张骏艳,姚 华,李 晟,等.Urantide对大鼠心肌缺血/再灌注后心肌细胞凋亡的作用及机制研究[J].中国药理学通报,2013,29(5):648-54.
[5] Zhang JY,Yao H,Li S,et al.Regulation of urantide in PI3K/Akt and PKC signaling transduction inmyocardial ischemia-reperfusion injury to relieve the cardiomyocyte apoptosis in rats and itsmechanism[J].Chin Pharmacol Bull,2013,29(5):648-54.
[6] Shaarnash A H,Elsonosy E D,ZakhariM M,et al.Placental nitric oxide synthase(NOS)aetivity and nitric oxide(NO)production in normal pregnancy,precelampsia and eclampsia[J].Int JGynaecol Obstet,2001,72(2):127-33.
[7] Kim YM,de Vera M E,Watkins SC,etal.Nitric oxide protects culured rat hepatocytes from tumor necrosis factor-alpha-induced apoptosis by inducing heatshock protein 70 expression[J].JBoil Chem,1997,272(2):1402-11.
[8] Huang Q T,Zhang M,Zhong M,et al.Advanced glycation end products as an upstream molecule triggers ROS-induced sFlt-1 production in extravillous trophoblasts:a novel bridge between oxidative stress and preeclampsia[J].Placenta,2013,34(12):1177-82.
[9] BeligniM V,Fath A,Bethke PC,et al.Nitric oxide acts as an antioxidant and delays programmed cell death in barley aleurone lay-ers[J].Plant Physiol,2002,129(4):1642-50.
[10]Zelko IN,Mariani T J,Folz R J.Superoxide dismutasemultigene family:a comparison of the CuZn-SOD(SOD1),Mn-SOD(SOD2),and EC-SOD(SOD3)gene structures,evolution,and expression[J].Free Radic Biol Med,2002,33(3):337-49.
[11]张 敏,朱 颖,胡 波,等.A-actinin-4与多柔比星肾病大鼠氧化应激状态的关系[J].实用儿科临床杂志,2009,24(5):358-60.
[11]Zhang M,Zhu Y,Hu B,et al.The relationship between A-actinin-4 and the oxidative stress of doxorubicin nephropathy rats[J].J Appl Clin Pediatr,2009,24(5):358-60.
