盐胁迫对香菇草克隆生长及其钠、钾离子平衡的影响
2014-05-17闫道良朱祥龙杨巧玲岳春雷
闫道良,朱祥龙,杨巧玲,岳春雷
(1. 浙江农林大学林业与生物技术学院,浙江 临安 311300;2. 江西省崇义县思顺林业管理站,江西 崇义 341305;3. 浙江省林业科学研究院,浙江 杭州 310023)
盐胁迫对香菇草克隆生长及其钠、钾离子平衡的影响
闫道良1,朱祥龙2,杨巧玲1,岳春雷3
(1. 浙江农林大学林业与生物技术学院,浙江 临安 311300;2. 江西省崇义县思顺林业管理站,江西 崇义 341305;3. 浙江省林业科学研究院,浙江 杭州 310023)
选取长势一致的香菇草(Hydrocotyle vulgaris)为实验材料,在人工气候箱内,研究了盐胁迫下香菇草克隆生长及体内Na+、K+积累的特性,结果表明,当NaCl浓度 > 3.0 g/L时,香菇草的生长显著受到抑制,在NaCl浓度为5.0 g/L时,香菇草各生长指标降低的百分率分别为花序数(87.06%)> 花序生物量(82.61%)> 叶生物量(59.26%)> 整株生物量(58.60%)> 叶片数(58.27%)> 根生物量(58.33%) > 匍匐茎生物量(51.22%)> 节间数(27.10%);在盐度为1.0 ~ 5.0 g/L,除了叶比重有显著波动以外,茎重比、根重比和花重比并没有明显变化,表明香菇草可以通过内在调节机制适应盐度的变化;根、茎和叶中的Na+、K+随着盐度的增加,分别表现上升和下降趋势,相关分析表明,根、茎和叶中的Na+、K+间分别呈现极显著负相关。
NaCl胁迫;Na+、K+;生长;香菇草
盐渍化的湿地环境是退化生态系统生物恢复研究中的一个重要问题。就我国目前沿海地区而言,由于海水入侵以及不合理的土地灌溉,滨海盐土是海岸带主要的土壤类型之一,盐渍化土壤具有地下水埋藏浅、含盐量高等特点[1],对这些盐渍土地选择适宜的植物绿化改造与我国社会经济的可持续发展密切相关。
植物的耐盐性与其本身的离子代谢,特别是Na+、K+及Cl-代谢密切相关[2]。Na+是造成植物盐害及产生盐渍生境的主要离子,K+是植物生长发育所必需的大量元素和重要的渗透调节组分,Na+对K+吸收呈现出明显的竞争性抑制作用。因此,盐渍化土壤上的植物往往受到Na+毒害和K+亏缺的双重伤害。植物生长是植物对盐胁迫反应的综合体现及对盐胁迫的综合适应,也是植物耐盐性的最优评价指标[3]。因此,盐胁迫下植物的生长与体内离子代谢,特别是Na+和K+代谢,是抗盐生理研究的主要问题之一[4]。
香菇草(Hydrocotyle vulgaris),为伞形科天胡荽属多年生草本植物,由于其良好的观赏特性,较强的适应性和较快的繁殖速度而受到园林工作者的偏好,成为我国湿地造景、生态系统净化与修复中应用频度较高的植物材料[5~7]。然而,香菇草在盐胁迫环境下的生长及其体内Na+、K+代谢在国内还未见报导。本文以香菇草为实验材料,研究了盐胁迫对香菇草生长和Na+、K+积累的影响,以期为香菇草用于滩涂湿地生态修复及景观绿化提供参考。
1 材料与方法
1.1 材料
剪取长势一致、带有1枚叶片的节的香菇草,栽种在蓝色长方形塑料盒内(规格为35 cm×23 cm×12 cm),盒内装有7 cm厚的河沙。实验设置4个处理,每处理NaCl溶液用1/2霍格兰特营养液配制,NaCl浓度分别为0、1.0、3.0、和5.0 g/L,每处理液添加量以水平面在基质表面以下1 cm左右为准,每隔4 d更换一次处理液。每处理3个重复,每盒栽植10株香菇草,计每处理30株。全部实验材料置于全光照人工气候培养箱内,箱内白天/晚上温度为(25±1)/(22±1)℃,光照时间为每天14 h,相对湿度为60% ~ 70%。处理3个月后,收获分析。
1.2 相关指标测定分析
实验处理结束后,计数张开成熟的叶片、节间、花序的数量,洗净分离植株各构件后,于80℃下烘干至恒质量后称重作为各构件的生物量,并计算各构件的生物量与总生物的比值,即叶重比、茎重比、根重比和花重比。用FP6400A火焰光度计(上海傲普分析仪器有限公司)测定植株根系、茎和叶片Na+和K+含量(mg/g干重)。利用SPSS 13.0对数据进行统计分析,处理间差异显著性(P < 0.05)采用Duncan多重比较,所得数据均是以盒,即每一重复为统计单位。
2 结果与分析
2.1 盐处理对香菇草克隆生长的影响
低浓度盐处理(NaCl浓度 < 1.0 g/L)没有明显影响香菇草叶片数和花序数,当NaCl浓度高于3.0 g/L时,叶片数和花序数显著下降,如5.0 g/L处理下,叶片数和花序数分别是对照的41.73%和12.94%。低浓度盐处理有刺激节间数增加的趋势,节间数在1.0 g/L NaCl处理下最高,为112.33,随着盐浓度的增加,节间数显著下降,5.0 g/L NaCl处理下的节间数是对照的72.90%。

表1 NaCl处理对香菇草克隆生长及生物量积累的影响
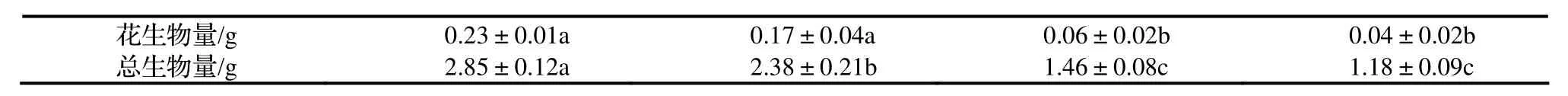
花生物量/g 0.23±0.01a 0.17±0.04a 0.06±0.02b 0.04±0.02b总生物量/g 2.85±0.12a 2.38±0.21b 1.46±0.08c 1.18±0.09c
低浓度盐处理,没有对根、匍匐茎和花生物量产生明显影响,但是叶生物量明显表现下降,由此引起总生物量也表现显著降低。随着盐浓度的增加(1.0 ~ 3.0 g/L)除叶生物量没有显著变化以外,根、匍匐茎、花和总生物量均表现显著下降。3.0 ~ 5.0 g/L处理,则显著降低了叶、匍匐茎的生物量,对根、花和总生物量影响并不明显。当盐浓度增加到5.0 g/L,各构件生物量降低百分率顺序分别为花序(82.61%) > 叶(59.26%)> 全株(58.60%)> 根(58.33%)> 匍匐茎(51.22%)。
2.2 盐处理对生物量分配的影响
对盐处理下香菇草各构件生物量分配分析表明(表2),盐处理没有明显影响根重比。在1 ~ 3 g/L处理下,叶重比随着盐浓度的增加而显著升高,茎重比则在0 ~ 1 g/L处理下,随着盐浓度的增加而增大。与对照相比,5 g/L处理下的花重比显著降低,花重比此时最小,平均为0.03。

表2 盐处理下香菇草的生物量分配
2.3 盐处理对植株K+、Na+离子积累的影响
随着盐浓度的增加,Na+含量在香菇草各组织内的积累也显著上升(P < 0.05)。在根、匍匐茎和叶中,Na+上升的幅度表现不同的变化。叶中Na+含量变化最为明显,如在正常生长下,叶中Na+含量平均为6.04 mg/g,在5 g/L NaCl处理下,则为46.64 mg/g,是对照的7.72倍。匍匐茎中Na+的积累,表现较为缓慢,如在对照下,Na+含量为5.03 mg/g,5 g/L NaCl处理下则为21.88 mg/g,是对照的4.35倍。对于K+而言,随着盐浓度的增加,叶和根中K+含量显著下降(P < 0.05)。如对照下叶和根中的K+含量分别是5 g/L NaCl处理下的1.83倍和2.09倍。和对照相比,茎中K+含量在1 g/L NaCl处理下显著下降,是对照的68.26%,但随着盐浓度的继续增加,K+含量没有表现明显差异(P > 0.05)。各组织中的K+/Na+在盐浓度为0 ~ 3 g/L NaCl处理下,显著下降(P < 0.05),在3 ~ 5 g/L NaCl处理下表现并不明显。
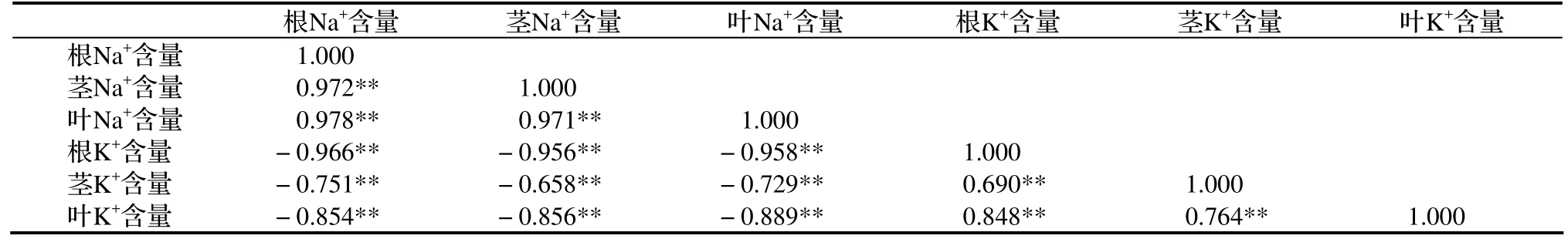
表3 香菇草植株Na+、K+离子含量间的相关分析
为进一步说明Na+、K+在香菇草功能器官中的分配关系,相关分析表明,根、茎、叶中的Na+含量间极显著正相关,却与根、茎、叶中的K+含量间极显著负相关。同样,根、茎、叶中的K+含量间也表现极显著正相关(P < 0.01)(表3),表明香菇草对K+、Na+的选择性吸收具有明显的相互抑制特性。
3 结论与讨论
盐胁迫会引起植物生理代谢紊乱,致使生长受到明显抑制,抑制程度取决于胁迫的强度和植物在不同时期的耐盐能力[8]。香菇草具有一定的耐盐性,在含盐量低于1.0 g/L时,并没有明显抑制其光合叶片数、节间伸展和花序数,表明香菇草可以正常生长在含盐量为1.0 g/L的土壤中。当盐浓度达到3.0 g/L时,植株的生长和生物量积累明显受到抑制,和对照相比,盐胁迫对香菇草生长及生物量积累抑制而导致各指标下降幅度依次是:花生物量(73.91%)> 花序数(66.67%)> 根生物量(62.50%)> 总生物量(48.77%)> 叶生物量(42.59%)>茎生物量(36.59%)> 叶片数(33.45%)> 节间数(11.84%)。
植物在逆境环境下,具有生物量分配模式可塑性的适应对策[9~10]。近年来,国内外学者对荒漠旱生、盐生植物开展了有关生物量分配方面的大量研究[11~13]。在盐胁迫下,盐生植物通过调节地上与地下部分的生物量分配,使之适应不同盐度的胁迫。在本研究中,不同盐分处理组中,虽然盐分胁迫显著地影响植物各部分生物量累积,但香菇草的根重比并未出现显著性变化,同样,与对照相比,在盐度为3 ~ 5 g/L处理下,叶重比、茎重比也没有呈现明显变化,表明在盐分不断变化的生境下,香菇草并没有基于最优分配理论和模型的预测[14~15],调节地上与地下营养器官部分生物量的分配,但3 ~ 5 g/L NaCl处理却显著降低了花重比,表明盐胁迫会显著抑制香菇草的有性生殖。我们的研究只是研究了香菇草一个生长时期后(进入生殖期)的生物量分配特征,对于不同生长时期,即香菇草的整个生活史过程,如营养生长期和生殖生长期各自的生物量分配是否遵循生物量分配的最优分配理论,有待进一步研究。
香菇草在盐胁迫下,Na+随着盐度的增加显著增加,K+则显著下降,由此,根、茎和叶中的K+/Na+也表现显著下降。相关分析得出,K+、Na+含量表现极显著负相关,说明Na+吸收,通过抑制香菇草生长代谢大量需要的K+的积累,从而影响其生长和生物量积累,这可能是随着叶内Na+的增加,破坏了光合色素的合成,抑制了光合作用碳物质积累。
[1] 周斌,丁丽霞. 浙江海涂土壤资源利用动态监测系统的研制与应用[M]. 北京:中国农业出版社,2008.
[2] Greenway H, Munns R. Mechanisms of Salt Tolerance in Nonhalophytes[J]. Annu Rev Plant Physiol, 1980(31):149-190.
[3] Levvit J. Responses of plants to environmental stresses. Volume II. Water, radiation, salt, and other stresses[M]. New York: Academic Press, 1980.
[4] Flowers T J. Improving crop salt tolerance[J]. J Experimental Botany, 2004, 55(396):307-319.
[5] 金树权,周金波,朱晓丽,等. 10种水生植物的氮磷吸收和水质净化能力比较研究[J]. 农业环境科学学报,2010,29(8):1571-1575.
[6] 方焰星,何池全,梁霞,等. 水生植物对污染水体氮磷的净化效果研究[J]. 水生态学杂志,2010,3(6):36-40.
[7] 周金波,金树权,姚永如,等. 冬季低温条件下6种水生植物水质氮、磷净化能力比较[J]. 浙江农业学报,2011,23(2):369-372.
[8] Munns R. Comparative physiology of salt and water stress[J]. Plant Cell Environ, 2002(25):239-250.
[9] Hibert D W. Optimization of plant root: shoot ratios and internal nitrogen concentration[J]. Ann Bot, 1990(66):91-99.
[10] Dewar R C. A root-shoot partitioning model based on carbon-nitrogen-water interactions and Munch phloem flow[J]. Funct Ecol, 1993(7):356-368.
[11]马淼,李博,陈家宽. 植物对荒漠生境的趋同适应[J]. 生态学报,2006,26(11):3 861-3 869.
[12] Xu H, Li Y. Water-use strategy of three central Asian desert shrubs and their responses to rain pulse events[J]. Plant and Soil, 2006, 285(1~2):5-17.
[13] 孙黎,刘士辉,师向东,等. 10种藜科盐生植物的抗盐生理生化特征[J]. 干旱区研究,2006,23(2):309-313.
[14] Chapin F S, Bloom A J, Field C B, et al. Plant responses to multiple environmental factors[J]. BioScience, 1987(37):49-57.
[15] Osone Y, Tateno M. Applicability and limitations of optimal biomass allocation models: a test of two species from fertile and infertile habitats[J]. Ann Bot, 2005(95):1 211-1 220.
Effect of Salt Stress on the Clonal Growth and Accumulation of Na+, K+in Hydrocotyle vulgaris
YAN Dao-liang1,ZHU Xiang-long2,YANG Qiao-ling1
(1. School of Forestry & Biotechnology,Zhejiang A & F University,Lin’an 311300,China; 2. Sishun Foretry Station, Chongyi 341305, China)
This article studied the clone growth of Hydrocotyle vulgaris and the characteristics of the vivo accumulation of Na+, K+under salt stress in the artificial climate box, selecting the H. vulgaris with the same growth condition as experimental materials. The research results showed that when the concentration of NaCl was more than 3.0 g/L, the growth of H. vulgaris was significantly suppressed. When concentration of NaCl was up to 5.0 g/L, the reduce percentage of H. vulgaris growth index respectively was such as number of inflorescence (87.06%) > inflorescence biomass (82.61%) > leaf biomass (59.26%) >whole biomass (58.60%) > number of leaf (58.27%) > root biomass (58.33%) > stolon biomass (51.22%) > number of stolon internode (27.10%). When the salinity was within the scope of 1.0 ~ 5.0 g/L, besides the significant volatility of leaf weight ratio , stem weight ratio, root weight ratio and flower weight ratio were no obvious change, which showed that the H. vulgaris can adapt to the changes in salinity through internal adjustment mechanism. The concentration of Na+, K+in root, stem and leaf was respectively rising and falling with the increase of salinity. Correlation analysis indicated that the concentration of Na+, K+in root, stem and leaf was significantly negative correlation.
NaCl stress; Na+、K+; growth; Hydrocotyle vulgaris
S718.43
A
1001-3776(2014)02-0001-04
2013-05-15;
2013-12-30
浙江省科技厅重点创新团队项目“城市湿地生态修复与资源利用”(2010R50039);台州市科技计划项目“台州市滨海盐碱地绿化植物筛选与种植示范”
闫道良(1975-),男,安徽宿州人,讲师,博士,从事植物资源、耐盐植物选育及其耐盐机制研究。
