MAPK通路在瑞芬太尼预处理减轻心衰大鼠离体心脏缺血/再灌注损伤中的作用
2014-05-17金世云何淑芳朱海娟张书杰
金世云,何淑芳,吴 昊,朱海娟,张书杰,张 野
(安徽医科大学第二附属医院1.麻醉科、2.超声科,安徽 合肥 230601)
慢性心力衰竭是各种心脏疾病发展的终末阶段,这类患者在行心血管手术时更易发生心脏的缺血/再灌注损伤(ischemia/reperfusion injury,IRI),可能导致术后并发症和死亡率增加[1]。因此,寻找一种有效减轻心力衰竭心肌缺血/再灌注损伤的心肌保护策略,在临床上具有重要的理论和实际意义。缺血预处理(ischemic preconditioning,IPC)是迄今为止最强的内源性心肌保护方法,但近年研究表明,在高血糖、高血脂、心肌梗死等病理状态下,心肌对IPC的敏感性减弱或消失[2]。本课题组近期研究发现,IPC对心力衰竭心脏的保护作用明显减弱,但阿片类药物如吗啡、瑞芬太尼预处理仍能发挥心肌保护作用[3-4],其机制尚待进一步探讨。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路,主要包括细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun NH2-terminal protein kinase,JNK)、p38激酶3个亚族,在阿片类药物介导正常大鼠的心肌保护中发挥重要作用[5]。本研究拟利用阿霉素长期注射诱导的大鼠慢性心力衰竭模型,探讨MAPK信号通路在瑞芬太尼预处理(remifentanil preconditioning,RPC)减轻心力衰竭大鼠离体心脏缺血/再灌注损伤中的作用,将为阿片预处理用于临床预防心力衰竭心脏缺血/再灌注损伤提供理论依据。
1 材料与方法
1.1 主要药品、试剂与仪器 盐酸阿霉素(批号:2QL0061,Prizer公司,意大利),盐酸瑞芬太尼(批号:6130311,宜昌人福药业有限责任公司),伊文斯兰(批号:20110909024,北京绿生源有限公司),氯化三苯基四氮唑(TTC,批号:129K1867V,Sigma公司,美国),乳酸脱氢酶(LDH)检测试剂盒(南京建成生物工程研究所),ERK抑制剂PD98059、p38抑制剂SB203580、JNK抑制剂SP600125(均购自 Cell Signaling公司),Power Lab数据采集系统(AD公司,澳大利亚),Langendorff灌注系统(安徽淮北正华有限责任公司),Vivid 7.0彩色超声仪(GE公司,美国)。
1.2 动物模型制备与分组处理 健康♂SD大鼠,由安徽医科大学动物实验中心提供,动物合格证号:SCXK(皖)2005-001,体质量 200~230 g,参照文献[6]介绍的方法制备慢性心力衰竭模型,于第8周末通过Vivid 7.0彩色超声仪评价大鼠心功能。将模型制备成功的慢性心力衰竭大鼠,通过随机数字表分为9组(n=6):假手术组(sham)、缺血/再灌注组(IR)、瑞芬太尼预处理组(RPC)、ERK抑制剂PD98059+RPC组(RPD)、p38抑制剂 SB203580+RPC组(RSB)、JNK抑制剂 SP600125+RPC组(RSP)以及抑制剂对照组(PD、SB和SP)。大鼠断头,取出心脏放在预先准备的4℃K-H液中,立即悬挂于Langendorff灌注架,逆行恒压灌注,灌注液为K-H 液 (118.5 NaCl,4.7 KCl,1.2 MgSO4,1.2 KH2PO4,2.5 CaCl2,25.0 NaHCO3,11.0 Glucose,单位为 mmol·L-1)。用体积分数为95%的O2与5%的CO2的混合气进行平衡,维持灌注液的pH值在7.4左右,温度稳定于37℃。用6-0丝线在肺动脉圆锥与左心耳之间缝扎左前降支起始部位,左心耳处剪一小口,将乳胶水囊自该小口置入左心室内,连接Power Lab系统,调节水囊内的容积,维持左心室舒张末压在0~1.33 kPa之间。实验中,通过收紧线结,实现左前降支支配区域心肌缺血与再灌注,缺血时表现为:缺血区域发绀、冠脉流量下降及LVDP减小。全部操作完成后,心脏稳定15 min,有明显心律失常以及LVDP<12 kPa的心脏弃之不用。Sham组仅缝线不结扎,持续灌注。IR组在平衡后,给予结扎左前降支30 min,松开线结后再灌注120 min。RPC组在平衡后,行5 min瑞芬太尼预处理(50μg·L-1),间隔 5 min,共 3个循环,然后缺血 30min,再灌注 120 min。RPD、RSB、RSP组在RPC预处理前10 min分别给予溶有ERK抑制剂PD98059(10μmol·L-1)、p38抑制剂 SB203580(5 μmol·L-1)或 JNK抑制剂 SP600125(5μmol·L-1)的K-H液灌流,直至缺血开始后5 min,共45 min。抑制剂对照PD组、SB组及SP组在IR前仅给予各抑制剂,不进行瑞芬太尼预处理。
1.3 LDH检测 所有组收取平衡15 min后(baseline)、再灌注后5 min(P5)及10 min(P10)的冠脉流出液,化学比色法检测LDH活性。
1.4 心肌梗死面积检测 再灌注末,取下大鼠心脏,吸干表面水份,称量,记录心脏湿重。取下大鼠心脏后,再次结扎左前降支,用0.25%的伊文斯兰通过主动脉逆行灌注对心脏进行染色,非缺血区心肌蓝染,缺血区无蓝染,放于-80℃冰箱20 min左右,行冰冻切片,沿心脏纵轴线切5~6片,每片为2 mm。切片在1%TTC溶液中,37℃中孵育10~15 min,随后再用10%中性福尔马林液固定过夜,梗死区(IS)呈白色,缺血危险区(AAR)呈砖红色。通过Imaging J 1.38e图像分析软件计算左心室与右心室总体积(LV+RV)、AAR体积,IS体积及 IS/AAR的比值。
1.5 心功能指标检测 通过Power Lab系统分别记录各组平衡 15 min(baseline)、预处理结束后(treatment)、缺血 30 min末(ischemia)、再灌注 60 min(P60)及再灌注120 min(P120)时心率(HR)、左心室发展压(LVDP)、左心室压力最大上升速率(+d p/d tmax)、左心室压力下降最大速率(-d p/d tmax)及冠脉流出液(CF)5种血流动力学指标。
1.6 统计学分析 采用SPSS 10.0统计软件进行分析,计量资料以¯x±s表示,组间比较采用单因素方差分析,两两比较采用q检验,重复测量资料采用重复测量设计的方差分析。
2 结果
2.1 冠脉流出液中LDH活性 再灌注5 min和10 min时,与sham组LDH活性相比(5 min:77±10,10 min:76±11),IR组 LDH活性明显升高(5 min:278±31,10 min:203±32;P<0.01)。而 RPC可以明显降低再灌注5 min和10 min的LDH活性(5 min:203±33,P<0.01;10 min:162±16,P<0.05)。再灌注5 min时,JNK抑制剂SP600125可明显阻断RPC降低LDH活性的作用(265±32,P<0.01);ERK抑制剂PD98059也有部分阻断作用(238±24,P<0.05);而p38抑制剂SB203580有升高LDH活性的趋势,但与RPC相比,差异无统计学意义。PD、SB、SP组在再灌注5 min和10 min时的LDH活性与sham组相比,差异有显著性,而与IR组相比差异无统计学意义。各组基础LDH活性差异无统计学意义(单位:IU·L-1)。见 Fig 1。
2.2 心肌梗死面积 与sham组(0.08±0.03)相比,IR组的 IS/AAR明显增加至(0.50±0.10),P<0.01;RPC则可以明显减轻IR损伤,IS/AAR降低到(0.23±0.08),P<0.01,这提示 RPC可以发挥心肌保护作用。与RPC相比,RSP和RPD的IS/AAR明显增加(RPD:0.36±0.09,P<0.05;RSP:0.48±0.12,P<0.01),而 RSB的无明显增加(0.30±0.04,P<0.01),这提示 JNK信号通路抑制剂和ERK通路抑制剂可以完全或部分阻断RPC的心肌保护作用。PD、SB、SP组IS/AAR与sham组相比,差异有统计学意义,而与IR组相比差异无统计学意义。各组在心重、LV+RV及AAR上差异无统计学意义。见Fig 2。

Fig 1 LDH activity in coronary effluent in each group(±s,n=6)1:Sham;2:IR;3:RPC;4:RPD;5:RSB;6:RSP;7:PD;8:SB;9:SP.The LDH activity was detected at baseline,5 min and 10 min after reperfusion(P5 and P10),respectively.*P<0.05,**P<0.01 vs IR group;ΔP<0.05,ΔΔP<0.01 vs RPC group;##P<0.01 vs sham group.

Fig 2 Infarct size determined by TTC staining in each groupA:Infarct size expressed as a percentage of the area at risk in groups subjected to RPC in the absence or presence of MPAK inhibitors;1:Sham;2:IR;3:RPC;4:RPD;5:RSB;6:RSP;7:PD;8:SB;9:SP.*P<0.05,**P<0.01 vs IR group;ΔP<0.05,ΔΔP<0.01 vs RPCgroup;##P<0.01 vs sham group.B:Representative images of AAR showing viable tissue(red)and infarcted tissue(white)for experimental groups.
2.3 血流动力学变化 I/R组在缺血30 min末、再灌注60 min及120 min 3个时间点上,LVDP、HR、+d p/d tmax、-d p/d tmax4个指标与 sham组相比,差异有统计学意义,说明缺血/再灌注损伤导致心脏功能的下降。除sham组外,其余各组间血流动力学差异无显著性,这提示瑞芬太尼预处理对离体心脏功能没有明显改善作用。见Tab 1。
3 讨论
瑞芬太尼是临床麻醉中常用的新型阿片类镇痛药,主要是μ-阿片受体激动剂,同时,对δ、κ受体也有一定激动作用。我们前期研究表明,瑞芬太尼预处理不仅可以抗正常大鼠心脏缺血/再灌注损伤,还可以明显减轻慢性心力衰竭大鼠的心肌缺血后损伤[3,7]。本实验根据前期研究方法成功建立慢性心力衰竭和离体心脏缺血/再灌注损伤模型[3,6],并选择浓度为50μg·L-1的瑞芬太尼进行预处理,结果显示,RPC明显缩小缺血后心肌梗死面积,并降低再灌注5 min和10 min时的LDH活性,证实RPC可以减轻心肌IR损伤,对心力衰竭大鼠心脏产生保护作用。
阿片类药物预处理主要是通过激活心脏上的阿片受体,继而活化下游的多种蛋白激酶,包括蛋白激酶 C(PKC)、PI3K/Akt(磷脂酰肌醇-3-激酶/蛋白激酶)、MAPK等,经过蛋白磷酸化作用激活线粒体KATP通道,从而对心肌产生保护作用。本研究利用3种MAPK信号通路抑制剂,进一步探讨MAPK信号通路在RPC介导心衰大鼠心肌保护中的作用。在RPC开始前10 min应用JNK通路抑制剂SP600125、ERK通路抑制剂PD98059或p38通路抑制剂 SB203580,结果 SP600125几乎完全阻断了RPC的心肌保护作用,PD98059有部分阻断作用,而SB203580对RPC心肌保护作用无明显影响,提示RPC介导心力衰竭大鼠的心肌保护作用与预处理阶段JNK和ERK信号通路的活化有关。
既往研究表明,心肌缺血/再灌注或预处理过程均可能导致MAPK信号通路活化,其中,ERK通路活化大多被认为对心脏起保护作用,其活化可以依赖或不依赖于 PI3K/Akt信号通路[8-9]。然而,JNK和p38通路是否介导心脏保护作用仍存在争议,不同的研究认为这两条通路的活化可能产生心脏保护作用,也可能对心脏有害[10]。我们前期研究发现,RPC对正常大鼠在体心脏缺血/再灌注损伤的保护作用与 JNK和 p38通路活化有关[11-12]。然而,本研究中RPC发挥对心力衰竭大鼠的心肌保护作用,主要依赖JNK通路活化,其次是ERK通路,而与p38通路无明显关系。当心脏发生病理性改变时,某些蛋白激酶信号途径可能发生改变。Miki等[13]研究发现,梗死后心肌重构导致PI3K/Akt信号通路失活,而代偿性ERK通路激活有利于心肌保护。在糖尿病大鼠模型中,PI3K及ERK等信号通路改变,可能导致吗啡预处理的心肌保护作用消失[14]。Peart等[15]研究发现,在老年小鼠心脏中,阿片受体激动剂由于不能激活p38通路,导致其心肌保护作用消失。在心力衰竭情况下,ERK、JNK及p38信号通路活化状态发生异常改变[16],这可能导致RPC介导心力衰竭大鼠心肌保护中涉及的MAPK通路与正常情况下有所不同,但其具体机制尚需进一步阐明。
Tab 1 Hemodynamic parameters in each group(¯±s,n=6)
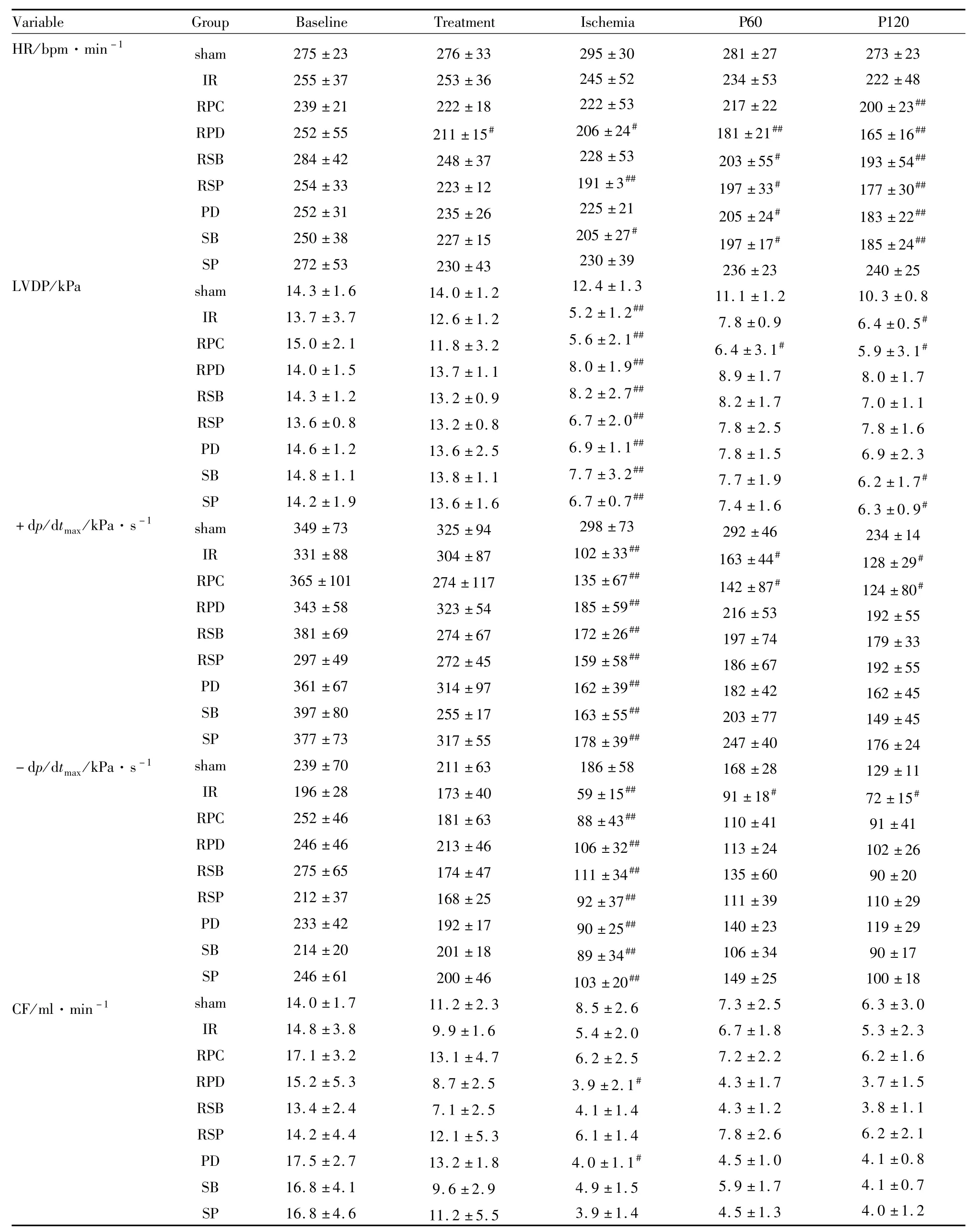
Tab 1 Hemodynamic parameters in each group(¯±s,n=6)
#P<0.05,##P<0.01 vs sham group
-d p/d t max/kPa·s-1 CF/ml·min-1 179±33 192±55 162±45 149±45 176±24 129±11 72±15#91±41 102±26 90±20 110±29 119±29 90±17 100±18 6.3±3.0 5.3±2.3 6.2±1.6 3.7±1.5 3.8±1.1 6.2±2.1 4.1±0.8 4.1±0.7 4.0±1.2 RSP PD SB SP sham IR RPC RPD RSB RSP PD SB SP sham IR RPC RPD RSB RSP PD SB SP 297±49 361±67 397±80 377±73 239±70 196±28 252±46 246±46 275±65 212±37 233±42 214±20 246±61 14.0±1.7 14.8±3.8 17.1±3.2 15.2±5.3 13.4±2.4 14.2±4.4 17.5±2.7 16.8±4.1 16.8±4.6 272±45 314±97 255±17 317±55 211±63 173±40 181±63 213±46 174±47 168±25 192±17 201±18 200±46 11.2±2.3 9.9±1.6 13.1±4.7 8.7±2.5 7.1±2.5 12.1±5.3 13.2±1.8 9.6±2.9 11.2±5.5 159±58##162±39##163±55##178±39##186±58 59±15##88±43##106±32##111±34##92±37##90±25##89±34##103±20##8.5±2.6 5.4±2.0 6.2±2.5 3.9±2.1#4.1±1.4 6.1±1.4 4.0±1.1#4.9±1.5 3.9±1.4 197±74 186±67 182±42 203±77 247±40 168±28 91±18#110±41 113±24 135±60 111±39 140±23 106±34 149±25 7.3±2.5 6.7±1.8 7.2±2.2 4.3±1.7 4.3±1.2 7.8±2.6 4.5±1.0 5.9±1.7 4.5±1.3
综上所述,JNK和ERK信号通路在瑞芬太尼预处理减轻心力衰竭大鼠离体心脏的缺血/再灌注损伤中发挥重要作用。
参考文献:
[1] Andersen A,Povlsen J A,Botker H E,et al.Right ventricular hypertrophy and failure abolish cardioprotection by ischaemic preconditioning[J].Eur J Heart Fail,2013,15(11):1208-14.
[2] Balakumar P,Singh H,Singh M,et al.The impairment of preconditioning-mediated cardioprotection in pathological conditions[J].Pharmacol Res,2009,60(1):18-23.
[3] 王 斌,张 野,朱海娟,等.瑞芬太尼预处理对心力衰竭大鼠心肌的保护作用[J].中国药理学通报,2012,28(7):956-60.
[3] Wang B,Zhang Y,Zhu H J,et al.Cardioprotective effect of remifentanil preconditioning on hearts in heart failure rat[J].Chin Pharmacol Bull,2012,28(7):956-60.
[4] 吴运香,张 野,姜 凡,等.吗啡预处理对慢性心力衰竭大鼠心肌缺血/再灌注损伤及心肌磷酸化细胞外信号调节激酶1/2表达的影响[J].中华麻醉学杂志,2011,31(7):854-7.
[4] Wu Y X,Zhang Y,Jiang F,et al.Effects of morphine preconditioning on myocardial ischemia-reperfusion injury and phosphorylated extracellular signal-regulated kinase 1/2 expression in rats with chronic heart failure[J].Chin J Anesthesiol,2011,31(7):854-7.
[5] Peart J N,Gross E R,Gross G J.Opioid-induced preconditioning:recent advances and future perspectives[J].Vascul Pharmacol,2005,42(5-6):211-8.
[6] 吴运香,张 野,谢春林,等.SD大鼠阿霉素慢性心力衰竭模型的建立与评价[J].中国药理学通报,2011,27(8):1170-3.
[6] Wu Y X,Zhang Y,Xie CL,et al.Establishment and evaluation of adrimycin-induced chronic heart failure model in SD rats[J].Chin Pharmacol Bull,2011,27(8):1170-3.
[7] Zhang Y,Irwin M G,Wong T M,et al.Remifentanil preconditioning confers cardioprotection via cardiacκ-andδ-opioid receptors[J].Anesthesiology,2005,102(2):371-8.
[8] Fryer R M,Pratt P F,Hsu A K,et al.Differential activation of extracellular signal regulated kinase isoforms in preconditioning and opioid-induced cardioprotection[J].J Pharmacol Exp Ther,2001.296(2):642-9.
[9] Hausenloy D J,Tsang A,Mocanu M M,et al.Ischemic preconditioning protects by activating prosurvival kinases at reperfusion[J].Am J Physiol Heart Circ Physiol,2005,288(2):H971-6.
[10]Hausenloy D J,Yellon D M.Survival kinases in ischemic preconditioning and postconditioning[J].Cardiovasc Res,2006,70(2):240-53.
[11]Zhang Y,Gu E W,Zhang J,et al.Role of p38 mitogen-activated protein kinases in cardioprotection of morphine preconditioning[J].Chin Med J(Engl),2007,120(9):777-81.
[12]张 野,顾尔伟,张 健,等.c-Jun氨基末端激酶在瑞芬太尼预处理减轻大鼠心肌缺血/再灌注损伤中的作用[J].中华麻醉学杂志,2007,27(12):1093-6.
[12]Zhang Y,Gu E W,Zhang J,et al.The role of JNK in protective effect of remi-fentanil preconditioning against myocardial ischemiareperfusion injury in rats[J].Chin JAnesthesiol,2007,27(12):1093-6.
[13]Miki T,Miura T,Tanno M,et al.Impairment of cardioprotective PI3K-Akt signaling by post-infarct ventricular remodeling is compensated by an ERK-mediated pathway[J].Basic Res Cardiol,2007,102(2):163-70.
[14]Gross E R,Hsu A K,Gross GJ.Diabetes abolishes morphine-induced cardioprotection via multiple pathways upstream of glycogen synthase kinase-3 beta[J].Diabetes,2007,56(1):127-36.
[15]Peart JN,Gross E R,Headrick JP,et al.Impaired p38 MAPK/HSP27 signaling underlies aging-related failure in opioid-mediated cardioprotection[J].JMol Cell Cardiol,2007,42(5):972-80.
[16]Flesch M,Margulies K B,Mochmann H C,et al.Differential regulation of mitogen-activated protein kinases in the failing human heart in response to mechanical unloading[J].Circulation,2001,104(19):2273-6.