二氢杨梅素对胰岛素抵抗3T3-L1脂肪细胞的改善作用及其机制研究
2014-05-17万星驿高丽辉冯国华
万星驿,高丽辉,冯国华,张 媛,刘 旭,李 玲
(1.昆明医科大学生物医学工程研究中心,云南昆明 650500;2.湖南省儿童医院,湖南长沙 410007)
胰岛素抵抗是机体对胰岛素的生物学效应降低的一种状态,即在胰岛素的刺激下细胞摄取利用葡萄糖的能力降低。脂肪组织作为胰岛素作用的外周靶组织之一,在胰岛素抵抗的发生发展中起着重要作用。脂肪细胞对葡萄糖的摄取依赖于细胞膜上分布的葡萄糖转运体4(glucose transporter 4,GLUT4),在胰岛素的刺激下能将细胞外的葡萄糖转运至细胞内,而胰岛素信号通路的转导异常将导致胰岛素抵抗。蛋白激酶 B(protein kinase B,PKB/Akt)是胰岛素信号通路的关键激酶,而脂联素(adiponectin)则是脂肪细胞分泌的激素,它们均与胰岛素抵抗相关。
二氢杨梅素(dihydromyricetin,DMY)化学结构为 3,5,7,3′,4′,5′-六羟基-2,3双氢黄酮醇,是一种重要的黄酮类化合物,广泛存在于杨梅科、葡萄科、杜鹃科、大戟科等植物中,具有抗氧化、抗菌消炎、抑制肿瘤、保护肝脏、抗高血压、调节血糖血脂[1]等药理作用。
据数据统计,天猫2017年11月11日当天成交额1682亿元、无线成交占比90%、全天支付总笔数达到14.8亿、全天物流订单达8.12亿、交易覆盖全球225个国家和地区……在这一系列疯狂的数据背后,毫无疑问,阿里巴巴推动下的“天猫双11”已经成为全球规模最大的购物狂欢节。从曾经网购兴起时的5200万到如今全球性的消费热潮,“双11”映照着社会运行机制的“晴雨表”,也标示着治理体系和治理能力现代化的水平。
前期研究表明,DMY能明显降低四氧嘧啶性糖尿病小鼠的血糖水平和改善糖耐量[2]。陈静等[3]研究也发现,DMY能改善D-半乳糖诱导的大鼠糖耐量异常状态,降低胰岛素抵抗。体外实验表明[4],DMY能增加高糖高胰岛素诱导的胰岛素抵抗L6肌管细胞的葡萄糖摄取量,改善其胰岛素抵抗状态。然而DMY对脂肪细胞胰岛素抵抗的影响和机制尚未见报道。因此,本研究拟采用地塞米松诱导3T3-L1脂肪细胞形成胰岛素抵抗,探讨DMY对脂肪细胞胰岛素抵抗的改善作用,并以Akt、GLUT4、脂联素为靶点初步探讨作用机制,为DMY的进一步研究和开发提供实验和理论依据。
O’Malley&Chamot(1990)将学习策略分为三类,一是是元认知策略、二是认知策略、三是社会/情感策略。
1 材料与方法
1.1 材料
1.1.1 细胞株 3T3-L1前脂肪细胞购于ATCC(A-merican Type Culture Collection)。
2.3 DMY对胰岛素抵抗3T3-L1脂肪细胞GLUT4、Akt2和脂联素基因表达的影响
1.1.2 试剂 DMY购自宁波德康生物制品有限公司,纯度>90% (HPLC)。H-DMEM和新生牛血清(NBCS)购自Gibco公司;胎牛血清(FBS)购自 Hyclone公司;3-异丁基-1-甲基黄嘌呤 (IBMX)、地塞米松、胰岛素均购自Sigma公司;罗格列酮购自北京高博医药化学技术开发有限公司;葡萄糖测定试剂盒购自上海荣盛生物技术有限公司;总RNA提取试剂盒购自天根公司;逆转录试剂盒和Taq DNA聚合酶均购自Thermo Fisher Scientific公司。
1.1.3 仪器 CO2培养箱(美国Thermo Fisher Scientific公司);百级层流超净台(珠海市再鑫仪器有限公司);倒置显微镜(日本Olympus公司);全波长酶标仪(美国Molecular Devices公司);PCR扩增仪(美国Bio-RAD公司)
结果显示,胰岛素刺激下,地塞米松模型组GLUT4的基因表达量较正常组明显下降(P<0.05);加入1×10-8mol·L-1的 DMY和 1×10-6mol·L-1的罗格列酮作用后,胰岛素抵抗脂肪细胞GLUT4基因的表达量较地塞米松组明显增加(P<0.01,Fig 3),提示DMY能促进脂肪细胞表达GLUT4基因。
1.2 方法
1.2.1 细胞培养与诱导分化 3T3-L1前脂肪细胞以1×107cells·L-1的密度接种于96孔板,用含10%NBCS的H-DMEM完全培养基培养,置于CO2培养箱内,待细胞生长融合至接触抑制后2天,参照文献[5]加入含 0.5 mmol·L-1IBMX、1μmol·L-1地塞米松、1 mg·L-1胰岛素和 1μmol·L-1罗格列酮的H-DMEM培养基 (含10%FBS)培养2 d,再换为含1 mg·L-1胰岛素的10%FBS H-DMEM培养基继续培养2 d,之后更换为10%FBS H-DMEM完全培养基培养,每2天换液1次,直至细胞完全分化成脂。
1.2.2 DMY对正常3T3-L1脂肪细胞葡萄糖摄取的影响 参照文献方法[6]取分化成脂的细胞设正常组、DMY 1×10-5、1×10-6、1×10-7、1×10-8mol·L-1浓度组和罗格列酮1×10-6mol·L-1组,作用48 h,采用葡萄糖氧化酶法测定各组细胞培养液中的葡萄糖含量,并计算出葡萄糖的消耗量。每组3复孔,重复3次以上。
在1 nmol·L-1的胰岛素刺激下,地塞米松模型组的葡萄糖消耗量较正常组减少18.4% (P<0.01),表明其对胰岛素的敏感性下降。DMY(1×10-6~1×10-8mol·L-1)浓度依赖性的增加胰岛素抵抗脂肪细胞的葡萄糖消耗量(Fig 2),与模型组相比,差异有统计学意义(P<0.05,0.01),与罗格列酮相比,差异无统计学意义,提示DMY能促进胰岛素的作用,改善脂肪细胞的胰岛素抵抗状态。
1.2.4 DMY对GLUT4、Akt2和脂联素基因表达影响 ①总RNA的提取和反转录反应:参照试剂盒说明书提取3T3-L1脂肪细胞的总RNA。定量后,依次 加入 Oligo(dT)18primer 1μl,RNase-Free ddH2O和RNA,置于 PCR扩增 仪中65℃反应5 min后取出,加入 5×Reaction Buffer 4μl,Ribolock RNase Inhibitor 1μl,10 mmol·L-1dNTP Mix 2μl,Revert Aid Reverse Transcriptase 1μl,充分混匀后,放入PCR扩增仪中,42℃反应60 min,70℃反应 5 min,反应产物于-20℃保存备用。② PCR反应:冰上操作,加入 Taq酶 10μl,引物 2μl,cDNA 2~4 μl,RNase-Free ddH2O加至20μl。充分混匀后放入PCR扩增仪。循环的条件为:94℃预变性5 min,94℃变性 30 s,57.4(GLUT4)/55.3℃(Akt2)/54.7℃(脂联素)退火 35 s,72℃延伸 45 s,32个循环72℃继续延伸10 min。扩增产物于4℃保存备用。③PCR扩增片段的凝胶电泳:先将扩增产物与6×loading buffer(含2.5%核酸染料)以5∶1混合均匀,取其中6μl加入质量分数为0.015的琼脂糖凝胶。GLUT4和Akt2扩增片段于80 mV恒定电压进行电泳60 min。脂联素扩增片段于80 mV恒定电压进行电泳65 min。电泳结果采用凝胶成像系统拍摄,通过 Quantity One软件进行定量分析。GLUT4上游引物:5′-GCTTTGTGGCCTTCTTTGAG-3′;下游引物:5′-CGGCAAATAGAAGGAAGACG-3′;Akt2上游引物:5′-TCGGCAAGGTCATTCTGGT-3′;下游引物:5′-GGCATACTCCATCACAAAGCA-3′;脂联素 上游引物:5′-GACGTTACTACAACTGAAGAGC-3′;下 游 引 物:5′-CATTCTTTTCCTGATACTGGTC-3′;内参为 GAPDH 上游引物:5′-CAAGGTCATCCATGACAACTTTG-3′;下游引物:5′-GTCCACCACCCTGTTGCTGTAG-3′。
海上丝绸之路是古代中国与世界其他区域进行文化交流和经济贸易的海上通道。海上的历史最早可追溯到西汉时期,以徐闻、合浦等港口为起点。宋元时期,中国的造船技术和航海技术有极大的提升,促进了海上丝路贸易的发展。广州是海上丝绸之路的重要港口,其独特的地理位置,往来贸易日益繁华,在此背景下广彩瓷器应运而生,成为“十八世纪欧洲的宠儿”。正因广彩是丝绸之路的产物,贸易互通对广彩的风格样式造成了巨大的影响,造就了广彩金碧辉煌的视觉效果和欢快明亮的洛可可装饰风格,成就了独特的广彩艺术。
1.2.5 统计学分析 数据采用¯x±s表示,采用SPSS 17.0软件进行单因素方差分析。
2 结果
2.1 DMY对正常3T3-L1脂肪细胞葡萄糖消耗量的影响 实验结果显示,正常3T3-L1脂肪细胞加入系列浓度的 DMY(1×10-5~1×10-8mol·L-1)作用48 h后,其葡萄糖消耗量与正常组相比,差异无统计学意义(Tab 1)。
Tab 1 Effect of DMY on glucose consumption in 3T3-L1 adipocytes±s,n=3)
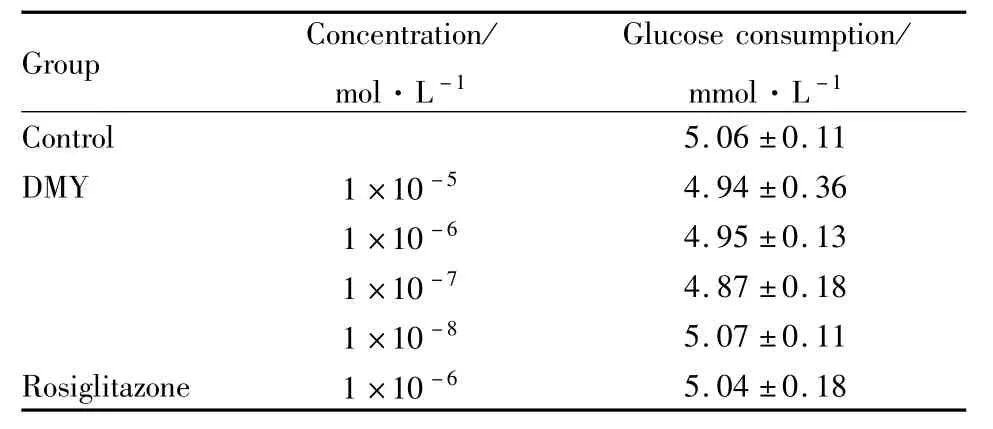
Tab 1 Effect of DMY on glucose consumption in 3T3-L1 adipocytes±s,n=3)
Group Concentration/mol·L-1 Glucose consumption/mmol·L-1 Control 5.06±0.11 DMY 1×10-5 4.94±0.36 1×10-6 4.95±0.13 1×10-7 4.87±0.18 1×10-8 5.07±0.11 Rosiglitazone 1×10-65.04±0.18
2.3.1 DMY对GLUT4基因表达的影响 RT-PCR
粘贴加固方法主要是在钢板与混凝土表面之间加垫款,再采用环氧树脂胶泥对周边进行有效的封闭,使混凝土与钢板形成封闭的空腔,同时对每片钢板最低点实施注胶,这在较大程度上有利于注胶内空气的排出。对钢板采用粘贴加固方法时,首先对混凝土松散层进行清理至平整为止,在此基础上对钢板粘接面采用工具清理干净,再用专业的工具在钢板中涂抹结构胶,最后将钢板粘贴到预定的位置,同时对其进行钻孔固定。
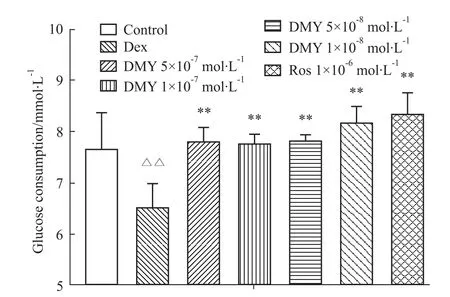
Fig 1 Effect of DMY on basal glucose consumption in insulin resistant 3T3-L1 adipocytes(±s,n=3)△△P<0.01 vs control group;**P<0.01 vs dexamethasone group.
1.2.3 3T3-L1细胞胰岛素抵抗模型的建立与药物处理 参照文献方法[6-8],取诱导分化的3T3-L1脂肪细胞分为正常对照组、地塞米松模型组、DMY系列浓度组(1×10-6~1×10-8mol·L-1)和阳性药物罗格列酮1×10-6mol·L-1组。正常对照组用10%FBSH-DMEM完全培养基培养7 d,其余各组给予1×10-6mol·L-1地塞米松培养7 d诱导形成胰岛素抵抗模型,地塞米松作用4 d后加入受试药物DMY和罗格列酮,加入胰岛素刺激或药物单独作用,72 h后采用葡萄糖氧化酶法测定各组细胞培养液中葡萄糖含量,并计算出葡萄糖的消耗量。每组3复孔,重复3次以上。此外,收集细胞提取RNA,冻存于 -80℃备测 GLUT4、Akt2和脂联素基因。

Fig 2 Effect of DMY on insulin-stimulated glucose consumption in insulin resistant 3T3-L1 adipocytes±s,n=3)△△P<0.01 vs control group;*P<0.05,**P<0.01 vs dexamethasone group
取5份100 g的藕片,放入300 g水中,加入硬化剂的浓度为1.1%,分别在20,30,40,50,60 ℃的条件下硬化2 h,根据感官评价选择合适的硬化温度。
2.2 DMY对地塞米松诱导3T3-L1脂肪细胞胰岛素抵抗的改善作用 在无胰岛素刺激的情况下,地塞米松模型组的葡萄糖消耗量较正常组明显减少(P<0.01),提示胰岛素抵抗模型复制成功。而加入 5×10-7~1×10-8mol·L-1DMY和阳性药物罗格列酮(1×10-6mol·L-1)作用72 h后,其葡萄糖消耗量较地塞米松模型组明显增加(P<0.01,Fig 1),提示DMY单独作用能改善脂肪细胞基础状态下的胰岛素抵抗状态。
实验使用的脑电数据集由德国波恩大学的癫痫研究实验室收集。该脑电数据集来自五名志愿者,包含两名健康人和三名癫痫病患者,对应的五个数据集分别标记为Z,O,N,F,S。其中,脑电数据的采集位置如表1[7]所示,每个数据集包含100个信道,脑电信号的采样频率、持续时间和采样点数分别为173.61Hz、23.6s和4097个。

Fig 3 Effect of DMY on GLUT4 mRNA expression in insulin resistant 3T3-L1 adipocytes(±s,n=3)△P<0.05 vs control group;**P<0.01 vs dexamethasone group.
2.3.2 DMY对Akt2基因表达的影响 RT-PCR结果显示,在胰岛素刺激下,地塞米松模型组Akt2基因的表达量较正常对照组明显下降(P<0.05),加入 DMY 1×10-8mol·L-1和1×10-6mol·L-1罗格列酮后,胰岛素抵抗脂肪细胞Akt2基因的表达量明显增加,与地塞米松模型组比较,差异有统计学意义(Fig 4),提示DMY能上调胰岛素抵抗脂肪细胞Akt2基因的表达。
2.3.3 DMY对脂联素基因表达的影响 实验结果表明,地塞米松作用后,在胰岛素刺激条件下,脂联素基因表达量较正常组明显下降(P<0.05)。1×10-7和1×10-8mol·L-1DMY组和 1×10-6mol·L-1罗格列酮组均能明显上调脂联素基因表达量(P<0.05),其中 DMY 1×10-8mol·L-1组的脂联素基因表达量与正常组相比P<0.05,与Dex组比较P<0.01(Fig 5),提示DMY能促进胰岛素抵抗脂肪细胞脂联素基因的表达。
除了试验示范的多个优质稻新品种,观摩现场还展示了多种智能化农机具——激光平地机作业精度达到正负两厘米,一小时可以作业2~3亩;旋耕、施肥、播种一体机,可以控制播种深度,实现种肥精确控制,节本效果明显;无人驾驶智能收割机,可以实现自主导航路径规划与作业,自动行驶、收割、脱粒、卸粮。

Fig 4 Effect of DMY on Akt2 mRNA expression in insulin resistant 3T3-L1 adipocytes(±s,n=3)△△P<0.01 vs control group;*P<0.05 vs dexamethasone group.

Fig 5 Effect of DMY on adiponectin mRNA expression in insulin resistant 3T3-L1 adipocytes¯x±s,n=3)△P<0.05 vs control group;*P<0.05,**P<0.01 vs dexamethasone group.
3 讨论
胰岛素抵抗是指肌肉、肝脏和脂肪细胞等靶器官对胰岛素的生理作用反应性下降或敏感性降低,其中脂肪组织在胰岛素抵抗的发生发展中起到关键作用,肥胖和脂肪性营养不良都可能引起胰岛素抵抗。本实验采用地塞米松诱导3T3-L1脂肪7 d后,在有或无胰岛素刺激下,地塞米松组的细胞葡萄糖消耗量均较正常组明显减少,提示胰岛素抵抗模型复制成功。加入 DMY(5×10-7~1×10-8mol·L-1)后,无论有或无胰岛素的刺激,DMY均能增加胰岛素抵抗3T3-L1脂肪细胞的葡萄糖消耗量,提示DMY可改善地塞米松诱导脂肪细胞形成的胰岛素抵抗状态。但DMY对正常3T3-L1脂肪细胞的葡萄糖摄取无明显影响。
葡萄糖是极性分子,需借助于葡萄糖转运蛋白才能进入细胞内,其中GLUT4介导了脂肪细胞对葡萄糖的转运[9]。基础状态下,GLUT4主要分布在细胞内的囊泡中,在胰岛素刺激下,GLUT4大量易位至细胞膜,将细胞外的葡萄糖摄取进入细胞内。GLUT4表达数量的减少或易位受阻皆有可能引起胰岛素抵抗。本研究发现地塞米松模型组的细胞GLUT4基因表达量较正常组明显下调,与文献报道一致[7,10-11],加入 DMY后脂肪细胞的 GLUT4表达量明显增加,提示DMY改善胰岛素抵抗的作用可能与上调GLUT4基因的表达量有关。
Akt是胰岛素信号转导通路的关键激酶,在PI3K的作用下被激活,活化的 Akt能直接刺激GLUT4易位到细胞膜上,从而转运葡萄糖[12]。抑制Akt的基因表达或者抑制其磷酸化均能明显抑制胰岛素依赖的 GLUT4易位,产生胰岛素抵抗。Akt主要有3种亚型,其中Akt 2分布于脂肪组织,与糖代谢密切相关[13],参与细胞内的胰岛素信号转导。本研究发现地塞米松使脂肪细胞Akt2的基因表达量明显下降,而DMY则能促进脂肪细胞表达Akt2,提示DMY改善胰岛素抵抗的机制与上调Akt2基因的表达有关。
脂联素是脂肪组织分泌产生的一种细胞因子,脂联素与其受体结合后,激活AMPK信号通路,进而发挥脂肪酸氧化、蛋白质分解、细胞保护作用和葡萄糖摄取等多种药理作用[14]。研究表明,脂联素和胰岛素抵抗呈负相关,脂联素基因敲除小鼠可出现胰岛素抵抗,而补充脂联素可以逆转胰岛素抵抗[15-17]。本研究表明地塞米松能下调脂联素基因的表达,与文献报道一致[18]。而加入DMY作用后能明显上调胰岛素抵抗3T3-L1脂肪细胞的脂联素基因表达量,提示促进脂联素基因的表达可能是DMY改善胰岛素抵抗的另一机制。
综上所述,DMY在有或无胰岛素刺激下均能增加地塞米松诱导的胰岛素抵抗3T3-L1脂肪细胞的葡萄糖消耗量,改善胰岛素抵抗状态,同时不影响正常脂肪细胞的糖摄取。DMY改善胰岛素抵抗的机制可能与上调胰岛素信号通路中的Akt2和GLUT4的基因表达,以及上调脂联素基因的表达有关,但是DMY是否能促进Akt2的磷酸化和GLUT4的易位还有待进一步的研究。
参考文献:
[1] 张友胜,宁正常,胡闫勇,等.黄酮类化合物二氢杨梅素的研究现状[J].中成药,2002,24(12):971-2.
[1] Zhang Y S,Ning Z C,Hu Y Y.Research on flavonol of dihydromyricetin[J].Chin Tradit Patent Med,2002,24(12):971-2.
[2] 卢 威,秦晓改,李 玲,等.二氢杨梅素对四氧嘧啶性糖尿病小鼠的降糖作用研究[J].中药药理与临床,2011,27(4):5-17.
[2] Lu W,Qin X G,Li L,et al.Protective effect of dihydromyricetin on alloxan induced diabetic mice[J].Pharmacol Clin Chin Mat Med,2011,27(4):5-17.
[3] 陈 静,郭丽娜,郑 成,等.二氢杨梅素对糖耐量异常大鼠氧化和非酶糖基化的影响 [J].吉林大学学报,2008,34(6):994-7.
[3] Chen J,Guo L N,Zheng C,et al.Influence of dihydromyricetin on oxidation and non-enzymatic glycosylation in impaired glucose tolerance rats[J].J Jilin Univ,2008,34(6):994-7.
[4] 李石飞,黄年旭,李 玲,等.滇产植物乌墨中胰岛素增敏活性成分[J].云南植物研究,2009,31(5):469-73.
[4] Li S F,Huang N X,Li L,et al.Effect of chemical constituents from syzygium cumini(Myrtaceae)on glucose uptake in insulin-resistant L6 cells[J].Acta Botanica Yunanica,2009,31(5):469-73.
[5] 陈思凡,肖新才,孙延双,等.白黎芦醇对小鼠3T3-L1细胞增殖与分化的影响及其机制[J].中国药理学通报,2010,26(1):108-11.
[5] Chen SF,Xiao X C,Sun Y S,et al.Effects of resveratrol on proliferation and differentiation of murine 3T3-L1 preadipocytes and the underlying mechanism[J].Chin Pharmacol Bull,2010,26(1):108-11.
[6] 左益檠,牛艳芬,李 玲,等.双(α-呋喃甲酸)氧钒对胰岛素抵抗3T3-L1脂肪细胞糖摄取的影响[J].中国药理学通报,2008,24(7):902-5.
[6] Zuo Y Q,Niu Y F,Li L,et al.Effects of bis(α2 furancarboxyla to)oxovanadium(IV)on the glucose uptake in norma l and insulin-resistan t 3T3-L1 adipocytes[J].Chin Pharmacol Bull,2008,24(7):902-5.
[7] 杨桂枝,高小平,晏菊芳,等.地塞米松和胰岛素诱导3T3-L1脂肪细胞胰岛素抵抗的分子机理研究[J].西南师范大学学报,2003,28(3):460-4.
[7] Yang GZ,Gao X P,Yan JF,et al.Molecular mechanism of dexamethasone and insulin induce insulin resistance in 3T3-L1 adipocyte[J].J Southwest China Normal Univ,2003,28(3):460-4.
[8] Anil Kumar K L,Marita A R.Troglitazone prevents and reverses dexamethasone induced insulin resistance on glycogen synthesis in 3T3 adipocyte[J].British J Parmacol,2000,130(2):351-8.
[9] Annette M,Shewan,Ellen M.GLUT4 recycles via a trans-golgi network(TGN)subdomain enriched in syntaxins6 and 16 but Not TGN38:Involvement of an acidic targeting motif[J].Mol Biol Cell,2003,14(3):973-86.
[10]Sakoda H,Ogihara T,Anai M,et al.Dexamethasone-induced insulin resistance in 3T3-L1 adipocytes is due to inhibition of glucose transport rather than insulin signal transduction[J].Diabetes,2000,49(10):1700-8.
[11]Montagut G,BladéC,Blay M,et al.Effects of a grapeseed procyanidin extract(GSPE)on insulin resistance[J].J Nutritional Biochemistry,2010,21(10):961-7.
[12]Tsatsoulis A,Mantzaris M D,Bellou S,et al.Insulin resistance:an adaptive mechanism becomes maladaptive in the current environment-an evolutionary perspective[J].Metabolism Clinical and Experimental,2013,62(5):622-33.
[13]Bouzakri K,Zachrisson A,Al-Khalili L,et al.siRNA-based gene silencing reveals specialized roles of IRS-1/Akt2 and IRS-2/Akt1 in glucose and lipid metabolismin human skeletal muscle[J].Cell Metablism,2006,4(6):89-96.
[14]Shehzad A,Iqbal W,Shehzad O,et al.Adiponectin:Regulation of its production and its role in human diseases[J].Hormones,2012,11(1):8-20.
[15]Kubota N.Disruption of adiponectin causes insulin resistance and neointimal formation[J].J Biol Chem,2002,277(29):25863-6.
[16]Trevaskis JL,Gawronska-Kozak B,Sutton GM,et al.Role of adiponectin and inflammation in insulin resistance of Mc3r and Mc4r knockout mice[J].Obesity(Silver Spring),2007,15(11):2664-72.
[17]Yamauchi T,Kamon J,Waki H,et al.The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity[J].Nat Med,2001,8(7):941-6.
[18]Fasshauer M,Klein J,Neumannke S,et al.Hormonal regulation of adiponectin gene expression in 3T3-L1 adipocytes[J].Biochem Biophys Res Commun,2002,290(3):1084-9.