克隆西农莎能奶山羊的微卫星DNA分析
2014-05-16李长雷马宝苗陈晓青易卉玲舒细记
李长雷,马宝苗,柳 威,陈晓青,易卉玲,舒细记*
(江汉大学 a.医学院;b.武汉生物医学研究院,湖北 武汉 430056)
0 引言
原产于瑞士的莎能奶山羊最早引进入我国大约是在20世纪初,后经原西北农学院(今西北农林科技大学)等地的几代科研工作者数十年的选种、培育与改良,逐渐形成了具有自身优良特性的新品种,于1985年被陕西省正式批准命名为西农莎能奶山羊。作为我国奶山羊最早的培育品种之一,由于其产奶量和生产规模高,且羊奶营养价值高,因此在全国范围内得以较大规模的选育及推广[1-2]。
在西农莎能奶山羊的育种过程中,符合要求的现代新技术被积极采用。动物克隆技术即是其中之一。此项技术产生后,有力促进了生命科学等领域的发展。对具有优良性状的动物进行克隆,可以扩大种畜优良基因,迅速提高种畜品质。但在克隆动物出生后,采用何种方法证明动物是由无性繁殖而来,是动物克隆研究中一个十分关键的问题。
关于亲子鉴定的方法很多,在体细胞克隆哺乳动物获得成功以后,人们常用微卫星DNA分析的方法对克隆动物进行鉴定。鉴定克隆羊“Dolly”的身份采用的就是微卫星DNA方法。目前,这一技术已成为证明克隆动物身份的权威方法之一[3-8]。笔者将此项技术用于克隆西农莎能奶山羊的鉴定,利用微卫星位点的多态性,即同一微卫星DNA引物在不同动物中都表现出多态性来进行亲子鉴定。
1 材料与方法
1.1 材料来源
克隆山羊个体(1号小羊,产自1号受体母羊,存活;2号小羊,产自2号受体母羊,死亡;下同);受体母羊(1号和2号);供体细胞(实验室转染、培养的的母山羊成纤维细胞);随机挑选两只普通母羊(对照组),山羊品种均系西农莎能奶山羊(见图1)。

图1 克隆山羊,受体山羊,对照组山羊和供体细胞山羊Fig.1 Cloned goat,recipient goat,goat of control group and donor goat
1.2 主要试剂及仪器
TIANamp Genomic DNA Kit(离心柱型,DP304,Germany);Zymo TaqTMPreMix(Zymo,China);Tris、甘氨酸、SDS和甲基丙烯基氧丙基三甲氧基硅烷(Sigma,Japan);Marker(Takara,Japan);GDS8000凝胶成像分析系统(UVP,USA);PTC-220 PCR 扩增仪(MJ,USA);WD-9405A 型脱色摇床(China);倒置相差显微镜和实体显微镜(OLTYMPUS,Japan)。
1.3 DNA的提取与检测
无菌条件下取1号小羊、1号受体羊,2号受体羊和两只对照组山羊血液各5 mL,加入抗凝剂;取2号小羊肝脏组织少许;供体细胞,至实验室供检测使用。按照TIANamp Genomic DNA Kit试剂盒的说明和要求,提取血液、组织和供体细胞中的基因组DNA。
1.4 PCR扩增反应的引物选择与合成
扩增微卫星 DNA序列采用郭泽坤等[9]鉴定体细胞克隆山羊时所筛选出来的5对具有显著多态性差异的引物,引物均由上海捷瑞生物工程有限公司合成,其信息见表1。
1.5 优化PCR反应条件
微卫星PCR反应总体系为50μL,其中Premix 25μL;上 、下 游 引 物 各 1μL;模 板 2μL;ddH2O 21μL。体系反应条件如下:95℃预变性5 min,95℃变性30 s,按各自的退火温度退火40 s,72℃ 延伸30 s重新转到94℃ 变性30 s至72℃延伸30 s,40个循环,最后72℃延伸7 min,产物4℃保存备用。
扩增目的基因DNA在PTC-220 PCR扩增仪中进行。电泳胶制备在BIO-RAD公司电泳槽内进行。
1.6 PCR产物的检测
扩增产物首先采用2%琼脂糖凝胶电泳进行检测,并以DG2000核酸分子量标准作对照,在紫外透射分析仪上观察是否有所需的条带。结果表明:有扩增产物,且扩增长度符合预期长度。

表1 引物信息Tab.1 Information of primer
1.7 聚丙烯酰胺凝胶电泳
取4μL PCR产物加入2μL上样缓冲液后进行6%聚丙烯酰胺凝胶电泳。用银染的方法进行固定、染色、显影后,凝胶放入GDS8000凝胶成像分析系统的暗箱中,用白光拍照成像。
1.8 统计分析
所得结果用GDS8000凝胶成像分析系统所附带的软件进行基因组分析。
2 结果
2.1 表型分析
1号克隆西农莎能奶山羊,雌性,毛色为纯种西农莎能奶山羊所体现的白色,小竖耳(见图1,下同);死亡的2号克隆西农莎能奶山羊,雌性,经自然晾晒后,毛色为白色,小竖耳。供体细胞来自雌性,表型为白色、小竖耳的西农莎能奶山羊母羊的组织培育而成。从表型分析,可以得知克隆羊与提供供体细胞的母山羊一致,可初步判断所获山羊为克隆个体。
2.2 PCR扩增结果分析
PCR扩增结果如图2,图3。1号和2号克隆山羊和供体细胞分别以不同引物扩增的DNA片段多态性完全相同,而与受体母羊和对照组母羊都存在明显差异,后两者相互之间也不一样。因此微卫星DNA多态性分析结果证实克隆山羊个体基因组DNA来源于培养的供体细胞。这一结果也表明,这5对引物PCR扩增的产物在同种不同个体山羊之间存在多态性差异。
3 讨论
在克隆动物研究中,对核移植的动物都需要通过遗传鉴定来确定是否来源于供体细胞[10]。最常用的遗传鉴定方法是RAPD(random amplification polymorphism DNA)和微卫星DNA分析技术。RAPD技术虽然能够产生较丰富的多态性,但是需要筛选大量的随机引物;微卫星DNA分析技术则主要针对种间和个体间变异较大的微卫星位点。
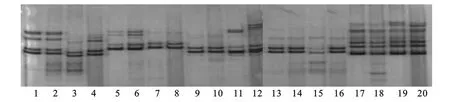
图2 1号小羊微卫星检测Fig.2 Goat number 1 SSRs detection

图3 2号小羊微卫星检测Fig.3 Goat number 2 SSRs detection
微卫星位点由微卫星本体和两侧的侧翼序列构成,其侧翼序列在相近的物种中具有一定的保守性,可用于生物基因组序列中特异性定位。微卫星本体的拷贝数在生物种间,甚至种内不同个体间高度变异而具有长度多态性[8]。微卫星序列又称简单序列重复、短串联重复序列或简单序列长度多态性,是一种高度重复序列,广泛分布于真核生物基因组中。其数量多、分布广、多态性丰富、个体专一性强,分析操作简便、快速,重复性、准确性和稳定性好,呈孟德尔式共显性遗传等优点,是一种比较成熟的分子标记技术[11-12]。近年来被广泛用于基因定位、构建基因图谱、群体遗传结构、遗传变异分析和亲子鉴定等方面[13-14]。该方法在山羊[8-9]、绵羊[15-16]、牛[17]、猪[18-19]和熊猫[20-21]等动物的克隆后代的亲子鉴定或物种系谱分析等诸多领域得到广泛应用,并快速向前发展。
本研究的主要目的是为了证明克隆西农莎能奶山羊的基因组DNA来自于传代培养的成纤维细胞,从而在DNA水平上证明其来自于体细胞克隆。表型特征和微卫星DNA分析的结果证实了实验设想,体细胞克隆西农莎能奶山羊获得成功。
(References)
[1]渊锡藩,曹斌云,罗军,等.西农莎能奶山羊的历史沿革与生产性能[J].畜牧兽医杂志,2007,26(2):47-48.
[2]颜泉梅,杨莎,朱广琴,等.西农莎能奶山羊和波尔山羊GDF9基因多态性与产羔数的相关分析[J].中国兽医学报,2010,30(10):1394-1397.
[3]FORBES S H,HOGG J T,BUCHANAN F C,et al.Microsatellite evolution in congeneric mammals:domestic and bighorn sheep[J].Mol Biol Evul,1995,12(6):1106-1113.
[4]ASHWORTH D,BISHOP M,CAMPBELL K,et al.DNA microsatellite analysis of Dolly[J].Nature ,1998,394(6691):323-329.
[5]SHIGA K,FUJITA T,HIROSE K,et al.Production of calves by transfer of nuclei from cultured somatic cells obtained from Japanese black bulls[J].Therigenlogy,1999,52(3):527-535.
[6]WELLS D N,M ISICA P M,TERVIT H R.Production of cloned calves following nuclear transfer with cultured adult mural granulose cells[J]Biol Reprod ,1999,60(4):996-1005.
[7]ZAKHARTCHENKO V,DURCOVA-HILLS G,STOJKOVIC M,et al.Effect of serum starvation and recloning on the efficiency of nuclear transfer using bovine fetal fibroblasts[J].J Reprod Fertil,1999,115(2):325-331.
[8]刘建,唐慧林,杨跃飞,等.克隆波尔山羊的微卫星DNA 鉴定[J].中国药科大学学报,2005,36(1):69-72.
[9]郭泽坤,郭继彤,安志兴,等.体细胞克隆山羊微卫星DNA 分析[J].生物化学与生物物理进展,2002,29(4):655-658.
[10]苏杰,孙伟,李云霞,等.克隆清原马鹿的微卫星鉴定[J].中国草食动物科学,2013,33(2):12-14.
[11]王正朝,庞训胜,潘晓燕,等.微卫星技术在体细胞克隆动物研究中的应用[J].家畜生态学报,2007,27(4):14-17.
[12]WANG Y G,ZOU X G,CHENG G X,et al.Cloned goats(Gapra hircus)from fetal fibroblast cell lines[J].Chin Sci Bull,1999 ,44(21):2319-2323.
[13]霍金龙,张娟,罗古月,等.微卫星PAGE银染法及其干胶的简易制备[J].动物医学进展,2005,26(1):78-80.
[14]张志峰,史洪才,武坚,等.微卫星DNA聚丙烯酰胺凝胶电泳(PAGE)银染法的改良[J].生物技术,2005,15(3):51-53.
[15]吕慎金,杨燕,候冠玉,等.运用微卫星标记对中国地方绵羊品种的遗传多样性分析[J].畜牧兽医学报,2008,39(7):858-865.
[16]BAUMUNG R,CUBRIC-CURIK V,SCHWEND K,et al.Genetic characterization and breed assignment in austrian sheep breeds using microsatellite marker information[J].Journal of Animal Breeding and Genetics,2006,123(4):265-271.
[17]李向阳,张国梁,胡成华,等.草原红牛微卫星标记的研究[J].吉林农业科学,2008,33(5):44-48.
[18]牟玉莲,冯书堂,刘立新,等.猪胚胎干细胞(EG)嵌合体鉴定研究[J].实验动物科学,2007,24(6):64-65.
[19]SHIM H,GUTIERREZ-ADAN A,CHEN LR,et al.Isolation of pluripotent stem cells from cultured porcine primordial germ cells[J].Biol Reprod,1997,57(5):1089-1095.
[20]王芳,彭真信,张金国,等.应用微卫星标记分析圈养大熊猫遗传多样性[J].生物化学与生物物理进展,2007,34(12):1279-1287.
[21]张志和,沈富军,孙姗,等.应用微卫星分型方法进行大熊猫父亲鉴定[J].遗传,2003,25(5):504-510.
