胃癌腹膜种植转移动物模型建立的研究进展
2014-05-16汤加宁程向东徐志远
汤加宁 程向东 徐志远
胃癌严重危害人类健康,在各类恶性肿瘤死因中排名第2位[1]。腹膜转移是胃癌进展过程中以及胃癌患者术后复发的常见现象,当发生腹腔种植后,其治疗效果往往不佳,5年生存率低于20%[2]。有研究者回顾性研究1172例胃癌RO切除术患者,胃癌腹膜转移的发生率为29%,且患者的中位生存时间只有6个月[3]。因此,迫切需要一个成熟、稳定、可靠、价廉的胃癌腹膜种植转移动物模型,这将有助于研究胃癌腹膜转移机制,检测各类抗胃癌药物疗效,进一步提高临床治疗策略,从而改善患者预后。有研究者曾采用Hp(幽门螺杆菌)感染小鼠,N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-Nitro-N-Nitrosoguanidine,MNNG)、硝酸、乙醇等化学致癌物质诱导Wister鼠等动物形成胃癌[4,5]。这些方法,原位胃癌成瘤时间长(要等10个月或者更久),腹膜成瘤率低,且对于实验人员有潜在Hp感染和化学致癌危险。还有研究者采用基因工程技术建立胃癌转基因小鼠如p53/CDH1(一种通过历时12个月的基因敲除技术形成于胃体的低分化腺癌小鼠模型)等[6]。此种方法虽能特异性的形成胃癌模型,但其成瘤时间长、代价巨大,不符合大批量的动物实验研究。这些年来,国内外主要采用细胞系建立胃癌腹膜种植转移动物模型,具有成瘤周期短、成瘤率高、可以根据不同实验目的建立针对性模型等特点,极大推动了胃癌腹膜转移的研究。
一、采用细胞系建立胃癌腹膜种植转移动物模型的方法
1.胃癌灶原位移植形成腹膜转移癌:目前最常用的宿主动物有:T细胞功能缺陷的BALB/c-nu/nu裸小鼠,T、B细胞功能联合免疫缺陷的SCID鼠,T、B、NK细胞联合免疫缺陷的BNX小鼠。一般选用6~8周龄的雄性鼠。上述实验动物具有不同程度免疫缺陷,为了降低宿主动物感染致死率,通常采用SPF级动物(specific pathogen-free animal)标准饲养。SPF级动物饲养于具有严格屏障体系的环境中,该环境对于实验员、动物饲料和空气的出入都有严格要求[7]。
所用胃癌灶原位移植瘤组织主要来源于胃癌细胞株(SGC-7901、MKN-45、AGS、NCI-N87、SNU-16、MGC-803等)经宿主动物皮下注射所形成的皮下瘤。待瘤体长到直径0.8~1.0cm时,剔除包膜等其他组织,选取新鲜鱼肉状瘤块,切成1mm3大小的小瘤块作为原位移植瘤源。然后将这些小瘤块移植于胃窦部近大弯侧浆膜处,在宿主动物生存期内将形成腹膜转移瘤。
将小瘤块移植于胃窦部有多种方法:如“悬挂法”、“胃囊法”、“OB胶粘贴法”、“纤维蛋白原-凝血酶法”[8~10]。(1)“悬挂法”:直接接将肿瘤以7-0的丝线缝挂于浆膜层,操作简便、快速,但有可能术后脱落,故较少运用。(2)“胃囊法”:指在浆膜处造一个2mm长的创口,将小瘤块置入浆膜层缺损处后采用荷包缝合,或是充分游离浆膜,在局部区域造成一小囊,而后将瘤块置于小囊中,再缝合囊袋,使瘤块整体被包埋于胃壁的浆膜层与黏膜层之间。(3)“OB胶黏贴法”:指用一次性注射针头轻度损伤胃大弯中部浆肌层,以出血为度,将肿瘤小块用医用OB胶黏合在损伤处。(4)“纤维蛋白原-凝血酶法”:用无菌空针头轻微划破胃窦浆肌层,置入3~4块小瘤块(1mm3大小),滴上约10滴凝血酶以覆盖瘤组织表面,待凝血酶与纤维蛋白原反应(约10s),使得小瘤块附着于胃上。
胃癌灶原位移植形成腹膜转移癌的建模方法,模拟了人体内胃癌的自然生长和腹膜转移过程。移植瘤组织保留了胃癌细胞与细胞外的微环境,其完整性避免了肿瘤的生物学行为遭到破坏。建立这种模型不仅再现了胃癌的侵袭转移过程,而且可以通过测定相关分子的表达,探究胃癌转移机制。胃癌灶原位移植的成功率都比较高。但是由于胃癌细胞系的差异以及宿主动物各个品系的差异,建模方法的差异,各宿主动物的生存时间的差异,腹膜瘤形成的靶向不确定性,造成了腹膜瘤形成的比率存在较大差异,详见表1。
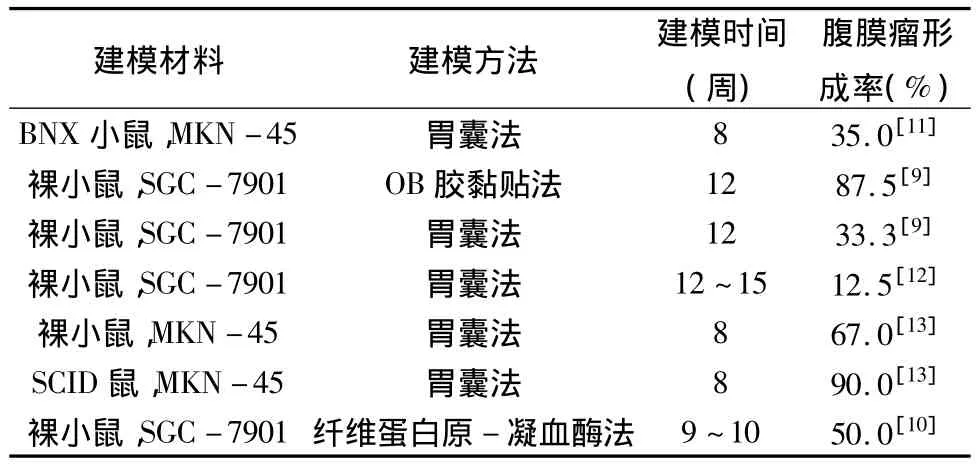
表1 胃癌灶原位移植形成腹膜转移癌的模型比较
2.经皮下穿刺腹腔注射瘤细胞形成腹膜癌:将细胞株制成细胞悬液(浓度数量级一般为106以上),经皮下穿刺腹腔注射形成腹膜瘤。这种方法模拟了胃癌细胞自然脱落形成腹膜瘤的过程,具有简单、易操作、创伤小的优点,深受研究者欢迎。Zhang等[14]选用裸鼠和SCID鼠经皮穿刺腹腔注射胃癌细胞株AGS、NCI-N87和 SNU-16构建腹膜种植瘤模型。探索出将(20~40)×106个 SNU-16细胞经腹腔注射到SCID鼠中,能够构建稳定实用的胃癌腹膜种植瘤模型。该模型的SCID鼠中位生存期为44~78天,可以为抗癌药物的研究,提供一个宽阔的时间窗。该模型中不同的细胞系,不同宿主动物经皮穿刺腹腔注射成瘤率比较,详见表2。
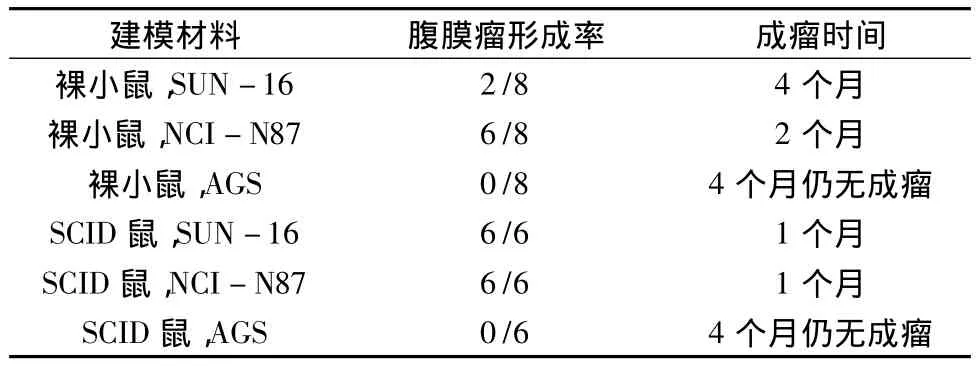
表2 经皮下穿刺腹腔注射法形成腹膜转移癌比较
3.其他方法:(1)开腹胃黏膜下注射瘤细胞法:将宿主动物开腹后,将瘤细胞悬液注射于胃黏膜下,继而形成腹膜癌。(2)开腹后瘤块包埋法:用眼科镊将体积为1.0~2.0mm3的瘤块(细胞系接种宿主动物皮下成瘤所得)包埋于胃窦部大网膜内。梅列军等[15]用兔VX2瘤细胞采用开腹胃黏膜下注射瘤细胞法、开腹后瘤块包埋法、经皮穿刺瘤细胞悬液注射法在新西兰大白兔上建立大动物的腹膜转移癌模型。这3种方法构建模型的成功率分别是100%(12/12)、91.7%(11/12)和58.3%(7/12),呈现出开腹法与经皮穿刺法相比有显著性差别。
二、成功建立胃癌腹膜种植转移动物模型的鉴定
为了鉴定以上几种建模方法造模是否成功,研究员通常在宿主动物出现消瘦、乏力、厌食、腹腔积液、腹部包块等恶病质症状时,将宿主动物开腹直接用肉眼观察腹腔内肿瘤情况,包括大小、部位、质地,有无局部区域侵袭播散等,而对于那些肉眼可疑部位进行取材,借助病理学检查加以筛选。
三、采用细胞系建立胃癌腹膜种植转移动物模型的应用
1.胃癌腹膜转移机制的研究:胃癌腹膜转移涉及黏附、降解、移动、血管生成等多个阶段,每一阶段都有不同种类基因的改变和多种生物学活性物质的介入[16]。王殿栋等[17]采用裸鼠腹腔注射 SGC-7901法建立胃癌腹膜转移模型,联合运用基因芯片技术筛选出数百个胃癌腹膜转移的差异性表达基因。实验研究结果为研究与胃癌腹膜转移的有关基因提供了理论依据并具有一定的参考价值。吴涛等[18]用SGC-7901建立裸鼠腹膜癌转移模型,论述转化生长因子β1(TGF-β1)小干扰RNA抑制SGC-7901腹膜转移。Miyake等[19]通过将HIF-1α敲除的胃癌细胞系采用腹腔注射法建立腹膜种植转移模型,结果发现HIF-1α在腹膜转移癌形成过程中具有促进肿瘤血管形成的作用。
2.抗癌药物动力学及抗癌药效应的研究:Mori等[20]用MKN-45在BALB/c-nu/nu裸小鼠上建立模型,证明口服抗癌药S-1(一种口服的氟尿嘧啶衍生物)具有抑制腹膜转移瘤形成,提高裸小鼠生成率的效应。Aoyagi等[21]在 BALB/c-nu/nu裸小鼠上采用腹腔注射胃癌腹膜高转移细胞系MKN-45P法建立胃癌腹膜转移模型,研究表明贝伐单抗能抑制血管内皮生长因子,抑制胃癌腹膜播散。Oh等[22]在BALB/c-nu/nu裸鼠腹腔注射AGS建立腹膜转移模型,研究WIN55,212-2(大麻素受体激动剂)的抗癌作用。
3.腹腔热灌注疗法(hyperther-mic intraperitoneal chemotherapy,HIPEC)的抗癌疗效研究。董怡民等[23]在BA-LB/c-nu/nu裸小鼠行腹腔注射SGC-7901建立模型,证明纳米活性炭吸附氟尿嘧啶具有提高腹腔内化疗的效果。Tang等[24]用兔VX2细胞株在新西兰大白兔上建立胃癌腹膜转移癌模型,发现肿瘤细胞减灭术联合多西紫杉醇、卡铂腹腔热灌注可显著延长发生胃癌腹膜转移的新西兰大白兔的生存时间。
四、展 望
用细胞系建立胃癌腹膜种植转移动物模型弥补了Hp感染、化学物质诱导动物形成胃癌时间长,腹膜成瘤率低的缺点,也克服了胃癌转基因小鼠价格之昂贵的不足。而笔者介绍的上述几种方法,虽具有腹膜成瘤率高,安全性好,成本低的优点,但仍存在成瘤时间相对较长(数月之久),成功建模动物筛选的主观性(肉眼观察)、复杂性(病理学检测),宿主动物体型偏小(裸小鼠、BNX鼠、SCID鼠)的缺点。为成功建立成熟、稳定、可靠、价廉的胃癌腹膜种植转移动物模型,笔者认为应该从以下3个方面改进:(1)进一步筛选高效的腹膜种植转移细胞系。Koga等[25]建立了腹膜高转移的MKN45-P细胞系,白飞虎等[26]顺利地构建了胃癌腹膜高转移细胞系GC9811-P。(2)采取客观的方法筛选出发生腹膜种植转移的宿主动物。Kaneko等[27]采用绿色荧光蛋白标记的人胃癌细胞系MKN-45建立腹膜癌转移模型,当用荧光立体显微镜时,就可发现腹膜直径150μm大小的微转移癌。这种方法可以客观地筛选出腹膜种植的宿主动物。(3)寻找更大更适宜手术干预的宿主动物。毕竟免疫缺陷小鼠体型较小,有效循环血量少,不利于手术干预。梅烈军等[15]和 Tang等[24]用兔 VX2瘤株建立兔VX2腹膜转移癌模型,但此法笔者认为有些瑕疵,毕竟VX2为SHOP病毒在兔身上诱发出诱发型乳头状瘤后,经过恶变成为鳞癌,非腺癌,不同于人常见的胃腺癌,况且VX2瘤并不是人胃来源的肿瘤。但该模型为研究腹膜各类转移癌提供了较好的科研平台。众所周知,裸小鼠、SCID鼠、BNX鼠都是基因工程产物。随着科学技术的法展,分子生物学领域的不断拓展,更好更经济更适合科研需要的宿主动物的产生应当不是问题。总之,建立胃癌腹膜种植转移模型的细胞系、宿主动物的种类,采用的成瘤方式很多,我们可以通过以上3个方面的改进,进一步完善模型,继而建立出适合不同种应用目的的胃癌腹膜种植转移动物模型。
1 Crew KD,Neugut AI.Epidemiology of gastric cancer[J].World J Gastroenterol,2006,12(3):354-362
2 朱正纲.充分重视胃癌腹膜转移的预防、诊断与治疗[J].外科理论与实践,2003,8(1):16-17
3 Glockzin G,Piso P.Current status and future directions in gastric cancer with peritoneal dissemination[J].Surg Oncol Clin N Am,2012,21(4):625-633
4 曾志荣,胡品津,林汉良,等.幽门螺杆菌感染与胃癌形成关系的动物实验研究[J].中国医师杂志,2002,4(5):454-457
5 徐晶莹,李益民,李玉兰,等.MNNG诱导大鼠胃癌模型的建立[J].哈尔滨医科大学学报,2003,37(2):104-106
6 Shimada S,Mimata A,Sekine M,et al.Synergistic tumour suppressor activity of E-cadherin and p53 in a conditional mouse model for metastatic diffuse-type gastric cancer[J].Gut,2012,61:344-353
7 吴志邦,赵明德,龚林,等.SPF级动物的饲育设施与环境维护[J].泸州医学院学报,2007,30(5):431,362
8 刘少平,张珏,袁静萍,等.胃癌灶原位移植腹膜转移癌裸小鼠模型的建立及生物学性状鉴定[J].中华实验外科杂志,2012,29(10):2082-2084
9 陈亚琳,魏品康,许玲,等.采用OB胶粘贴法建立人胃癌裸鼠原位种植转移模型[J].癌症,2005,24(2):246-248
10 黄玲,朱伟,许晓蒙,等.“纤维蛋白原-凝血酶”法建立人胃癌组织块裸鼠胃癌原位移植模型[J].江苏大学学报:医学版,2010,20(1):29-31
11 姚明,闫明霞,周光兴,等.BNX小鼠人胃癌原位移植模型的建立及其生物学特性的观察[J].肿瘤,2004,24(6):566-569
12 林奇,周士福.人胃癌裸鼠原位移植和转移模型的建立及其生物学特性观察[J].徐州医学院学报,2008,28(7):446-449
13 闫明霞,许兰文,姚明,等.两种免疫缺陷动物人胃癌原位移植模型的肿瘤生物学特性研究[J].上海实验动物科学,2005,25(1):8-12
14 Zhang C,Awasthi N,Schwarz MA,et al.Establishing a peritoneal dissemination xenograft mouse model for survival outcome assessment of experimental gastric cancer[J].Surg Res,2013,182(2):227-234
15 梅列军,杨肖军,李雁,等.兔VX2腹膜转移癌模型的建立及转移特征研究[J].中国肿瘤临床,2009,36(9):523-526
16 朱志,徐惠绵.胃癌腹膜转移的相关基因[J].国际肿瘤学杂志,2008,35(3):202-205
17 王殿栋,段建中,张克实,等.胃癌腹膜转移相关基因的动物实验研究[J].中国肿瘤外科杂志,2010,2(6):331-335
18 吴涛,徐惠绵,吴晓华,等.转化生长因子β1小干扰RNA抑制SGC-7901 腹膜转移[J].中华医学杂志,2006,86(5):343-345
19 Miyake S,Kitajima Y,Nakamura J,et al.HIF-1α is a crucial factor in the development of peritoneal dissemination via natural metastatic routes in scirrhous gastric cancer[J].Int J Oncol,2013,43(5):1431-1440
20 Mori T,Fujiwara Y,Yano M,et al.Experimental study to evaluate the usefulness of S-1 in a model of peritoneal dissemination of gastric cancer[J].Gastric Cancer,2003,6(Suppl 1):13-18
21 Aoyagi K,Kouhuji K,Miyagi M,et al.Molecular targeting therapy using bevacizumab for peritoneal metastasis from gastric cancer[J].World Crit Care Med,2013,2(4):48-55
22 Oh JH,Lee JY,Baeg MK,et al.Antineoplastic effect of WIN 55,212-2,a cannabinoid agonist,in a murine xenograft model of gastric cancer[J].Chemotherapy,2013,59(3):200-206
23 董怡民,沓小容,姚崇舜,等.纳米活性炭吸附氟尿嘧啶在胃癌荷瘤裸鼠体内释放及抑瘤作用的观察[J].中华肿瘤防治杂志,2008,15(23):1768-1770
24 Tang L,Mei LJ,Yang XJ,et al.Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival of gastric cancer with peritoneal carcinomatosis:evidence from an experimental study[J].Transl Med,2011;9:53
25 Koga A,Aoyagi K,Imaizumi T,et al.Comparison between the gastric cancer cell line MKN-45 and the high-potential peritoneal dissemination gastric cancer cell line MKN-45P [J].Kurume Med,2011,58(3):73-79
26 白飞虎,李来生,郭新宁,等.胃癌腹膜高转移潜能细胞系的建立及其生物学特性[J].肿瘤防治研究,2006,33(3):144-147
27 Kaneko K,Yano M,Tsujinaka T,et al.Establishment of a visible peritoneal micrometastatic model from a gastric adenocarcinoma cell line by green fluorescent protein [J].Int J Oncol,2000,16(5):893-898
