Et-DHA通过激活线粒体途径和T细胞granzyme B诱导HepG2细胞凋亡*
2014-05-16陈永顺王雪君陈韵帆刘轲莉陈凤佳鲁建军
陈 鲲, 陈永顺, 王雪君, 陈韵帆, 刘轲莉, 陈凤佳, 鲁建军△
(1广州大学基因干扰研究所,广东广州 510006;2中山大学附属第一医院胸外科,广东广州 510080)
·论 著·
Et-DHA通过激活线粒体途径和T细胞granzyme B诱导HepG2细胞凋亡*
陈 鲲1, 陈永顺1, 王雪君1, 陈韵帆1, 刘轲莉1, 陈凤佳2, 鲁建军2△
(1广州大学基因干扰研究所,广东广州 510006;2中山大学附属第一医院胸外科,广东广州 510080)
目的:本研究探讨了二十二碳六烯酸乙酯(Et-DHA)对人肝癌HepG2细胞凋亡的影响。方法:HepG2细胞用于检测Et-DHA的抑癌活性,MTT法检测Et-DHA对HepG2细胞的直接抑制作用,Hoechst 33258荧光染色观察细胞的形态特征,ELISA法检测Et-DHA处理后HepG2细胞的活性氧簇(ROS)释放量、总超氧化物歧化酶(SOD)和caspase-9活性,Western blotting法检测胞质和线粒体中Bax、Bak、Bid、Bcl-2、Smac和细胞色素C(Cyt C),以及胞质中cleaved caspase-8、cleaved caspase-9和cleaved caspase-3的水平;T细胞与HepG2细胞共培养,进一步观察Et-DHA处理后T细胞的增殖对HepG2细胞活性的影响,并检测了颗粒酶(granzyme)B的水平。结果:Et-DHA显著抑制HepG2细胞的生长(P<0.05),这种抑制作用具浓度效应和时程效应;Et-DHA处理后HepG2细胞的ROS释放量增加,但总SOD活性无明显变化,caspase-9活性显著上升(P<0.05);线粒体上的促凋亡蛋白Bax、Bak和Bid水平增加,而抑凋亡蛋白Bcl-2以及线粒体中Cyt C和Smac的水平降低,胞质中的Cyt C、Smac、cleaved caspase-8、cleaved caspase-9、cleaved caspase-3以及cleaved Bid水平呈剂量性升高。另外T细胞和HepG2细胞共培养组在Et-DHA的诱导下,HepG2细胞的凋亡程度与Et-DHA单独作用时相比进一步增加。在Et-DHA刺激下,T细胞内granzyme B上调,释放到HepG2细胞内的granzyme B明显增多。结论:Et-DHA可能主要通过线粒体内源性途径以及caspase-8途径,激活caspase-3,诱导HepG2细胞凋亡,以及通过间接活化T细胞,促使 granzyme B增多,从而增强对HepG2细胞的毒性作用。
二十二碳六烯酸;HepG2细胞;半胱氨酸天冬氨酸蛋白酶9;颗粒酶B;细胞色素C;Smac蛋白
二十二碳六烯酸(docosahexaenoic acid,DHA,22:6 n-3)是一种n-3多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs),在海洋动物体内含量丰富。近年来作为一种保健食品,具有较好的预防和治疗癌症、降低肿瘤的发生及抗炎等功效,备受广泛关注[1]。n-3多不饱和脂肪酸[二十碳五烯酸(eicosapentaenoic acid,EPA)和DHA]可通过调节肺癌、结肠癌、乳腺癌等肿瘤细胞的凋亡蛋白如Bax的活性和表达,诱导肿瘤细胞凋亡,对肿瘤细胞的异常增殖具有一定的抑制作用[2-6]。n-3多不饱和脂肪酸还可提高肿瘤化疗药物的疗效。离体实验表明,EPA和DHA可提高许多常用抑癌药物(阿霉素、三氧化二砷、丝裂霉素、紫杉醇、表阿霉素、5-氟尿嘧啶和阿糖胞苷)对结肠癌、神经母细胞瘤、乳腺癌、膀胱癌和胶质母细胞瘤等细胞株的抑制作用[2,7-9]。在体实验表明,饲料中添加DHA并联合应用5-氟尿嘧啶可减少荷瘤动物肿瘤块的大小[10]。临床实验表明,EPA和DHA可增加结肠癌对依立替康的敏感性[1],给非小细胞肺癌患者每天添加2.5 g EPA和DHA,化疗效果可提高约2倍,平均延长3周的化疗时程,从而增加患者的存活率[11]。
人类肝细胞癌(hepatocellular carcinoma,HCC)是最常见的五大癌症之一,目前对于肝癌还没有有效的二级预防或系统性治疗,肝癌患者的整体存活率较低。相对于DHA对其它恶性肿瘤抑制作用的报道,目前DHA对原发性肝癌作用的报道较少[2-3]。一项超过9万多人的统计表明多食鱼类和含量高的n-3 PUFAs的食物可以显著降低肝癌的发生率[1]。有研究揭示不饱和脂肪酸可调节肝细胞(HepG2细胞)纤溶酶原激活剂抑制物1的基因转录。虽然已有实验证据表明n-3 PUFA可预防癌变,DHA可通过影响转录因子和基因表达、增强脂质过氧化作用、抑制类花生酸的生物合成等方面诱导肿瘤细胞凋亡[1,12],但是对n-3 PUFAs的抑癌分子机制仍然没有完全阐明,特别是关于DHA对人肝癌HepG2细胞抑制作用的分子机制仍不十分清楚。本研究观察二十二碳六烯酸乙酯(ethyl DHA,Et-DHA)对HepG2细胞增殖和凋亡的影响,并探讨Et-DHA对T细胞和HepG2细胞共培养的作用的分子机制,为肝癌病防治提供新的靶点和策略。
材料和方法
1 材料
1.1 动物 健康成年SPF清洁级BALB/c小鼠,18~22 g,8周龄,购自中山大学实验动物中心。所有实验操作以及动物使用都严格遵守《关于善待实验动物的指导意见》(中国科技部2006)以及广州大学及中山大学动物伦理法规。
1.2 材料 人肝癌HepG2细胞由南京大学刘畅教授惠赠;Et-DHA(22:6Δ4,7,10,13,16,19)购自东京化成工业株式会社(Tokyo),纯度高于98%,-20℃保存;胎牛血清(fetal bovine serum,FBS)和DMEM(Dulbecco’s modified Eagle medium)购自Gibco;总超氧化物歧化酶(superoxide dismutase,SOD)活力测定试剂盒和活性氧簇(reactire oxygen species,ROS)检测试剂盒购自南京建成生物工程研究所;caspase-9活性检测试剂盒购自上海贝博;所有其它的试剂盒均购自Sigma。
2 细胞培养和处理
2.1 脾淋巴细胞的制备和培养 颈椎脱臼处死小鼠,75%乙醇浸泡2 min,无菌条件下切取小鼠脾脏。机械分离脾细胞,用200目滤网过滤,离心后用红细胞裂解液去除红细胞,再用 PBS清洗2次,4℃、3 000×g离心1×10 min,离心后加入培养液,制成细胞悬液,先用培养瓶培养12 h,然后吸取细胞悬液,纯化T细胞,分到6孔板上,并调整细胞浓度为1×108/L。进行药物处理2 d后观察并拍照。
2.2 HepG2细胞培养 使用包含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养液培养HepG2细胞。将培养瓶置于培养条件5% CO2、37℃饱和湿度的培养箱,细胞贴壁生长。细胞分到培养皿时密度大约为 1×108/L。实验组在DMEM培养液内加入Et-DHA(终浓度为0 μmol/L、10 μmol/L、30 μmol/L、100 μmol/L和300 μmol/L)培养24 h,对照组加等体积的DMEM。通过预实验确定本实验的Et-DHA浓度。每个实验重复3次。
2.3 T细胞和HepG2细胞共培养 在已经贴壁的HepG2细胞中按T细胞与刺激细胞10∶1的比例加入T细胞悬液培养24 h和48 h作为实验组,对照组加入相同体积的10 μmol/L Et-DHA。
3 主要方法
3.1 MTT比色法测定细胞活性 将HepG2细胞以1×108/L的密度接种于96孔板,培养24 h,向培养液中各加入不同浓度的Et-DHA(终浓度为0 μmol/L、10 μmol/L、30 μmol/L、100 μmol/L和300 μmol/L),培养24 h和48 h后,用MTT比色法测定细胞活性。
按照1×108/L细胞接种密度对HepG2细胞进行培养,依据之前设计的试剂浓度加入Et-DHA连续培养48 h,获得实验所需的细胞。用裂解液裂解HepG2细胞,按说明书内的规定操作程序来测定SOD,采用酶标仪(Spectra MAX 340)在波长为550 nm处检测SOD吸收值。
3.2 细胞形态分析 为了观察HepG2细胞在凋亡过程中发生的形态变化,用 Hoechst 33258处理HepG2细胞。在室温下将HepG2细胞用4%多聚甲醛固定20 min后,用0.02 mol/L PBS洗涤3次,避光条件下添加10 g/L Hoechst 33258染色10 min,在荧光显微镜下(Nikon)用×100和×200的放大倍数观察细胞。在倒置相差显微镜(×100和×400)下观察T细胞。
3.3 ROS含量的测定 按照1×108/L细胞接种密度对HepG2细胞进行培养,依据之前设计的试剂浓度加入Et-DHA连续培养48 h,获得实验所需的细胞。使用DCFH-DA荧光染色法测定细胞内的活性氧簇的含量。DCFH-DA本身没有荧光,可自由穿过细胞膜,进入细胞内后,细胞内的H2O2等小分子量的过氧化物,即在有ROS的情况下DCFH-DA能够被氧化为生成荧光的二氯荧光素(dichlorofluorescein,DCF),其荧光强度与细胞内的ROS的水平成正比。Et-DHA处理过的HepG2细胞用10 mmol/L的DCFH-DA孵育30 min,PBS清洗2遍,最后DCF的生成量通过酶标仪读数得到,其激发波长为500 nm,发射波长为530 nm。
3.4 总SOD活性测定 按照1×108/L接种密度对HepG2细胞进行培养,依据之前设计的试剂浓度加入Et-DHA连续培养48 h,获得实验所需的细胞。用裂解液裂解HepG2细胞。按说明书内的规定操作程序来测定SOD,采用酶标仪在波长为550 nm处来检测SOD吸收值。重复3次,计算出平均值。总SOD活性(103U/L)=(对照管吸光度-测定管吸光度) ÷50% ×(反应液总量÷所取样品量)。
3.5 Caspase-9活性的测定 以1×108/L细胞接种密度培养HepG2细胞,按照设计的浓度添加Et-DHA继续培养48 h后收集细胞,用裂解液裂解HepG2细胞。用考马氏亮蓝法测定蛋白浓度,然后按试剂盒说明书操作测定caspase-9活性,使用酶标仪在405 nm波长处测定caspase-9的吸收值。计算各Et-DHA实验组caspase-9与对照组细胞caspase-9的相对活性。实验重复3次,取平均值。
3.6 Western blotting检测蛋白的表达 细胞接种于6孔板,进行药物处理,终止培养后细胞溶解于lysis buffer[10 mmol/L HEPES(pH 7.9),1.5 mmol/L MgCl2,10 mmol/L KCl,和0.5%NP-40]中,而后收集细胞至离心管中13 200 r/min离心10 min。选用Folin-酚法测定蛋白酶浓度,以每泳道40 μg蛋白等量上样,聚丙烯酰胺凝胶电泳,电泳后将蛋白转膜至硝酸纤维膜上。用5%脱脂牛奶封闭1 h,Ⅰ抗(1∶1 000)孵育;Ⅱ抗使用羊抗兔IgG(1∶5 000)孵育后,进行ECL检测显影、定影、洗印胶片。Caspase-3 antibody(rabbit,1∶1 000)、caspase-9 antibody(human specific,1∶1 000)、caspase-8 (1C12) antibody (mouse,1∶1 000)、Smac/Diablo antibody(mouse,1∶1 000)、Bid antibody(human specific,1∶1 000)、Bcl-2 antibody(rabbit,1 ∶1 000)、Bax antibody(rabbit,1∶1 000)、细胞色素C(cytochrome C,Cyt C)antibody(rabbit;1∶1 000)、Bak antibody(rabbit,1∶1 000)和颗粒酶(granzyme)B antibody(rabbit,1∶1 000)均购自 Cell Signaling Technologies,其它抗体购自Santa Cruz Biotechnology。电泳条带的强度用 Lab-Works Image Analysis software进行定量分析。
3.7 线粒体和胞浆蛋白分离提取 根据线粒体分离试剂盒(Pierce)使用说明手册操作。细胞接种于6孔板,DHA处理,终止培养后收集细胞至1.5 mL离心管中,在冰浴预冷的Mito-Cyto缓冲液中吹打重悬,移入Wheaten Dounce玻璃匀浆器冰浴中匀浆5 min。匀浆液于4℃、800×g离心10 min,取上清液进一步于4℃、10 000×g离心30 min,收集上清液即得到的胞浆成分(不含细胞核和线粒体)。下面部分即为线粒体部分,用 Mito-Cyto缓冲液 (0.2 mL)重悬,600×g离心5 min,以去除一些颗粒物,再12 000×g离心15 min,悬浮在Mito-Cyto Buffer中的即为线粒体蛋白[13]。测定蛋白含量后进行Western blotting分析。
4 统计学处理
数据用均数±标准差(mean±SD)表示。差异显著性用单因素方差分析(ANOVA)与进行多组样本间差异显著性分析或用Origin 7.0来进行Fisher确切概率检验。以P<0.05为差异有统计学意义。
结果
1 Et-DHA对HepG2细胞数量的影响
HepG2细胞(1.0×108/L)在 10 μmol/L、30 μmol/L、100 μmol/L和300 μmol/L的Et-DHA培养液中培养24 h后,随着Et-DHA浓度上升,HepG2细胞的密度和数量显著下降,与对照组相比分别为98%、90%、80%和70%,见图1。
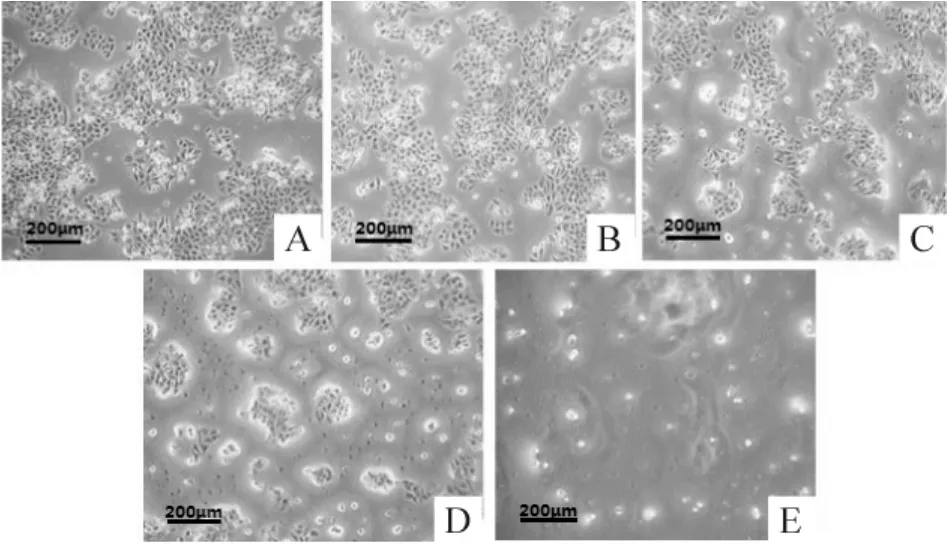
Figure 1. EffectofEt-DHA on numberofHepG2 cells (×100).A:control group;B:10 μmol/L Et-DHA;C:30 μmol/L Et-DHA;D:100 μmol/L Et-DHA;E:300 μmol/L Et-DHA.图1 不同浓度Et-DHA处理对HepG2细胞数量的影响
2 Et-DHA对HepG2细胞活性的抑制作用
用MTT比色法检测Et-DHA是否对HepG2细胞的活性具有抑制作用。Et-DHA作用24 h和48 h后,HepG2细胞的活性显著降低。抑制作用随着Et-DHA浓度(10、30、100和300 μmol/L)的增加以及时间的延长而增强,与对照组(0 μmol/L Et-DHA)相比,差异有统计学意义(P<0.05),见图2。

Figure 2.MTT assay was performed at 24 h and 48 h after the cells were exposed to Et-DHA.*P<0.05 vs 0 μmol/L.图2 不同浓度Et-DHA处理HepG2细胞24 h和48 h后的细胞生长抑制曲线
3 Et-DHA对HepG2细胞核形态的影响
如图3所示,对照组细胞核发淡蓝色,较大较圆,色泽均一,形态规则,表面光滑。100 μmol/L Et-DHA处理后,HepG2细胞核呈高染色密度,核浓缩,细胞膜出泡,核仁裂解,染色体在核膜周边凝聚,凋亡小体形成,这些都呈现程序性细胞凋亡的特征。
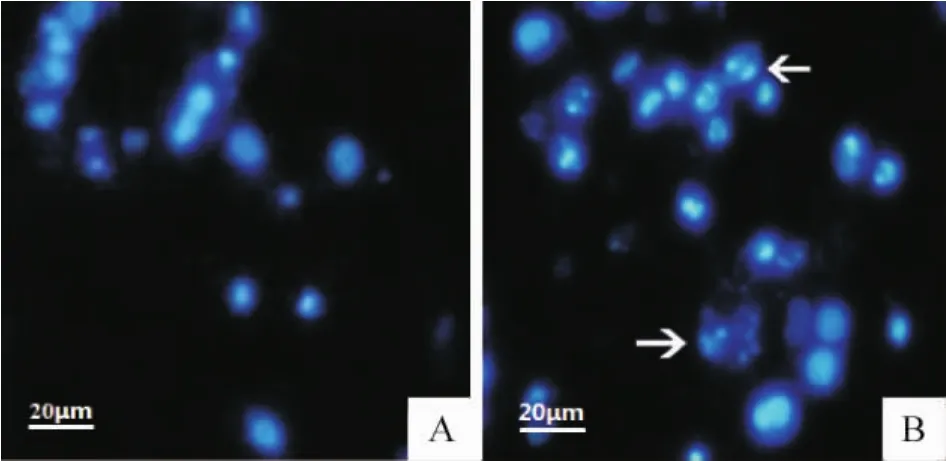
Figure 3.Effect of Et-DHA on the morphology of HepG2 cell nucleus(×400).A:control group cells were pale blue and round;B:after treated with 100 μmol/L Et-DHA,the HepG2 cells revealed a marked nuclear condensation,membrane blebbing,nuclear fragmentation and apoptotic bodies,all of which were the characteristics of apoptotic programmed cell death.图3 Et-DHA对HepG2细胞核形态的影响
4 Et-DHA诱导HepG2细胞凋亡的机制
4.1 Et-DHA对HepG2细胞内ROS的影响 如图4所示,与对照组比较,Et-DHA诱导HepG2的细胞ROS含量均明显增加,且呈剂量-效应关系。经10、30、100和300 μmol/L Et-DHA处理后,DCF出现了近1.3、1.8、2.2和2.5倍的增加。研究表明ROS会导致线粒体膜通透性以及结构的改变[14],因而上述结果提示Et-DHA导致HepG2细胞ROS的大量产生,可能是诱导HepG2细胞凋亡的原因。
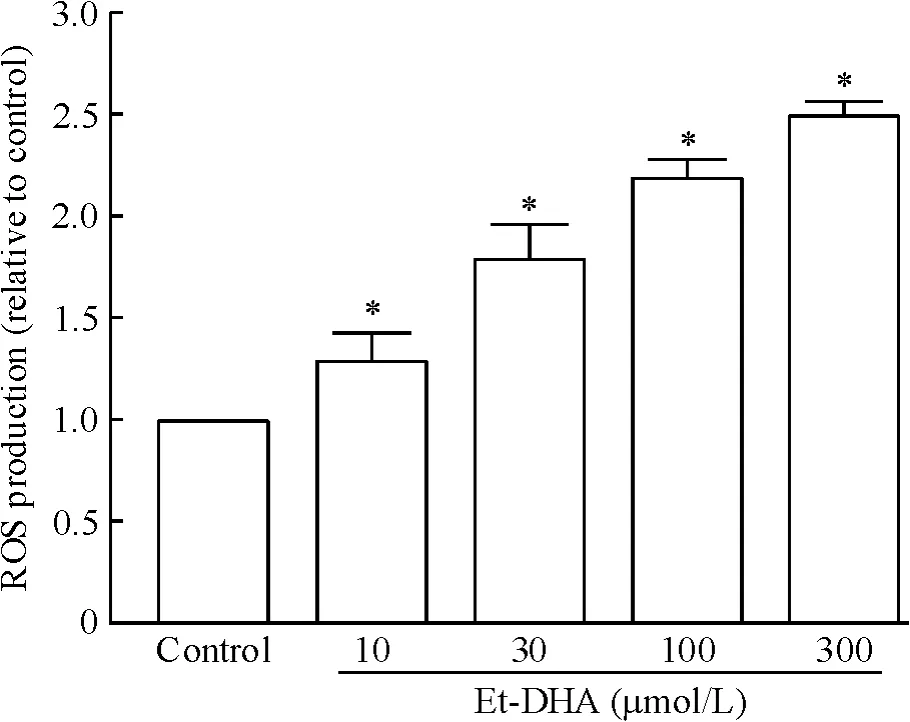
Figure 4.Effect of Et-DHA on the level of ROS in HepG2 cells.*P<0.05 vs control group.图4 Et-DHA对ROS量的影响
4.2 Et-DHA对HepG2细胞总SOD活性的影响Et-DHA作用48 h对HepG2细胞的总SOD活性并无显著影响,提示Et-DHA处理后HepG2细胞的抗氧化能力水平没有显著改变,见表1。
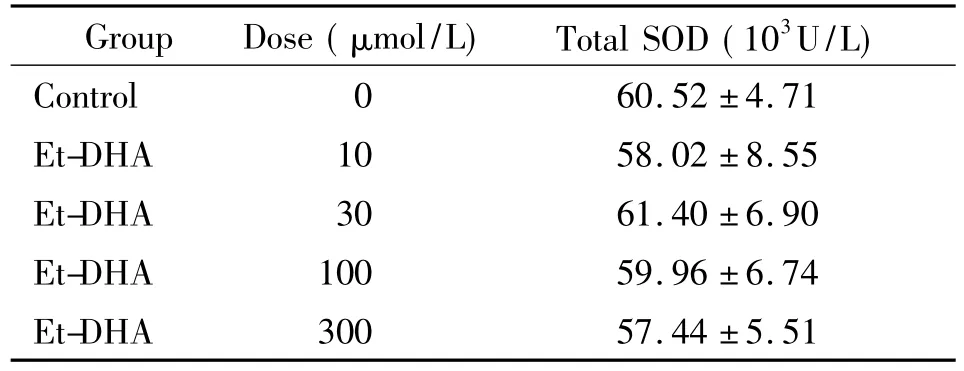
表1 Et-DHA对HepG2细胞总SOD活性的影响Table 1.Effect of Et-DHA on total superoxide dismutase(SOD) activity in HepG2 cells(Mean±SD.n=3)
4.3 Et-DHA对HepG2细胞Bax、Bak和Bid线粒体转位、Bid活化及Bcl-2表达的影响 不同浓度的Et-DHA作用HepG2细胞48 h后,线粒体上的Bax、Bak和Bid的水平均显著高于对照组(P<0.05);Bcl-2水平较对照组下调(P<0.05),表明Et-DHA诱导HepG2细胞凋亡可能主要激活了线粒体凋亡通路。而细胞质中cleaved Bid上调,提示Et-DHA可能也激活了caspase-8凋亡途径,从而活化Bid,见图5。
4.4 Et-DHA对HepG2细胞Cyt C和Smac释放的影响 Et-DHA作用HepG2细胞48 h后,胞浆中Cyt C和Smac水平呈剂量依赖性增加,而线粒体内Cyt C和Smac呈剂量依赖性降低,见图6。
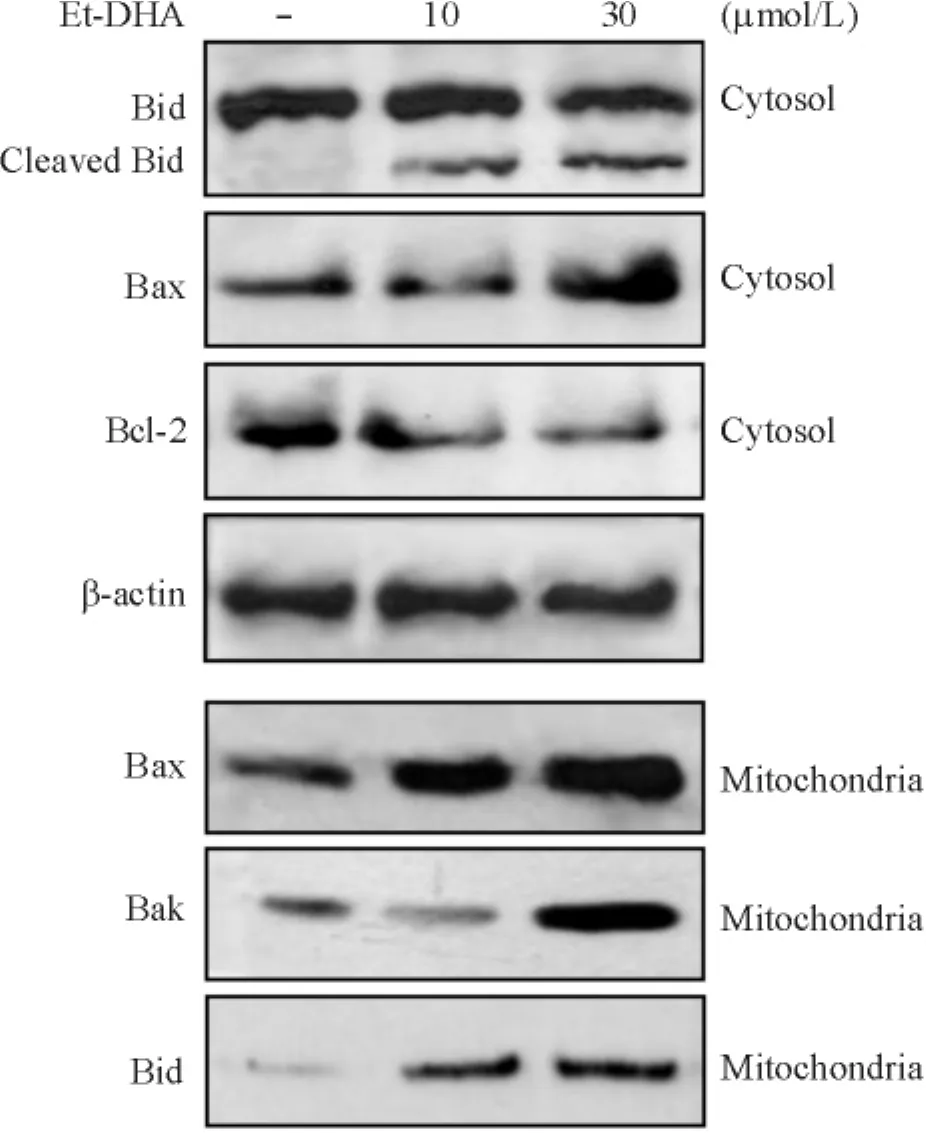
Figure 5.Western blotting analysis of Bid activation,Bcl-2 expression,and Bax,Bak and Bid mitochondrial translocation during Et-DHA-induced apoptosis in HepG2 cells.图5 Et-DHA对Bid活化、Bcl-2表达及Bax、Bak和Bid线粒体转位的影响
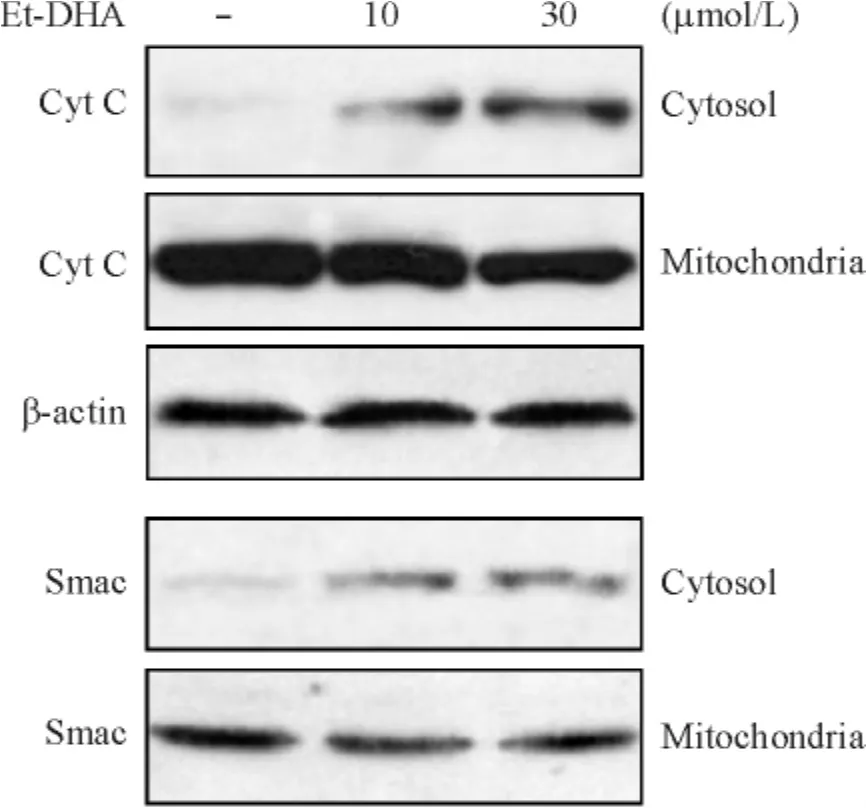
Figure 6.Effects of Et-DHA on the release of Cyt C and Smac in HepG2 cells during apoptosis.图6 Et-DHA对Cyt C和Smac释放的影响
4.5 Et-DHA对HepG2细胞caspase-8、caspase-9和caspase-3的影响 如图7所示 10 μmol/L以及30 μmol/L Et-DHA处理HepG2细胞48 h后,caspase-8和caspase-9酶原被同性活化,被切割成有活性的cleaved caspase-8和 cleaved caspase-9,其中 cleavedcaspase-9水平显著增加,并具剂量-效应关系。我们继而检测了下游的效应分子 caspase-3,结果表明caspase-3酶原也被剂量依赖性切割成 cleaved caspase-3。以上结果表明Et-DHA主要通过线粒体内源途径以及部分caspase-8外源途径交互作用,激活caspase-3,诱导HepG2细胞凋亡。
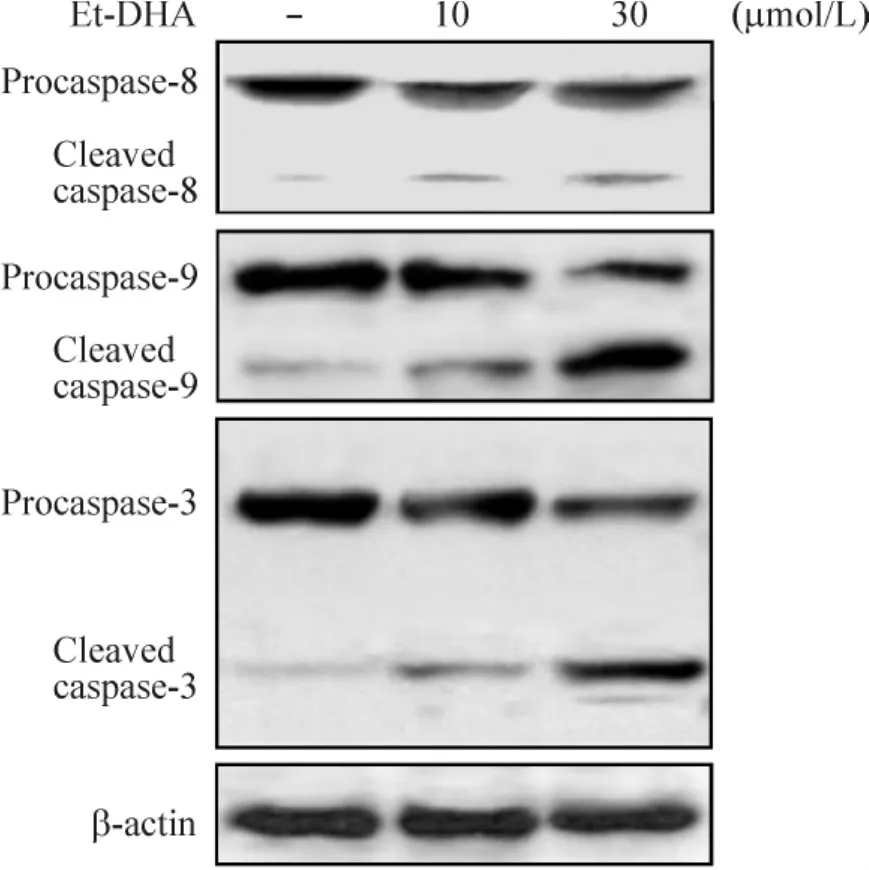
Figure 7.Effects of Et-DHA on the activation of caspase-8,caspase-9 and caspase-3 in HepG2 cells.图7 Et-DHA对caspase-8、caspase-9和caspase-3活化的影响
4.6 Et-DHA对HepG2细胞caspase-9活性的影响
Et-DHA作用HepG2细胞48 h后,HepG2细胞caspase-9活性增加,并呈剂量-效应关系,与对照组相比,P<0.05,见图8。此结果进一步表明线粒体内源途径参与了Et-DHA诱导HepG2细胞凋亡。
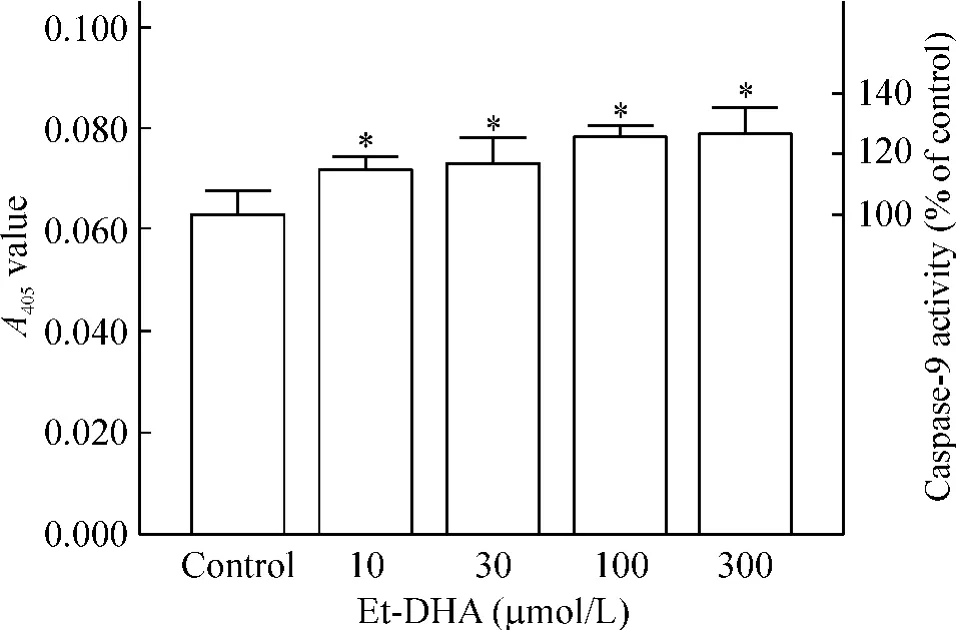
Figure 8.Effect of Et-DHA on caspase-9 activity in HepG2 cells after 48 h of exposure.*P<0.05 vs control group.图8 不同浓度 Et-DHA处理 HepG2细胞 48 h后对caspase-9活性的影响
4.7 Et-DHA对T细胞杀伤HepG2细胞的影响 10 μmol/L Et-DHA促使 T细胞增殖约70% ~90% (P<0.05),见图9A。当10 μmol/L Et-DHA与T细胞共同培养24 h后,HepG2细胞比单独使用Et-DHA时显著减少,并且具有时程-效应关系(P<0.05);当培养48 h时,在Et-DHA和T细胞的共同作用下,HepG2细胞数量比Et-DHA单独作用时显著减少,见图9B。以上结果表明Et-DHA可能通过活化T细胞,促进HepG2凋亡。
4.8 Et-DHA对T细胞granzyme B蛋白表达的影响不同浓度的Et-DHA作用T细胞48 h后,granzyme B较对照组表达显著上调(P<0.05),见图10A;在Et-DHA作用于HepG2细胞或T细胞和HepG2细胞共培养48 h后,移去T细胞,共培养组HepG2细胞内granzyme B水平较空白对照组以及HepG2组上调,granzyme B释放到HepG2细胞内较明显,见图10B。而空白对照组以及 Et-DHA组 HepG2内granzyme B的水平很低(第1、2条带),在与T细胞共培养后,HepG2内granzyme B的水平显著增加(第3条带),而共培养体系中从HepG2细胞中洗脱的T细胞granzyme B较明显(第4条带)。以上结果表明Et-DHA可能通过诱导T细胞释放granzyme B,杀伤HepG2细胞,从而间接诱导HepG2细胞凋亡。
讨论
在近来研究中,EPA和DHA因其具有的预防、抑癌能力及改善心血管功能等功效而倍获关注[1,15]。目前国内外已有许多关于EPA和DHA抗癌机制的研究,主要集中在以下几方面:(1)改变肿瘤细胞膜的结构,(2)破坏机体脂肪酸的形成,(3)阻断肿瘤细胞的信号转导途径,(4)改变体内的脂类代谢[16]。本研究旨在探究Et-DHA诱导的HepG2细胞凋亡是否依赖于脂质过氧化物的过度积累触发凋亡效应,以及Et-DHA激活T细胞后抑癌作用的分子机制。
实验结果显示,Et-DHA作用于HepG2细胞24 h后,均可观察到各浓度实验组的HepG2细胞的密度呈剂量依赖性下降,非贴壁的漂浮细胞增多。这与Araseki等[17]的研究显示HepG2细胞经油酸、花生四烯酸和DHA联合处理后,HepG2细胞存活率呈浓度依赖性下降的结果较一致。MTT检测结果显示,Et-DHA对HepG2细胞的存活率有显著抑制作用,随着Et-DHA的浓度和给药持续时间的增加,抑制率显著增强。在Hochest 33258荧光染色实验中,Et-DHA各浓度组细胞核呈高染色密度,染色体呈强蓝色荧光,核仁裂解,染色体在核膜周边凝聚,碎裂等在细胞程序性凋亡过程中的特征,而对照组细胞不呈现以上特征,暗示Et-DHA可能通过脂质过氧化等途径诱导HepG2细胞凋亡[14,16]。
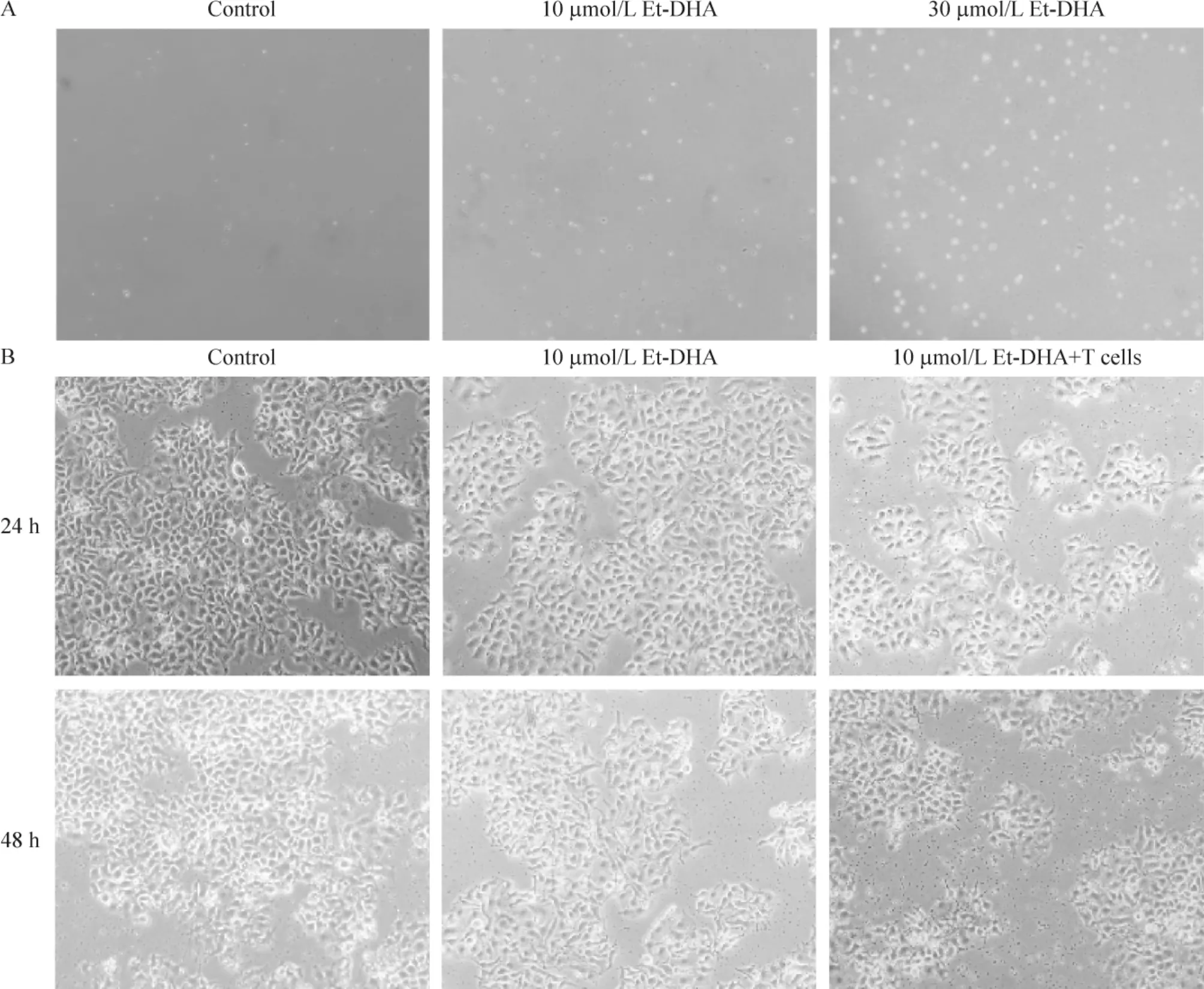
Figure 9.Effect of Et-DHA on HepG2 cells during co-cultured with T cells(×100).A:T cells treated with Et-DHA;B:HepG2 cells treated with Et-DHA and co-cultured with T cells.图9 HepG2细胞与T细胞共培养24 h和48 h后,Et-DHA对HepG2细胞的影响
DHA作为一种长链多不饱和脂肪酸,富集于细胞膜上,化学性质不稳定,容易受到其他离子的攻击,发生脂质过氧化反应。DHA可通过氧化应激,增强细胞膜的脂质过氧化作用、抑制类花生酸的生物合成等方面诱导肿瘤细胞凋亡[1,14]。尽管本实验检测Et-DHA处理HepG2细胞后,各浓度组总SOD活力并无明显变化,HepG2肿瘤细胞的抗氧化水平即清除ROS水平没有统计学意义上的改变,但检测出ROS呈剂量性显著升高,提示这可能与Et-DHA处理HepG2细胞后,膜上含有大量的易被氧化的DHA,氧化应激引起脂质过氧化作用增强有关,与DHA通过影响ROS代谢从而调节结肠癌细胞生长和死亡机理类似[5],也与乳腺癌病人每天补充DHA血液循环磷脂增加后,其化疗效果明显改善的机制类似[12]。而过量累积的ROS会导致线粒体DNA损伤、以及线粒体膜通透性以及结构的改变,继而引发凋亡效应[14]。结果与直接暴露HepG2细胞于2 mmol/L过氧化氢,产生氧化应激能诱导 HepG2肝癌细胞发生凋亡的机制类似[17]
细胞接受凋亡信号(ROS、不可修复DNA损伤等)后,胞内凋亡信号“感受器”(Bid、Bad等)被活化的caspase-8切割后,也被活化,从而对Bcl-2家族包括凋亡抑制因子(Bcl-2、Bcl-xL)等起拮抗作用。从而使处于抑制状态的凋亡促进因子(Bax、Bak等)释放出来,从细胞质中转移到线粒体外膜上,并发生寡聚化,并与膜上电压依赖性阴离子通道相互作用,改变膜的通透性,使线粒体内的凋亡因子 Cyt C和Smac等释放到细胞质中,引发细胞凋亡[18]。本研究通过Western blotting测定Et-DHA处理HepG2细胞后,线粒体上的Bax、Bak以及Bid水平上调,胞浆中的Bid被切割,Bcl-2表达下调,而Bax/Bcl-2比值的改变可影响细胞对诱发凋亡的敏感性,揭示Et-DHA可能通过激活线粒体途径,诱导HepG2细胞凋亡。我们进一步检测到胞浆中的Cyt C和Smac水平升高,而线粒体中的 Cyt C和 Smac水平下降,提示HepG2细胞接收凋亡信号后,在Bax和Bak等凋亡因子的作用下,通透性增加,Cyt C和Smac从线粒体中释放到细胞质中,从而激活下游的 caspase-9及caspase-8家族等凋亡因子。本结果与DHA通过选择性调节凋亡蛋白和通路,诱导结肠癌细胞生长和死亡的机制类似[5]。
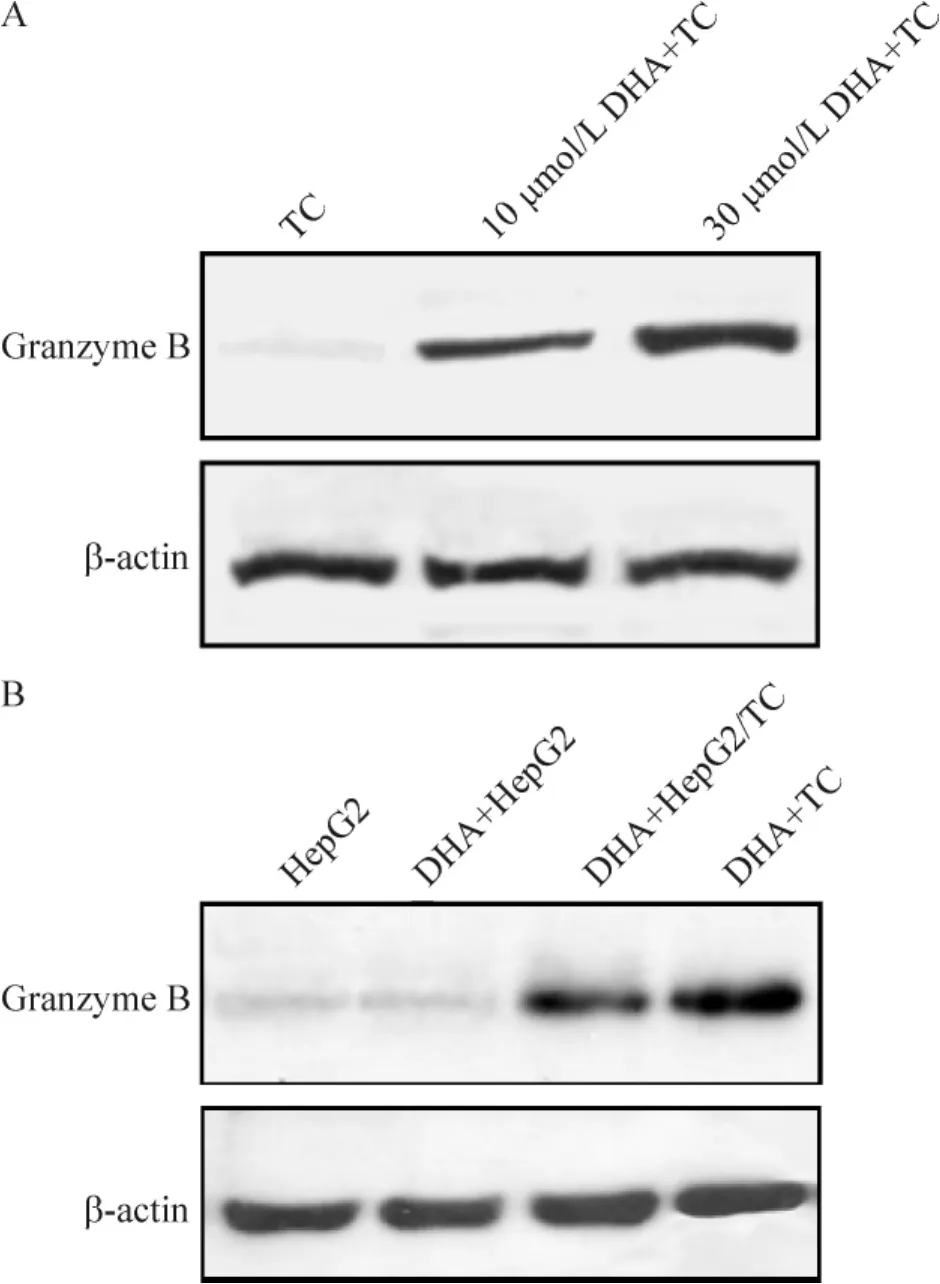
Figure 10.Western blotting analysis of granzyme B secreted by T cells(TC)and penetrated into HepG2 cells during co-culture and Et-DHA(DHA)treatment for 24 h.A:effect of DHA on granzyme B protein expression in TC;B:granzyme B protein in HepG2 cells without treatment(HepG2),DHA-treatedHepG2 cells (DHA+HepG2),DHA-treated HepG2 cells co-cultured with TC(TC were removed;DHA+HepG2/ TC),and TC washed from DHA-treated HepG2 cell co-culture(DHA+TC).图10 Et-DHA对T细胞和HepG2细胞共培养体系中granzyme B表达的影响
Caspases家族是驱动凋亡的分子开关,起始caspase以及效应caspase具有同性活化和异性活化的特征。被活化的 caspase-9和caspase-8则接着激活位于级联反应下游的效应caspase-3,使级联反应快速地扩大。而caspase-9是线粒体的凋亡程序中不可或缺的起始因子,本实验结果显示,HepG2细胞经Et-DHA处理后,caspase-9和 caspase-3被切割成cleaved caspase-9和cleaved caspase-3,caspase-9的活性大大提高,且与其浓度呈正相关,提示caspase-9是Et-DHA抑制HepG2细胞生长的重要参与者。凋亡程序的开始信号到达线粒体以后,诱导线粒体排放出Cyt C,之后Cyt C与凋亡蛋白酶活化因子1反应,并使其空间结构改变成为八聚体,后者和caspase-9反应并导致它开始活化自身,进而切割下游的caspase-3。活化的效应 cleaved caspase-3可活化caspase激活的脱氧核糖核酸酶,切割DNA成200 bp的DNA片段,诱发HepG2细胞凋亡。根据以上结果推测,Et-DHA处理后HepG2细胞的凋亡方式,与白细胞介素4诱导HepG2细胞凋亡类似,主要与线粒体凋亡途径相关[13]。
此外,我们的结果还显示细胞质中caspase-8和Bid也微弱地被切割,并且Smac的水平升高。以上结果提示,Et-DHA抑制HepG2细胞生长,也可能部分通过激活caspase-8内源凋亡途径。这与EPA通过ROS堆积、caspase-8活化以及自噬诱导胰腺癌凋亡的机制类似[13]。
先前的研究表明自然杀伤细胞对不同肝癌细胞株(K562、BEL-7402、SMMC-7721和HepG2)具有一定的杀伤作用[19],那么Et-DHA在机体内是否可通过活化T淋巴细胞perforin-granzyme B途径来诱导HepG2细胞凋亡呢?为了验证以上设想,我们采用淋巴细胞和HepG2共培养体系,模拟了机体内细胞生存环境,观察Et-DHA是否间接通过激活T细胞,从而增加 T细胞杀伤 HepG2效应。结果表明Et-DHA诱导T细胞增殖,当共培养时,与Et-DHA单独处理HepG2细胞相比,其凋亡率更显著。以上结果暗示Et-DHA通过活化T淋巴细胞,促使增殖,并释放细胞因子,对HepG2细胞的毒性增强,从而间接抑制HepG2细胞的生长[20]。
当激活的细胞毒性T细胞与靶细胞结合后,经颗粒胞吐方式,效应细胞释放致密的胞质颗粒及其内容物到达靶细胞和效应细胞的结合位点处,对靶细胞进行致死性的攻击。在脱颗粒过程中释放许多大分子物质,其中最主要的为granzyme B,检测T细胞granzyme B分子的表达可以直接反映T细胞的杀伤力[21]。本研究发现,DHA作用后,T细胞内以及HepG2细胞内granzyme B均较对照组明显升高(P<0.05),表明DHA通过活化T细胞,上调granzyme B的表达,从而在机体内间接增强诱导HepG2凋亡。而在T细胞的增殖活化过程中,ERK1/2信号通路扮演着重要角色。DHA是否通过抑制ERK1/2信号通路,有待进一步研究。
总之,在Et-DHA诱导人肝癌HepG2细胞凋亡的过程中,caspase-9以及granzyme B扮演了重要角色。本研究的结果将为临床上利用n-3多不饱和脂肪酸预防及辅助治疗人类肝癌提供一定依据,无论单独使用或是结合化疗药物联合辅助使用都可能是一种高效、对正常细胞无毒性、安全的肝癌病人的生物预防和治疗策略。
[1]Vaughan VC,Hassing MR,Lewandowski PA.Marine polyunsaturated fatty acids and cancer therapy[J].Br.J.Cancer,2013,108(3):486-492.
[2]Araseki M,Kobayashi H,Hosokawa M,et al.Lipid peroxidation of a human hepatoma cell line(HepG2)after incorporation of linoleic acid,arachidonic acid,and docosahexaenoic acid[J].Biosci Biotechnol Biochem,2005,69 (3):483-490.
[3]Sun SN,Jia WD,Chen H,et al.Docosahexaenoic acid (DHA)induces apoptosis in human hepatocellular carcinoma cells[J].Int J Clin Exp Pathol,2013,6(2):281-289.
[4]Sato SB,Park J,Kawamoto J,et al.Inhibition of constitutive Akt(PKB)phosphorylation by docosahexaenoic acid in the human breast cancer cell line MDA-MB-453[J].Biochim Biophys Acta,2013,1831(2):306-313.
[5]Skender B,Vaculova AH,Hofmanova J.Docosahexaenoic fatty acid(DHA)in the regulation of colon cell growth and cell death:a review[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2012,156(3):186-199.
[6]Yao QH,Zhang XC,Fu T,et al.ω-3 polyunsaturated fatty acids inhibit the proliferation of the lung adenocarcinoma cell line A549 in vitro[J].Mol Med Rep,2014,9(2): 401-406.
[7]Rudra PK,Krokan HE.Cell-specific enhancement of doxorubicintoxicity in human tumour cells by docosahexaenoic acid[J].Anticancer Res,2001,21(1A):29-38.
[8]Coleman WB.Mechanisms of human hepatocarcinogenesis[J].Curr Mol Med,2003,3(6):573-588.
[9]Sawada N,Inoue M,Iwasaki M,et al.Consumption of n-3 fatty acids and fish reduces risk of hepatocellular carcinoma[J].Gastroenterology,2012,142(7):1468-1475.
[10]Chua ME,Sio MC,Sorongon MC,et al.Relationship of dietary intake of omega-3 and omega-6 fatty acids with risk of prostate cancer development:a meta-analysis of prospective studies and review of literature[J].Prostate Cancer,2012,2012:826254.
[11]Murphy RA,Mourtzakis M,Chu QS,et al.Supplementation with fish oil increases first-line chemotherapy efficacy in patients with advanced nonsmall cell lung cancer[J].Cancer,2011,117(18):3774-3780.
[12]Bougnoux P,Hajjaji N,Ferrasson MN,et al.Improving outcome of chemotherapy of metastatic breast cancer by docosahexaenoic acid:a phase II trial[J].Br J Cancer,2009,101(12):1978-1985.
[13]Aoudjehane L,Podevin P,Scatton O,et al.Interleukin-4 induces human hepatocyte apoptosis through a Fas-independent pathway[J].FASEB J,2007,21(7):1433-1444.
[14]Fukui M,Kang KS,Okada K,et al.EPA,an omega-3 fatty acid,induces apoptosis in human pancreatic cancer cells:role of ROS accumulation,caspase-8 activation,and autophagy induction[J].J Cell Biochem,2013,114 (1):192-203.
[15]贺艳丽,叶 平,周 新.不饱和脂肪酸影响HepG-2细胞PAI-1表达的机制初探[J].中国病理生理杂志,2005,21(3):436-440.
[16]Di Nunzio M,Valli V,Bordoni A.Pro-and anti-oxidant effects of polyunsaturated fatty acid supplementation in HepG2 cells[J].Prostaglandins Leukot Essent Fatty Acids,2011,85(3-4):121-127.
[17]国 平,吴灵飞,蒲泽锦.氧化应激诱导HepG2肝癌细胞凋亡的研究[J].中国病理生理杂志,2008,24(1): 105-111.
[18]Lim K,Han C,Dai Y,et al.Omega-3 polyunsaturated fatty acids inhibit heptocellular carcinoma cell growth through blocking β-catenin and cyclooxygenase-2[J].Mol Cancer Ther,2009,8(11):3046-3055.
[19]黎建军,陈诗萍,古模发.NK细胞对不同人肝癌细胞株的杀伤作用[J].中国病理生理杂志,2012,28(4): 638-642.
[20]Calder PC.Immunomodulation by omega-3 fatty acids[J].Prostaglandins Leukot Essent Fatty Acids,2007,77(5-6):327-335.
[21]Fritsch K,Finke J,Grüllich C.Suppression of granzyme B activity and caspase-3 activation in leukaemia cells constitutively expressing the protease inhibitor 9[J].Ann Hematol,2013,92(12):1603-1609.
Et-DHA induces apoptosis of HepG2 cells through activation of mitochondrial pathway and induction of granzyme B expression in T cells
CHEN Kun1,CHEN Yong-shun1,WANG Xue-jun1,CHEN Yun-fan1,LIU Ke-li1,CHEN Feng-jia2,LU Jian-jun2
(1Institute of Gene Interference,Guangzhou University,Guangzhou 510006,China;2Department of Thoracic Surgery,the First Affiliated Hospital of Sun Yat-sen University,Guangzhou 510080,China.E-mail:kchennju@hotmail.com)
AIM:To investigate the effect of ethyl docosahexaenoate(Et-DHA)on the apoptosis of human hepatocarcinoma HepG2 cells.METHODS:HepG2 cells were used to test the anticarcinogenicity of Et-DHA.The direct inhibition of HepG2 cells by Et-DHA was detected by MTT.Nuclear morphological features of the HepG2 cells were observed under fluorescence microscope after staining with Hochest 33258.The levels of Bax,Bak,Bid,Bcl-2,Smac and cytochrome C(Cyt C)in mitochondria and cytosol,the cleaved caspase-8,cleaved caspase-9,and cleaved caspase-3 in cytosol,as well as the release of reactive oxygen species(ROS),total superoxide dismutase(SOD)and caspase-9 activity in the Et-DHA-treated HepG2 cells were determined by Western blotting and ELISA.Furthermore,by co-culturing the HepG2 cells with T cells,the effects of proliferation of Et-DHA-treated T cells on the activity of HepG2 cells were observed,and the level of granzyme B was detected.RESULTS:Et-DHA significantly inhibited the growth of HepG2 cells ina concentration-and time-dependent manner.The ROS release and caspase-9 activity increased markedly in Et-DHA-treated HepG2 cells,and no significant change of the total SOD activity was observed.The levels of the pro-apoptotic proteins Bax,Bak and Bid in mitochondria increased,the anti-apoptotic protein Bcl-2 as well as mitochondrial Cyt C and Smac levels decreased,and the cytoplasmic Cyt C,Smac,cleaved caspase-8,cleaved caspase-9,cleaved caspase-3 and cleaved Bid levels showed dose-dependent increases.Additionally,the degree of Et-DHA-induced apoptosis in HepG2 cells in the co-culture group(T cells+HepG2 cells)showed a further increase as compared with the HepG2 cells treated with Et-DHA alone.Due to Et-DHA inducing elevation of granzyme B level in the T cells,the granzyme B released into HepG2 cells was significantly increased.CONCLUSION:Et-DHA might induce the apoptosis of HepG2 cells through activation of caspase-3 mainly via a mitochondrial intrinsic pathway and a caspase-8 pathway,and promote the increase in granzyme B indirectly by activating T cells,thus enhancing the cytotoxic effect on HepG2 cells.
Docosahexaenoic acids;HepG2 cells;Caspase-9;Granzyme B;Cytochrome C;Smac protein
R363
A
10.3969/j.issn.1000-4718.2014.03.001
1000-4718(2014)03-0385-09
2013-11-15
2014-01-20
国家自然科学基金资助项目(No.31171281);广州市教育局科技计划项目(No.10A044)
△通讯作者Tel:020-87755766;E-mail:kchennju@hotmail.com
