沉默FRAT1基因对结肠癌HT-29细胞增殖与凋亡的影响及其机制研究
2014-05-16王苏雅于庆功张欣欣杨子荣李文哲
王苏雅,于庆功*,谷 伟,张欣欣,杨子荣,李文哲
沉默FRAT1基因对结肠癌HT-29细胞增殖与凋亡的影响及其机制研究
王苏雅1,于庆功1*,谷 伟1,张欣欣1,杨子荣1,李文哲2
(1.大连大学附属中山医院消化内科,辽宁大连116001;2.大连大学生命科学与技术学院免疫研究所,辽宁大连116622)
目的 探讨沉默FRAT1基因对结肠癌HT-29细胞增殖、凋亡的影响及其可能分子机制。方法 将成功转染FRAT1基因RNA干扰序列的人结肠癌HT-29细胞扩大培养,MTT比色法检测细胞增殖,双染流式细胞术检测细胞凋亡率,单染流式细胞术分析细胞周期,免疫荧光法激光共聚焦显微镜下观察β-catenin蛋白变化。结果 转染组细胞较对照组细胞生长明显减缓(P<0.01),凋亡率明显增加(P<0.01),细胞周期出现G0/G1期阻滞,差异显著(P<0.01),胞质β-catenin蛋白表达明显下调。结论 FRAT1基因RNA干扰序列可以有效诱导结肠癌HT-29细胞凋亡和细胞周期阻滞,抑制细胞增殖,其机制可能通过下调β-catenin表达实现。
结肠癌;FRAT1;β-catenin;增殖;凋亡
(Chin J Lab Diagn,2014:18:0195)
FRAT1(frequently rearranged inadvanced T-cell lymphomas 1)基因为一种鼠原癌基因类似物[1],研究发现在多种肿瘤中高表达[25],其编码蛋白是首个被发现的GSK(蛋白质糖原合成酶激酶)-3β抑制蛋白,通过抑制GSK-3β对β-catenin磷酸化发挥作用,因而是Wnt/β-catenin信号转导通路的重要激活分子。β-catenin是Wnt/β-catenin通路核心成员,胞质内β-catenin异常蓄积可激活Wnt/βcatenin通路,促进细胞增殖抑制凋亡,最导致肿瘤发生[6-8]。本研究通过对FRAT1基因沉默的人结肠癌HT-29细胞进行检测,来研究FRAT1对结肠癌细胞增殖、凋亡及细胞周期分布的影响及其可能机制,为FRAT1基因治疗的临床应用提供实验依据。
1 材料和方法
1.1 实验材料 成功转染FRAT1基因RNA干扰序列的人结肠癌HT-29细胞由本研究组前期实验完成,DMEM培养基购自美国Gibco公司,胎牛血清购自杭州四季青生物工程公司,四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、PI、4',6-diamidino-2-phenylindole(DAPI)购自美国Sigma公司;Annexin V-FITC/PI凋亡试剂盒购自南京凯基生物公司,兔抗人β-catenin单克隆抗体、FITC标记羊抗兔荧光二抗购自美国Santa Cruz公司。
1.2 实验方法
1.2.1 实验分组 前期通过阳离子聚合物基因转染方法,将有效干扰载体质粒、空载体质粒以及阴性对照质粒分别转染人结肠癌HT-29细胞,并经过G418筛选,建立了稳定转染的细胞系,同时在HT-29细胞中单独加入离子聚合物作为平行对照,四组依次命名为:HT-29-S、HT-29-neo、HT-29-NC以及HT-29。
1.2.2 MTT比色法绘制细胞生长曲线 取四组细胞分别调整细胞浓度至4×104/ml,将细胞悬液接种于96孔板。每孔加入200μl含10%胎牛血清的DMEM高糖培养基,置于5%CO2,37℃环境的培养箱中。接种后于24h、48h、72h各收集细胞一次。各组细胞在收集后弃上清,加入含0.5%MTT的培养基200μl继续培养4h。弃上清后加入DMSO 150μl震荡至结晶物充分溶解,用酶标仪测定490nm波长处各孔的吸光值(A值)。以时间为横坐标,A值为纵坐标,根据各组吸光度绘制细胞生长曲线。
1.2.3 流式细胞术检测细胞周期 将四组细胞以1×106/ml接种于25ml培养瓶,至80%融合时用胰酶轻微消化,冰PBS洗3遍,将单细胞悬液用一次性注射器针头打入70%冰乙醇中,置4℃固定过夜。次日弃乙醇并用PBS洗2遍,加入含RnaseA的碘化丙啶(PI)染液,避光反应30min,使用流式细胞仪测定各组细胞周期。
1.2.4 Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率 取四组对数生长期细胞,收集培养基中悬浮死亡细胞,贴壁细胞用不含EDTA胰酶轻微消化后与之前收集的悬浮死亡细胞一起PBS洗2遍,滤网过滤并进行细胞计数以保证细胞密度在1-5×105/ml,加入500μl Binding Buffer悬浮细胞后加入5μl Annexin V-FITC和5μl PI,于室温下避光反应15min,进行流式细胞仪检测分析。
1.2.5 β-catenin免疫荧光染色 6孔板预置合适玻片,将四组细胞按4×105/ml密度分别接种于孔内玻片,在5%CO2,37℃环境培养箱中培养至细胞长满玻片80%,取出PBS洗3遍,每次10min(以下PBS冲洗皆同此法),4%多聚甲醛固定20min,PBS冲洗,0.2%Triton-100在37℃通透打孔15 min,PBS冲洗,胎牛血清封片30min吸净封片液,滴加β-catenin一抗(1∶100),置于湿盒4℃过夜。次日PBS冲洗,滴加FITC标记的荧光二抗室温避光孵育2h,PBS冲洗后DAPI染核,甘油封片,荧光共聚焦显微镜下观察拍照。
1.2.6 统计分析 应用SPSS 19.0统计软件对实验结果进行数据分析。计量资料以_x±s表示,多个样本均数比较采用单因素方差分析,多样本两两比较采用SNK-q检验,计数资料率的比较用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MTT法检测转染各组细胞生长曲线FRAT1基因沉默对HT-29细胞的增殖有明显抑制作用,并且抑制具有时间依赖性。HT-29-S组细胞生长速度(吸光度A值)明显低于HT-29组、HT-29-neo组和HT-29-NC组(P<0.01),HT-29组、HT-29-neo组、HT-29-NC组三组之间差异无统计学意义(P>0.05)(表1,图1)。

表1 沉默FRAT1基因对HT-29细胞增殖的影响(A490吸光度值)(_x±s,n=3)

图1 四组细胞的生长曲线
2.2 流式细胞术检测细胞周期 结果显示,与HT-29、HT-29-neo和HT-29-NC组细胞相比,HT-29-S组G0/G1期细胞明显增加(P<0.01),G2/M期细胞明显减少(P<0.01),S期无明显改变,表明FRAT1基因沉默后HT-29细胞发生了G1期阻滞,并对细胞增殖能力产生了抑制作用。(表2,图2)。
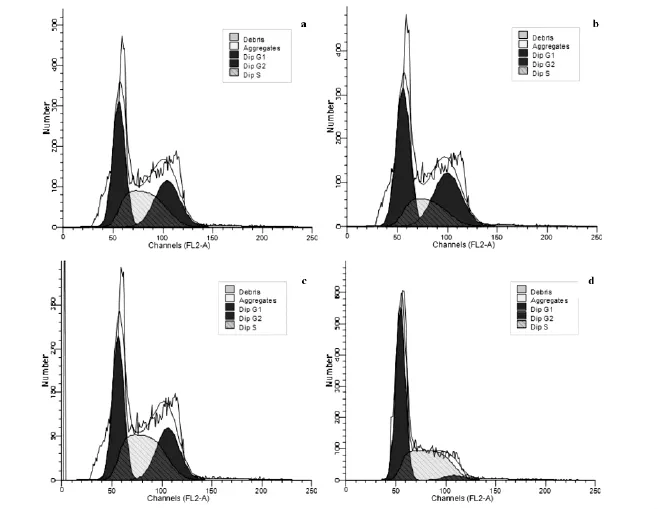
图2 默FRAT1基因对HT-29细胞周期的影响

表2 染沉默FRAT1基因对HT-29细胞周期的影响(_x±s,n=3)单位:%
2.3 流式细胞术检测细胞凋亡率 经Annexin VFITC/PI双染流式上机检测结果显示,HT-29、HT-29-neo、HT-29-NC和HT-29-S的早期凋亡率分别为(0.37±0.06)%,(0.40±0.11)%,(0.45±0.09)%,(40.05±2.59)%,阳性转染组HT-29-S凋亡率显著高于其他3组(P<0.01)(表3,图3),转染沉默FRAT1基因可明显促进HT-29细胞凋亡。

表3 沉默FRAT1基因对HT-29细胞凋亡率的影响(_x±s,n=3)单位:%
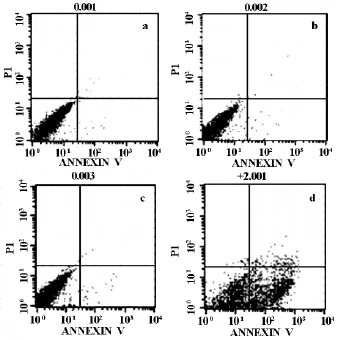
图3 转染沉默FRAT1基因对HT-29细胞凋亡率的影响
2.4 免疫荧光检测β-catenin蛋白的表达 β-catenin蛋白在肿瘤细胞中主要表达于细胞质,同时可见表达于胞核,而在正常细胞中只少量表达于细胞膜。免疫荧光共聚焦显微镜下图片显示,HT-29、HT-29-neo和HT-29-NC细胞爬片可见胞质内强荧光,并表达于胞核。HT-29-S细胞爬片胞质内显示微弱荧光,胞核几乎不表达(图4)。结果表明转染干扰RNA序列的HT-29细胞内β-catenin表达下调,FRAT1基因可能通过上调β-catenin表达来抑制细胞凋亡并由此促进细胞增殖。FRAT1在包括食管鳞状细胞癌、乳腺癌、卵巢癌、非小细胞肺癌、脑胶质瘤在内的多种人类恶性肿瘤中存在表达上调现象。Guo等[4]发现脑胶质瘤中FRAT1蛋白表达量低者预后明显好于FRAT1蛋白表达量高者,Zhang等[5]研究表明非小细胞肺癌

图4 β-catenin在HT-29细胞中的表达情况
3 讨论
FRAT1是一种最初发现于进展期T细胞淋巴瘤中的原癌基因,具有原癌结合蛋白属性,在人染色体10q24.1处编码一种分子量29kD(1Da=0.9921u)的GSK-3β结合蛋白。多项研究证实,FRAT1mRNA量与肿瘤TNM分期密切相关。FRAT1蛋白通过与GSK-3β结合激活Wnt信号转导通路,属于该通路的激活因子。研究证实多种肿瘤存在Wnt通路异常现象,在Wnt经典通路中,数种通路组成蛋白皆与β-catenin相互作用,因此βcatenin无疑是Wnt经典信号转导通路的核心成员。β-catenin是一条由多肽链组成的胞质内蛋白,Wnt信号缺失时,β-catenin在其他蛋白的辅助下形成复合物[6]然后迅速降解[7]而不至在细胞中累积。当激活Wnt信号时,GSK-3β活性被抑制,导致β-catenin磷酸化异常,细胞质内出现大量游离β-catenin,进而β-catenin在胞核内增加,与核内T细胞因子/淋巴增强结合因子(Tcelltranscriptional factor/Lymphoid enhancer factor,TCF/LEF)形成复合物,激活cmyc、Cox-2、cyclin D1等基因,使细胞周期发生改变或产生异常蛋白,随之发生癌变。一些学者研究证实,β-catenin在食管鳞状细胞癌、乳腺癌的胞质胞核中均有显著表达上调现象[8,9],更有深入研究表明,胃癌组织中β-catenin高表达可能与病理学分型有关[10]。而在结肠癌中,高达66-79%出现胞质和胞核β-catenin异常表达[11],但β-catenin高表达是否与FRAT1基因有关尚未见报道。
本研究用siRNA靶向干扰结肠癌HT-29细胞FRAT1基因,探讨其对HT-29细胞增殖、凋亡的影响。采用MTT法检测FRAT1蛋白表达降低或缺失的HT-29细胞增殖活性的变化,与空载体组、阴性对照组以及平行对照组比较,经FRAT1基因沉默后的HT-29细胞增殖活性显著下降,并利用流式细胞术检测FRAT1基因沉默后其细胞周期的变化,结果显示FRAT1基因沉默对细胞周期产生了显著影响,有效沉默组的细胞较多地被阻滞于G0/G1期,而空载体组、阴性对照组以及平行对照组G2/M期比例较高,FRAT1的表达缺失使肿瘤细胞不能及时停留于G2/M期,削弱了细胞的自我修复,从而抑制HT-29细胞增殖。在Annexin V-FITC/PI双染流式细胞术检测细胞凋亡率的试验中:FRAT1基因沉默组的HT-29细胞早期凋亡率达(40.05±2.59)%,与其他3组细胞差异显著。这些均提示了FRAT1对HT-29细胞凋亡的负向调节作用。进一步的激光共聚焦显微镜下免疫荧光技术显示,FRAT1基因的沉默干扰了Wnt/β-catenin信号通路中重要分子β-catenin的细胞内表达。由此我们推测FRAT1对Wnt/β-catenin信号通路中βcatenin蛋白表达的上调作用可能激活了Wnt/βcatenin信号通路,从而抑制了细胞的凋亡诱导效应促进其增殖。
我们的实验数据支持以下结论:采用RNA干扰技术沉默FRAT1基因能够抑制结肠癌HT-29细胞增殖并促进其凋亡,其机制可能与下调β-catenin表达有关。这表明利用RNA干扰技术沉默FRAT1基因有望成为治疗结肠癌的一种新途径。但结肠癌作为一种多基因、多因素恶性疾病,以FRAT1作为靶基因治疗的更多依据以及其安全有效性等问题还需要在体内试验中证实。
[1]Saitoh T,Katoh M.FRAT1and FRAT2clustered in human chromosome 10q24.1region,are up-regulated in gastric cancer[J].Int J Oncol,2001,19(2):311.
[2]Wang Y,Hewitt SM,Liu S,et al.Tissue microarray analysis of human FRAT1expression and its correlation with the subcellular localisation ofβ-catenin in ovarian tumours[J].British journal of cancer,2006,94(5):686.
[3]Wang Y,Liu S,Zhu H,et al.FRAT1overexpression leads to aberrant activation ofβ-catenin/TCF pathway in esophageal squamous cell carcinoma[J].International Journal of Cancer,2008,123(3):561.
[4]Guo G,Liu B,Zhong C,et al.FRAT1expression and its correlation with pathologic grade,proliferation,and apoptosis in human astrocytomas[J].Medical Oncology,2011,28(1):1.
[5]Zhang Y,Han Y,Zheng R,et al.Expression of Frat1correlates with expression ofβ-catenin and is associated with a poor clinical outcome in human SCC and AC[J].Tumor Biology,2012,33(5):1437.
[6]Fujii N,You L,Xu Z,et al.An Antagonist of Dishevelled Protein-Protein Interaction Suppressesβ-Catenin-Dependent Tumor Cell Growth[J].Cancer research,2007,67(2):573.
[7]Gavert N,Ben-Ze'ev A.β-Catenin signaling in biological control and cancer[J].Journal of cellular biochemistry,2007,102(4):820.
[8]Nakanishi Y,Ochiai A,Akimoto S,et al.Expression of E-cadherin,α-catenin,β-catenin and plakoglobin in esophageal carcinomas and its prognostic significance[J].Oncology,2009,54(2):158.
[9]Prasad C P,Rath G,Mathur S,et al.Potent growth suppressive activity of curcumin in human breast cancer cells:modulation of Wnt/β-catenin signaling[J].Chemico-biological interactions,2009,181(2):263.
[10]Kundu J,WAHAB S M R,Kundu J K,et al.Tob1induces apoptosis and inhibits proliferation,migration and invasion of gastric cancer cells by activating Smad4and inhibitingβ-catenin signaling[J].International journal of oncology,2012,41(3):839.
[11]Vignjevic D,Schoumacher M,Gavert N,et al.Fascin,a novel target ofβ-catenin-TCF signaling,is expressed at the invasive front of human colon cancer[J].Cancer research,2007,67(14):6844.
Effect of FRAT1 gene Silencing on proliferation and apoptosis of Colon cancer HT-29 cells and possible relevant mechanism
WANG Su-ya1,YU Qing-gong1,GU Wei1,et al.
(1.Department of Gastroenterology,Affiliated hospital of Dalian University,Dalian116001,China;2.ImmunologyI nstitute,Life Science and Biotechnology College of Dalian University,Dalian116622,China)
Objective To investigate the influence of FRAT1gene on the proliferation and apoptosis of human colon cancer cell line HT-29cells,and explore its underlying molecule mechanism.Methods Flow cytometry with Annexin V-FITC/PI double staining was employed to detect cell apoptosis,and the changes in the cell cycle and proliferation of the cells were examined with flow cytometry with PI staining and MTT colorimetric assay,respectively.β-catenin protein localization was detected by indirect immunofluorescence.Results FRAT1siRNA could restrain HT-29cell proliferation,increase G0/G1phase cell ratio,induce tumor cell apoptosis(P<0.01).The expression ofβ-catenin at the cytoplasm was down regulated and inhibit the translocation into nucleus,Conclusion FRAT1siRNA effectively inhibits the expression of HT-29cells,and suppresses cell growth and improves cell apoptosis by up regulating the expressions ofβcatenin.
Colon cancer;FRAT1;β-catenin;proliferation;apoptosis
R735.3+5
A
于庆功,男,主任医师,硕士,研究方向:消化道肿瘤及内镜治疗。
2013-02-08)
1007-4287(2014)02-0195-05
*通讯作者
