替米沙坦治疗糖尿病肾病过程中PPARγ的作用*
2014-05-15刘晏明罗华丽蒋先洪文津张剑彬
刘晏明,罗华丽,蒋先洪,文津,张剑彬
(重庆医科大学附属永川医院肾内科,永川 402160)
替米沙坦治疗糖尿病肾病过程中PPARγ的作用*
刘晏明,罗华丽,蒋先洪,文津,张剑彬
(重庆医科大学附属永川医院肾内科,永川 402160)
目的 进一步明确替米沙坦治疗糖尿病肾病的机制,探讨过氧化物酶体增殖物激活受体γ(PPARγ)通路在其中的作用。方法构建糖尿病肾病大鼠模型,将其随机分为空白对照组、替米沙坦组(5 mg·kg-1·d-1)、替米沙坦联合PPARγ抑制剂治疗组(替米沙坦5 mg·kg-1·d-1;GW9662 0.5 mg·kg-1·d-1),治疗12周后检测并比较3组SD大鼠的血、尿生化指标及肾脏质量,ELISA法检测并比较3组SD大鼠血液中白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的表达水平,比较分析各组肾脏组织病理变化。Western-blot或免疫组化法检测并比较3组SD大鼠肾脏组织HGF的表达,以及活化的NF-κB(p65)的水平。结果替米沙坦能够显著改善糖尿病肾病大鼠的血、尿生化指标,减轻肾脏质量,缩小肾小球体积,减轻系膜增生,减少炎性细胞浸润;明显降低血液中IL-1、IL-6、TNF-α表达水平,及肾脏组织中活化的NF-κB(p65)的水平,增加肾脏组织中HGF表达。但以上变化能被PPARγ抑制剂GW9662有效逆转。结论PPARγ相关通路活化可能在替米沙坦治疗糖尿病肾病中起重要作用。
替米沙坦;GW9662;过氧化物酶体增殖物激活受体γ;肾病,糖尿病
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的常见并发症,临床主要表现是蛋白尿。关于该病发生发展的机制研究日益透彻,其中,炎症反应被认为发挥了重要作用。过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptorγ,PPARγ)介导的下游分子活化是新近研究的热点,研究发现PPARγ与配体结合后可竞争性结合协同活化因子CBP及p300,从而使转录激活因子(signal transducers and activators of transcription,STAT)不能被有效活化,最终抑制由信号传导及STAT引起的炎症反应,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6 (interleukin-6,IL-6)等炎性因子的生成[1]。有报道证实,PPARγ激活后具有通过抑制炎症因子,减少氧化应激而保护肾脏的作用,因此被认为与DN的发生发展密切相关[2]。替米沙坦是一种新型的特异性血管紧张肽Ⅱ受体拮抗药,被广泛用于高血压及相关靶器官损伤的治疗中,包括DN的治疗,其可以明显改善患者的蛋白尿症状[3]。然而,在DN的治疗过程中,替米沙坦的作用机制尚未完全明确,PPARγ通路的激活在其中是否具有重要作用仍不清楚。
1 材料与方法
1.1 动物 健康8周龄斯泼累格·多雷(Sprague Dawley,SD)大鼠65只,普通级,雄性,体质量(190± 10)g,购买于重庆医科大学实验动物中心,动物合格证号:SCXY(渝)2012-004,实验动物生产许可证号: SYXK(渝)2012-006。
1.2 试剂 链脲佐菌素(streptozotocin,STZ)购自美国Sigma公司,批号:120301;检测IL-1、IL-6、TNF-α表达的酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒均购自Santa Cruz公司,批号依次为:sc-10798,sc-10635,sc-10029;肝细胞生长因子(hepatocyte growth factor,HGF)、NF-κB(p65)、组蛋白抗体均购自Abcam公司,批号依次为:ab21047, ab23218,ab20148;内参抗体购自Epitomics公司;总蛋白提取试剂、蛋白酶抑制剂、磷酸酶抑制剂均购自碧云天公司,批号依次为:P0033,P0132,P0237;蛋白浓度测定试剂盒购自Thermo Fisher公司,批号:PC0020。替米沙坦(苏州东瑞制药有限公司,批准文号:国药准字H20070149,批号:20130277);PPARγ抑制剂GW9662(Alexis公司,批准文号:国药准字cw201008,批号:nc208735)。
1.3 仪器 CX9型全自动生化分析仪(美国Beckman公司);XO-1200型超声裂解仪(江苏先欧科技公司); ST16R型冷冻离心机(Thermo公司);WD-9408C型电泳仪(北京六一仪器厂)。
1.4 动物模型构建 将健康雄性SD大鼠左肾切除,1周后开始构建DN大鼠模型,所有SD大鼠禁食10 h,单次腹腔注射链尿佐菌素(streptozotocin,STZ, 50 mg·kg-1),STZ用0.1 mol·L-1无菌柠檬酸缓冲溶液配制,72 h后取尾尖血测空腹血糖,以血糖值>16.65 mmol·L-1、连续3 d血糖稳定者为模型。结果成功建模62只,余3只建模失败。
1.5 动物分组与给药 选取成功建立DN的SD大鼠60只,将其随机分为3组。空白对照组:不予以任何治疗,仅予以0.9%氯化钠溶液灌胃;替米沙坦组:将替米沙坦溶于水中,按5 mg·kg-1·d-1剂量灌胃;替米沙坦联合PPARγ抑制剂GW9662组:将替米沙坦(5 mg·kg-1·d-1)联合PPARγ抑制剂GW9662 (0.5 mg·kg-1·d-1)溶于水后灌胃。治疗12周后处死并收集下腔静脉血及处死前24 h尿,留取右侧肾脏,称质量,部分肾组织以10%甲醛固定,其余组织置于-80℃冰箱中冻存。
1.6 蛋白提取 取少量肾脏组织碾磨成粉末状,过程中予以液氮降温,之后将其收集于干净EP管中,加入提前混有蛋白酶抑制剂与磷酸酶抑制剂的细胞裂解液,在冰上用超声裂解仪将组织裂解完全。在12 000×g条件下离心15 min,轻取上清液。用聚氰基丙烯酸正丁酯法测定蛋白液浓度,变性后于-30℃冰箱保存备用。
1.7 蛋白免疫印迹杂交(Western blot)检测 按既往常规操作进行,每孔蛋白上样量为40μg,SDS-PAGE法电泳分离,湿法转至PVDF膜,室温脱脂牛奶封闭2 h,一抗4℃孵育过夜,二抗室温孵育1 h,增强化学发光法显色,于暗室用胶片压片法显影,以GAPDH作为比对内参。
1.8 ELISA检测 IL-1、IL-6、TNF-α的检测严格按照试剂盒说明书操作。
1.9 免疫组化 按免疫组化试剂盒(北京中杉金桥生物技术有限公司)说明书操作,用苏木精复染,中性树胶封片。
2 结果
2.1 替米沙坦对SD大鼠血、尿生化指标及肾脏质量的影响 3组SD大鼠予以相应治疗12周后,分别检测血糖、血肌酐、尿蛋白,结果发现替米沙坦能显著降低SD大鼠血糖(F=20.812,P<0.01)、血肌酐(F= 219.534,P<0.01)及尿蛋白(F=39.357,P<0.01),均差异有统计学意义;处死大鼠观察肾脏外观发现,空白对照组大鼠肾脏体积较替米沙坦组大鼠明显增大,表面颗粒型感强,颜色较深红,前者肾质量/体质量高于后者,差异有统计学意义(F=147.568,P<0.01)。在联用PPARγ特异性抑制药GW9662的情况下,替米沙坦对糖尿病肾病的疗效有所减低。与单纯使用替米沙坦相比,联用GW9662的大鼠的血糖(F=21.237,P<0.01)、血肌酐(F=198.741,P<0.01)、尿蛋白(F= 35.132,P<0.01)均有所增高,但仍明显低于空白对照组的大鼠。这可能和替米沙坦也是血管紧张素受体Ⅱ特异性阻滞药相关。见表1。
2.2 3组SD大鼠肾脏病理切片结果 3组SD大鼠予以相应治疗12周后,光镜下比较肾脏组织苏木精-伊红(HE)染色切片发现,空白对照组大鼠肾组织可见部分肾小球体积明显增大,系膜明显增生,伴间质中性粒及单核淋巴细胞大量浸润(图1A)。替米沙坦组大鼠肾组织中肾小球体积较空白对照组有缩小,系膜增生不明显,炎性细胞浸润现象也得到缓解(图1B)。然而,替米沙坦联合PPARγ抑制药GW9662后肾小球体积又有增大趋势,系膜增生及炎性细胞浸润现象较替米沙坦组严重(图1C)。
2.3 PPARγ对糖尿病肾病中炎症递质表达的影响 前期动物模型实验已经证实替米沙坦具有改善DN症状的疗效,且在一定程度上依赖于PPARγ相关通路的活化,采用PPARγ抑制药GW9662可以明显减弱替米沙坦治疗DN的疗效,这初步表明PPARγ通路在替米沙坦治疗DN过程中起了介导作用。为进一步证实该观点,用ELISA法检测各组大鼠血液中IL-1、IL-6、TNF-α的表达水平。结果发现,替米沙坦能够显著降低DN大鼠体内IL-1[(316.37±11.45)pg·mL-1比(126.26± 4.79)pg·mL-1,F=4 688.536,P<0.01]、IL-6 [(110.93±5.72)pg·mL-1比(56.61±3.96)pg·mL-1,F=1 219.047,P<0.01]、TNF-α[(1 314.92±85.68) pg·mL-1比(381.30±50.49)pg·mL-1,F=1 762.796,P<0.01]的表达。与单用替米沙坦组相比,联用PPARγ抑制药GW9662后可使DN大鼠体内炎症因子IL-1 [(190.82±11.67)pg·mL-1比(126.26±4.79) pg·mL-1,F=523.289,P<0.01]、IL-6[(79.58±6.07) pg·mL-1比(56.61±3.96)pg·mL-1,F=201.137,P<0.01]、TNF-α[(789.32±50.21)pg·mL-1比(381.30± 50.49)pg·mL-1,F=656.662,P<0.01]表达上升,但仍明显低于空白对照组[IL-1:(190.82±11.67)pg·mL-1比(316.37±11.45)pg·mL-1,F=1 178.871,P<0.01; IL-6:(79.58±6.07)pg·mL-1比(110.93±5.72) pg·mL-1,F=282.607,P<0.01;TNF-α:(789.32± 50.21)pg·mL-1比(1 314.92±85.68)pg·mL-1,F= 560.254,P<0.01]。
2.4 PPARγ对HGF、NF-κB(p65)表达的影响 通过Western blot及免疫组化方法检测PPARγ下游关键分子HGF的表达,替米沙坦组大鼠肾脏组织的HGF表达量明显高于空白对照组(F=163.542,P<0.01), PPARγ抑制药GW9662能在一定程度上减弱替米沙坦促使HGF表达增加的效应,但不能将HGF表达量完全降至空白对照组的水平。NF-κB(p65)是重要的炎症促进因子,其激活所介导的IL-1、IL-6及TNF-α的产生在糖尿病肾病的发生发展中具有重要作用。结果显示糖尿病肾病大鼠接受替米沙坦治疗后,进入胞核内的NF-κB(p65)明显减少(F=24.983,P<0.01),联用PPARγ抑制药GW9662后,其进入胞核的量又有所增加(F=39.369,P<0.05),但仍明显低于空白对照组(F=78.158,P<0.05)。见图2~4。
表1 3组大鼠治疗后血、尿生化指标及肾脏体质量比值比较Tab.1 Comparison of biochem ical indexes of blood and urine,renal weight among three groups of rats after treatment ±s

表1 3组大鼠治疗后血、尿生化指标及肾脏体质量比值比较Tab.1 Comparison of biochem ical indexes of blood and urine,renal weight among three groups of rats after treatment ±s
与空白对照组比较,*1P<0.01;与替米沙坦组比较,*2P<0.01Compared with blank control group,*1P<0.01;compared with telmisartan group,*2P<0.01
组别血糖/ (mmol·L-1)血肌酐/ (μmol·L-1)尿蛋白/ (mg·L-1)肾脏体质量比/ (×10-3)空白对照组24.77±2.70 136.34±12.31 61.10±4.70 8.34±0.71替米沙坦组19.91±2.70 71.10±10.15 18.10±2.18 4.95±0.78替米沙坦联合GW9662组22.83±2.89*1*2103.51±11.57*1*235.35±4.97*1*26.36±0.67*1*2
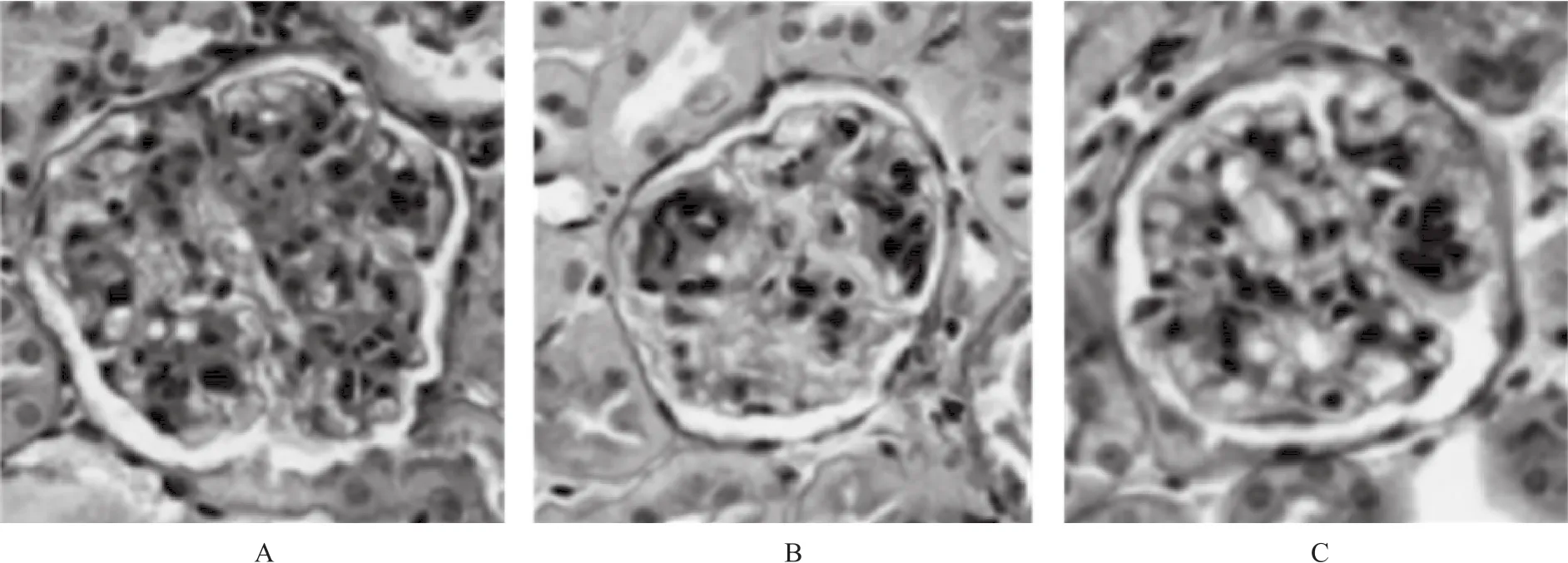
A.空白对照组;B.替米沙坦组;C.替米沙坦联合GW9662组图1 3组大鼠治疗后肾脏组织病理切片图(×400)A. blank control group;B. telmisartan group;C. combination of telmisartan and GW9662 groupFig.1 Pathology of renal tissue in three groups of rats after treatment(×400)
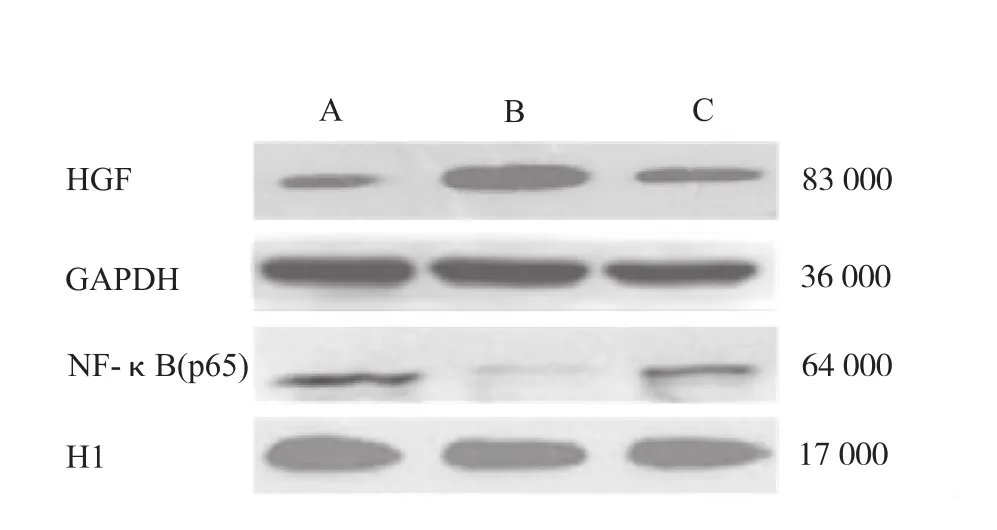
A.空白对照组;B.替米沙坦组;C.替米沙坦联合GW9662组图2 3组大鼠治疗后肾脏组织中HGF、活化NF-κB (p65)电泳图A. blank control group;B. telmisartan group;C. combination of telmisartan and GW9662 groupFig.2 Electrophotogram of HGF and activated NF-κB ( p65 ) of renal tissue among three groups of rats after treatment
3 讨论
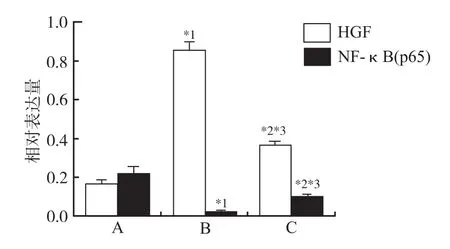
A.空白对照组;B.替米沙坦组;C.替米沙坦联合GW9662组;与空白对照组比较,*1P<0.01,*2P<0.05;与替米沙坦组比较,*3P<0.05图3 3组大鼠治疗后肾脏组织中HGF、活化NF-κB (p65)相对表达量比较A. control group; B. telmisartan group; C. combination of telmisartan and GW9662 group; compared with blank control group,*1P<0.01,*2P<0.05;compared with telmisartan group,*3P<0.05Fig.3 Comparison of relative expression of HGF and activated NF-κB (p65) of renal tissue among three groups of rats after treatment
DN的发病机制复杂,有研究认为其和糖尿病患者体内的高血糖状态有关,高血糖可以导致肾素血管紧张肽系统(renin angiotension system,RAS)活跃,血管紧张肽Ⅱ(AngiotensinⅡ,AngⅡ)与其受体结合效率明显增加,肾小球灌注压增高,肾小球微滤结构破坏,蛋白尿产生[4]。深入研究发现,肾小球微环境在高血糖的持续刺激下,NF-κB可被激活并大量转入细胞核内,从而调控下游多种分子表达,参与DN的发生发展[5]。此外,大量炎性递质在该环境下得以大量释放,包括IL-1、IL-6、TNF-α等,这些因子在细胞外基质增加的过程中均起重要作用。
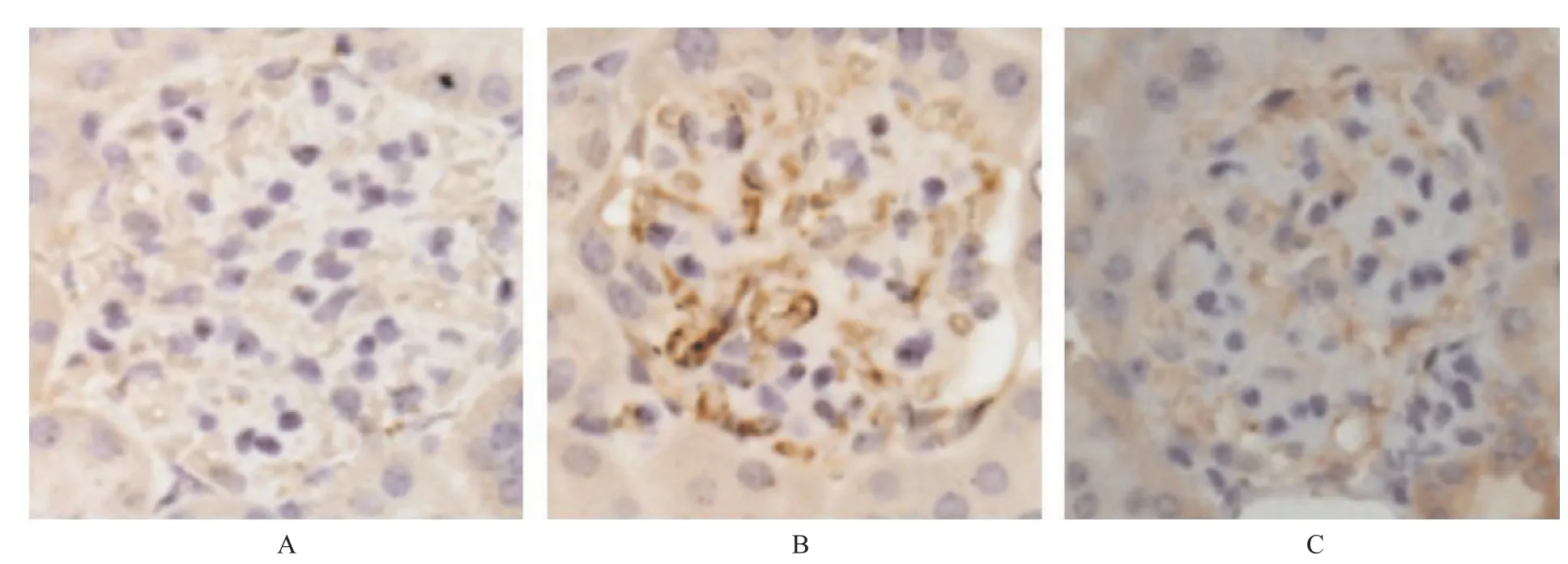
A.空白对照组;B.替米沙坦组;C.替米沙坦联合GW9662组图4 3组大鼠治疗后肾脏组织中HGF表达压片图(×400)A.blankcontrolgroup;B.telmisartangroup;C.combinationoftelmisartanandGW9662groupFig.4 PathologicalimagesofHGFinrenaltissueinthreegroupsofratsaftertreatment(×400)
与一般AngⅡ受体拮抗药相比,替米沙坦脂溶性更强,局部药物聚集浓度更高,发挥效应的时间更长,被广泛用于高血压及其并发症的治疗[6]。CAO等[7]认为替米沙坦通过阻断AngⅡ与其受体结合,缓解肾小球高滤过状态并降低灌注压,从而减轻患者蛋白尿状态。然而,在并发不同程度肾病的糖尿病患者中,替米沙坦被认为具有延缓肾病进展的作用,提示替米沙坦在治疗DN方面并不完全得益于其降血压的功效。有学者认为,替米沙坦、调控胰岛素敏感性的作用,能在一定程度上控制患者血糖,这为其治疗DN的疗效作出了解释。
PPARγ介导的下游信号活化是近年来研究的热点,被认为参与脂肪分化、糖脂代谢等多种生理反应中。PPARγ是核内的受体转录因子,被认为与过氧化物增殖应答原件结合,从而调控下游多个基因表达[8]。PPARγ激活后被认为与多种细胞因子的分泌相关,后者包括脂联素、抵抗素、IL-6、TNF-α、纤溶酶原激活物抑制剂-1、单核趋化蛋白-1及血管紧张素肽原等[9]。此外,PPARγ还参与了巨噬细胞功能的调控,从而抑制多种炎性因子的表达[10]。在高糖状态持续刺激下,肾小球处细胞发生表型转化,从而导致细胞及外基质增殖活跃,影响了肾小球的正常功能,采用PPARγ激动剂处理后,肾小球组织病理受损程度明显缓解。这说明PPARγ的活化在DN的治疗中具有重要作用[11-12]。
然而,替米沙坦是否在一定程度上通过激活PPARγ而治疗DN尚不清楚,深入研究替米沙坦治疗DN的机制具有重要意义,这通过应用PPARγ抑制药GW9662充分说明了这一问题。在DN大鼠模型中,联用GW9662后可以明显减弱替米沙坦的治疗疗效,初步证实了替米沙坦可能通过PPARγ的活化起到治疗DN的作用。分析各组大鼠肾脏组织病理形态发现,空白对照组可见肾小球体积明显增大,系膜明显增生,间质中性粒及单核淋巴细胞大量浸润,采用替米沙坦治疗后能明显缓解上述现象。然而,联用GW9662可减弱替米沙坦对肾脏组织的保护作用。进一步研究PPARγ下游信号分子HGF发现,替米沙坦能够显著促使HGF表达增加,HGF具有抗纤维化作用,可延缓DN的病变进展[13]。这表明替米沙坦能活化PPARγ/HGF通路,用PPARγ抑制药GW9662后HGF表达明显下调,则进一步证明了该观点。考虑到炎症反应在DN的发病中具有重要作用,比较了采用不同治疗手段治疗后的DN大鼠体内的重要炎症递质的表达,包括IL-1、IL-6、TNF-α及NF-κB(p65),均是接受PPARγ调控的下游炎症递质。结果发现替米沙坦能够显著降低IL-1、IL-6、TNF-α分泌水平,抑制NF-κB(p65)活化进入胞核,相反,GW9662可以有效逆转以上变化,也提示了PPARγ在替米沙坦治疗DN中的作用。
综上所述,通过动物模型、分子层面初步证实了PPARγ相关通路活化在替米沙坦治疗DN中的媒介作用,进一步明确了替米沙坦的药理机制。
[1] LI M,PASCUAL G,GLASS C K. Peroxisome proliferatoractivatedreceptor gamma-dependent repression of theinducible nitric oxide synthase gene[J]. Mol Cell Biol,2000,20(13):4699-4707.
[2] LAKSHMANAN A P,WATANABE K,THANDAVARAYANR A,et al. Telmisartan attenuates oxidative stress and renalfibrosis in streptozotocin induced diabetic mice with thealteration of angiotensin-( 1-7 ) mas receptor expressionassociated with its PPAR-gamma agonist action[J]. FreeRadic Res,2011,45(5):575-584.
[3] OTT IM,ALTER M L,VON WEBSKY K,et al.Effects of stimulation of soluble guanylate cyclase on diabetic nephropathy in diabetic eNOS knockout mice on top of angiotensinⅡreceptor blockade[J].PLoS One,2012,7 (8):e42623.
[4] 马旭,邵凤明.替米沙坦对糖尿病大鼠肾脏表达E-选择素的影响[J].中国老年学杂志,2013,22(6):1344-1346.
[5] LEE W C,CHEN H C,WANG C Y,et al.Cilostazol ameliorates nephropathy in type 1 diabetic rats involving improvement in oxidative stress and regulation of TGF-Beta and NF-kappaB[J].Biosci Biotechnol Biochem,2010,74 (7):1355-1361.
[6] 宫壮,李大林,朱向军,等.替米沙坦联合阿托伐他汀对早期糖尿病肾病微炎症状态的影响[J].江苏医药, 2013,17(12):1416-1419.
[7] CAO Z,COOPER M E.Efficacy of renin-angiotensin system (RAS)blockers on cardiovascular and renal outcomes in patients with type 2 diabetes[J].Acta Diabetol,2012,49 (4):243-254.
[8] SHARMA A M,STAELSB.Review:Peroxisome proliferatoractivated receptor gamma and adipose tissue——understanding obesity-related changes in regulation of lipid and glucosemetabolism[J].JClin Endocrinol Metab,2007, 92(2):386-395.
[9] DIGREGORIO G B,YAO-BORENGASSER A,RASOULI N,et al.Expression of CD68 and macrophage chemoattractant protein-1 genes in human adipose and muscle tissues:association with cytokine expression,insulin resistance,and reduction by pioglitazone[J].Diabetes, 2005,54(8):2305-2313.
[10] WEISBERG S P,MCCANN D,DESAIM,et al.Obesity is associated with macrophage accumulation in adipose tissue [J].JClin Invest,2003,112(12):1796-1808.
[11] BROEDERSN,ABRAMOWICZ D.Peroxisome proliferatoractivated receptors(PPARs):novel therapeutic targets in renal disease[J].Kidney Int,2002,61(1):354-355.
[12] YANG H C,DELEUZE S,ZUO Y,et al.The PPARgamma agonist pioglitazone ameliorates aging-related progressive renal injury[J].JAm Soc Nephrol,2009,20(11):2380-2388.
[13] LI Y,WEN X,SPATARO B C,et al.hepatocyte growth factor is a downstream effector thatmediates the antifibrotic action of peroxisome proliferator-activated receptor-gamma agonists[J].JAm Soc Nephrol,2006,17(1):54-65.
DOI 10.3870/yydb.2014.12.004
Role of PPARγin Treatment of Diabetic Nephropathy by Telmisartan
LIU Yan-ming,LUO Hua-li,JIANG Xian-hong,WEN jin,ZHANG Jian-bin
(Department of Nephrology, Yongchuan Hospital ofChongqing Medical University,Yongchuan 402160,China)
Objective To demonstrate themechanisms underlying the efficacy of telmisartan in diabetic nephropathy, and discuss the role of PPARγin this process.MethodsThe diabetic nephropathy ratmodels were established and random ly assigned to control group,telmisartan group(5 mg·kg-1·d-1)and combination of telmisartan and PPARγinhibitor group (telmisartan:5 mg·kg-1·d-1;GW9662:0.5 mg·kg-1·d-1).After 12 weeks of treatment,the biochemical indexes of blood and urine,kidney weight,renal pathology in each group of diabetic nephropathy rats weremeasured and compared.The levels of IL-1,IL-6 and TNF-αin blood of each group were detected by ELISA and compared.The levels of HGF and activated NF-κB (p65)in renal tissue of each group were detected by Western blotting and compared.ResultsIn diabetic nephropathy rats, telmisartan lowered the levels of serum glucose,serum creatinine,urinary protein and kidney weight,decreased the glomerular volume,mesangial proliferation and inflammatory cell infiltration,reduced blood levels of IL-1,IL-6,and TNF-α,and decreased level of activated NF-κB(p65)in renal tissue.The level of HGF in renal tissue was elevated by telmisartan.Nevertheless,these changeswere partly reversed by PPARγinhibitor GW9662.ConclusionPPARγpresents an important role in treatment of diabetic nephropathy by telmisartan.
Telmisartan;GW9662;Peroxisome proliferator-activated receptorγ;Nephropathy,diabetic
R972.4;R587.1
A
1004-0781(2014)12-1553-06
2013-10-07
2014-03-20
*重庆市永川区科委课题(YCSTC, 2013NC8012);重庆医科大学附属永川医院院内课题(YJQN20120015,YJYJ201308)
作者介绍 刘晏明(1986-),男,重庆人,助理工程师,学士,研究方向:肾病内科。电话:023-85381678,E-mail: cd202020@163.com。
罗华丽(1972-),女,重庆人,主管护师,学士,研究方向:肾病内科。电话:023-85381678,E-mail:326704360 @qq.com。
