硝苯地平缓释微丸片的制备与体外释放度考察
2014-05-15张怡袁中文关世侠李庆国周祥萍
张怡,袁中文,关世侠,李庆国,周祥萍
(1.广州中医药大学中药学院,广州 510006;2.澳门科技大学中药质量研究国家重点实验室,中国澳门)
硝苯地平缓释微丸片的制备与体外释放度考察
张怡1,袁中文2,关世侠1,李庆国1,周祥萍1
(1.广州中医药大学中药学院,广州 510006;2.澳门科技大学中药质量研究国家重点实验室,中国澳门)
目的 制备硝苯地平缓释微丸片及其体外释放度考察。方法首先筛选载体的种类和用量,确定以新型辅料Soluplus作为载体材料(硝苯地平∶Soluplus=1∶1),用热熔融挤出法制备硝苯地平固体分散体,采用差式扫描量热法对其进行验证;用挤出-滚圆法制备含药微丸,并以Eudragit®RS 30D为包衣材料制备缓释微丸,再将缓释微丸压制成片剂。结果体外释放度表明,所制备的硝苯地平缓释微丸片在24 h内释药平稳且完全,释药规律符合一级释放模型。结论该法制备的硝苯地平缓释微丸片,载药量高,工艺简便,易于操作。
硝苯地平;热熔融挤出法;挤出-滚圆法;微丸片;释放度,体外
硝苯地平(nifedipine,NF)属于二氢吡啶类钙拮抗药,对高血压、心绞痛具有良好的预防和治疗作用。硝苯地平在水中的溶解度只有17μg·m L-1,制约着其生物利用度。且硝苯地平半衰期短,极易引起血压的较大波动,并能反射性增加心率,因此开发硝苯地平的缓控释制剂尤为重要。利用热熔融挤出技术(hotmelt extrusion technology,HME)制备硝苯地平固体分散体能有效提高的硝苯地平的溶解度,2009年德国BASF公司研发了适用于热熔融挤出技术的新型水溶性载体材料Soluplus,具有较低的玻璃化温度,能避免高温挤出时所致的药物分解。以Soluplus作为载体制备硝苯地平固体分散体的研究尚未见诸于报道[1-2]。目前国内外上市的硝苯地平缓、控释制剂均是单剂量由一个给药单元构成,这种剂型的缺点在于偶然制备失误可能会造成严重的不良反应,而且制剂不可分割,难以及时调整给药方案[3]。剂量分散型的微丸剂,服用后易于在胃肠道均匀分散,因而有较高的生物利用度,缓释微丸的释药规律尚具有较好的重复性,将微丸压制成片后,还易于分剂量,能提高给药方案的灵活性。笔者在本研究首先制备水溶性强的硝苯地平固体分散体,再采用挤出-滚丸法制备含药素丸,然后通过包衣手段制备出释药稳定的硝苯地平缓释微丸,最后压制微丸片,并初步考察制剂的处方因素及体外释放行为。
1 仪器与试药
1.1 仪器 RCZ-8A智能药物溶出仪(天津大学精密仪器厂);756MC紫外-可见分光光度仪(上海精密科学仪器有限公司分析仪器总厂);LC-10A高效液相色谱仪(LC-10AT泵,SPD-10A检测器,日本岛津株式会社);浙江大学N2000色谱工作站(浙江大学智能信息工程研究所);CTE-20双螺杆挤出机(德国CoperionKeya南京器械有限公司);JBZ-200型多功能微丸包衣造粒机(辽宁医联新药研究所);ATS高压均质机(ATS工业系统有限公司);DSC-60差式扫描量热分析仪(日本岛津公司)。
1.2 试药 硝苯地平(陕西西岳制药有限公司,批号:0907011);Soluplus(德国BASF公司);泊洛沙姆188(德国BASF公司,批号:WPYH570B);共聚维酮PVP/VA64(德国BASF公司,批号:76809916K0);聚乙二醇6000(PEG6000,天津市大茂化学试剂厂,批号:20120710);聚乙二醇400(PEG400,天津市大茂化学试剂厂,批号:20110923);微晶纤维素(microcrystalline cellulose,MCC,日本旭化成株式会社,批号:PH101);Eudragit®RS 30D(德国Degussa公司,批号:G120518503);柠檬酸三乙酯(triethyl citrate, TEC,广州大漠化工有限公司,批号:XA-221);单硬脂酸甘油酯[glycerylmonostearate,GSM,阿拉丁试剂(上海)有限公司,批号:J1210043];乳糖(天津市大茂化学试剂厂,批号:20110710);羟丙甲纤维素(hypromellose,HPMC,K4M,上海卡乐康包衣技术有限公司,批号:IN523613;HPMC E15,上海卡乐康包衣技术有限公司,批号:F0542492);低取代羟丙纤维素(low-substituted hydroxypropylcellulose,L-HPC,日本信越化学工业株式会社,批号:1101356)。
2 方法与结果
2.1 测定方法的建立
2.1.1 色谱条件 色谱柱:Agilent C18色谱柱(250 mm×4.6 mm,5μm);检测波长:239 nm;流动相:甲醇-水(70∶30);流速:1.0 m L·min-1;柱温:室温;进样量:20μL。硝苯地平主药峰分离度>1.5,理论板数按硝苯地平计算应>3 000[4]。
2.1.2 标准曲线的绘制 取硝苯地平对照品适量,以无水乙醇溶解并定容,作为储备液。精密量取硝苯地平储备液适量,用0.25%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液稀释成浓度分别为1,2,5, 10,20,30,50μg·mL-1的系列溶液(3份)。分别取各浓度供试液20μL注入高效液相色谱仪中,记录色谱图。以硝苯地平的峰面积(A)对质量浓度(C)进行线性回归,得回归方程为A=73.611C+22.835,R2= 0.999 9);线性范围1~50μg·mL-1。
2.1.3 体外释放度的测定 依照《中华人民共和国药典》2010年版二部附录ⅩD,按桨法测定。取相当于硝苯地平20 mg的固体分散体(微丸/微丸片)作为供试品。以0.25%SDS溶液作为释放介质,温度37℃,转速100 r·min-1,分别于0,10,20,30,40,50,60 min收集溶出液5 mL,立即过孔径0.22μm滤膜,收集续滤液,并及时补加溶出介质5 m L。照“2.1.1”项条件测定药物浓度,计算不同时间点药物的累积释放度。
2.1.4 差式扫描量热分析 取硝苯地平固体分散体、硝苯地平、硝苯地平与载体的物理混合物[称取适量硝苯地平和载体并混合均匀,过内径(180.0±7.6)μm (80目)筛,得到物理混合物]各约10 mg,置于铝盘中,以空铝盘为参比物,在干燥空气流中升温至设定值,升温速度:5℃·min-1;扫描范围:30~250℃。根据谱图判断药物在载体中的分散程度。
2.2 硝苯地平固体分散体的制备
2.2.1 热熔融挤出技术制备硝苯地平固体分散体的工艺 称取适量硝苯地平和载体,混合均匀。根据载体的性质,分别设定熔融挤出机一区、二区、三区、四区的温度,待温度升至设定值且稳定后,将药物与载体的混合物投入加料斗中,调节螺杆转速,收集挤出物并置于干燥器中冷却、干燥,粉碎过内径(180.0±7.6)μm (80目)筛,备用。
2.2.2 载体种类的筛选 分别以Soluplus、PEG6000、共聚维酮PVP/VA64(PVP VA64)、泊洛沙姆188为载体材料,设定硝苯地平-载体比例为1∶3,按“2.2.1”项下方法制备固体分散体,按“2.1.3”项下方法测定其溶出度。结果见图1。由结果可知,Soluplus、泊洛沙姆188、PVPVA64、PEG6000均能提高硝苯地平溶出度。尤以Soluplus作用最为显著,在10min时硝苯地平即可溶出100%。因此选择Soluplus作为硝苯地平的载体。
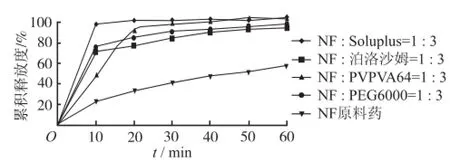
图1 不同载体制得固体分散体的累积释放度Fig.1 Cumulative release rate of solid dispersion prepared by using different carriers
2.2.3 载体用量的考察 以Soluplus为载体,设定硝苯地平-Soluplus比例分别为1∶1,1∶3,1∶5,分别制备物理混合物和固体分散体。按“2.1.3”项下方法测定释放度,按“2.1.4”项下方法进行差式扫描量热分析。结果发现,物理混合物在60 min时只能溶出约60%,载体比例对药物溶出几乎无影响。而固体分散体在60 min内累积释放度均达到100%,且溶出速率随载体比例增高而加快。但载体比例越高,会影响后期所制备微丸的载药量,因此,确定硝苯地平∶Soluplus=1∶1。由差式扫描量热分析谱图可见,硝苯地平在174℃的吸热峰仅存在于物理混合物中,在硝苯地平-Soluplus的固体分散体中只有Soluplus的吸热峰。初步表明硝苯地平与Soluplus间发生相互作用,药物可能以分子或无定型状态存在。
2.3 硝苯地平缓释微丸的制备
2.3.1 硝苯地平含药微丸的制备 称取处方量的MCC和硝苯地平-Soluplus(1∶1)固体分散体等辅料,以纯化水作为润湿剂制软材。按挤出速度26 r·min-1,滚圆速度420 r·min-1,滚圆时间4 min,制备载药量为15%的硝苯地平微丸。所制备微丸在50℃干燥10 h。取直径0.600~1.180 mm(16~30目)之间的微丸备用,微丸收率约为80.7%。
2.3.2 缓释微丸的制备 取处方量丙烯酸树脂Eudragit®RS 30D用适量纯化水稀释并搅匀;另取70℃纯化水适量,加入处方量的TEC和聚山梨酯-80,搅拌后用高压均质机匀化1次,再向上述乳状液中加入处方量GSM,高压均质2次。临用前将GSM混悬液与尤特奇水分散体混合均匀,过内径(180.0± 7.6)μm(80目)筛备用。取适量硝苯地平微丸置于微丸包衣造粒机内,使用上述包衣液,按转速280 r·min-1,供液速度1.5 m L·min-1,雾化压力0.6 MPa,鼓风温度37℃的工艺参数,进行连续包衣操作,直至达到增重要求。然后将微丸与质量分数为0.2%微粉硅胶均匀混合,置于40℃烘箱中干燥12 h。并按“2.1.3”项下操作测定药物释放度。
2.4 影响缓释微丸释放因素的考察
2.4.1 包衣增重的考察 配制聚合物浓度为10%的Eudragit®RS 30D包衣液,对同一批微丸进行包衣,包衣增重分别为15%,20%,25%,30%。再按“2.1.3”项下操作测定药物释放度。结果见图2。结果显示, 15%和20%的增质量时,药物释放过快;30%增质量时,药物有20%左右释放不完全;25%增重量时,药物释放平稳但也有约10%释放不完全。据此,本实验采用25%的包衣增质量,拟通过加入致孔剂来调节制剂的释药行为,以达到预期的缓释效果。
2.4.2 包衣液聚合物浓度的考察 配制Eudragit®RS 30D包衣液,使聚合物的浓度分别为5%,10%,15%,对同一批微丸进行包衣至增重均为25%。按“2.1.3”项下操作测定药物释放度。结果显示,包衣液中聚合物浓度对药物的释放行为几乎无影响。但随聚合物浓度的增大,在包衣过程中会出现微丸黏连现象。在10%的聚合物浓度时,包衣操作最顺利且时耗短。
2.4.3 致孔剂种类的考察 配制聚合物浓度为10%的Eudragit®RS 30D包衣液,向包衣液中分别加入PEG6000、PEG400、乳糖、HPMC E15作为致孔剂,致孔剂用量为聚合物质量的3%。对同一批微丸进行包衣至增重25%。按“2.1.4”项下操作测定药物释放度。结果见图3。结果显示,PEG6000、PEG400、HPMC E15作为致孔剂,会有突释现象发生,而用乳糖作为致孔剂时,释药平稳,因此选择乳糖作为致孔剂。
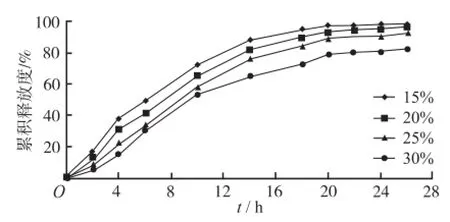
图2 Eudragit®RS 30D不同包衣增重制得缓释微丸中硝苯地平的体外释放度曲线Fig.2 In vitro release curves of NF from sustainedrelease pellets coated with different pore-form ing agent
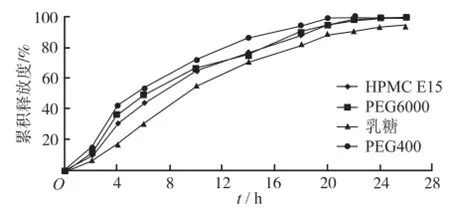
图3 不同致孔剂制得缓释微丸中硝苯地平的体外释放度曲线Fig.3 In vitro release p r of ile of NF from sustainedrelease pellects coated with different pore-form ing agent
2.4.4 致孔剂用量的考察 配制聚合物浓度为10%的Eudragit®RS 30D包衣液,使乳糖含量相对于聚合物质量为5%,7%,9%的包衣液,对同一批微丸进行包衣至增重25%,然后按“2.1.4”项下操作测定药物释放度。结果见图4。由结果可知,乳糖用量为5%时,微丸释药平稳且完全。因此确定致孔剂乳糖的用量为聚合物质量的5%。
2.5 硝苯地平缓释微丸片的制备 取MCC、HPMC K4M、L-HPC、微粉硅胶以及硝苯地平缓释微丸适量,用旋转式压片机干粉压片。根据预实验结果,确定压片工艺为:充填深度16.8 mm;预压厚度6.2 mm;片剂厚度3.5 mm。所得微丸片直径12 mm,每片质量0.45 g。微丸片的释药曲线见图5。
2.6 微丸片释放机制的研究 药物释放度曲线主要有4种拟合模型[5],Higuchi方程:Y=a3+b3t1/2;Ritgerpeppas方程:logY=a4+b4logt;零级释放模型:Y=a1+b1t;一级释放模型:ln(100-Y)=-a2+b2t。在上述方程中,Y均为药物的累计释放量,t均为取样时间,a1~a4为常数,b1~b4为释药常数。用硝苯地平缓释微丸片在0.25%的SDS溶液中的释放度数据进行释药机制拟合,结果Higuchi方程、Ritger-peppas方程、零级释放模型和一级释放模型的相关系数(R2)分别为0.935 7, 0.972 8,0.921 6,0.986 4。由结果可见,硝苯地平缓释微丸片的释药机制符合一级释放模型,释药方程为: ln(100-Y)=4.703 2-0.101 9t,R2=0.986 4。
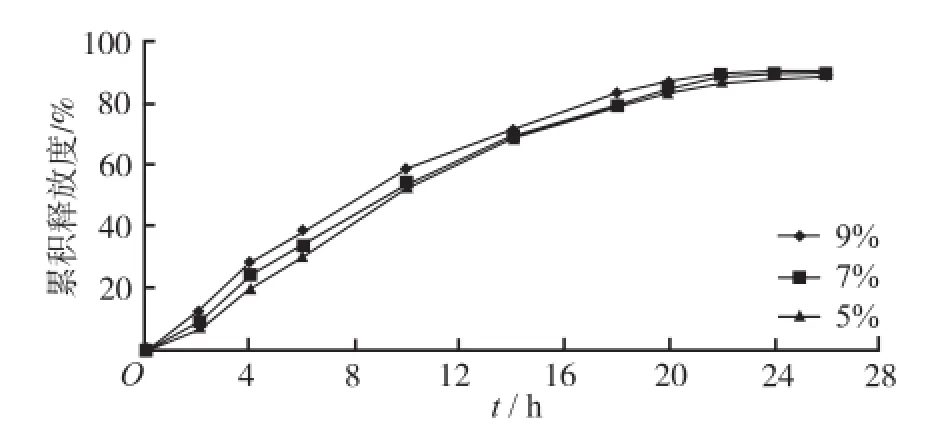
图4 不同乳糖用量制得缓释微丸中硝苯地平的体外释放度曲线Fig.4 In vitro release pr of ile of NF from sustainedrelease pellects coated with different amount of lactose
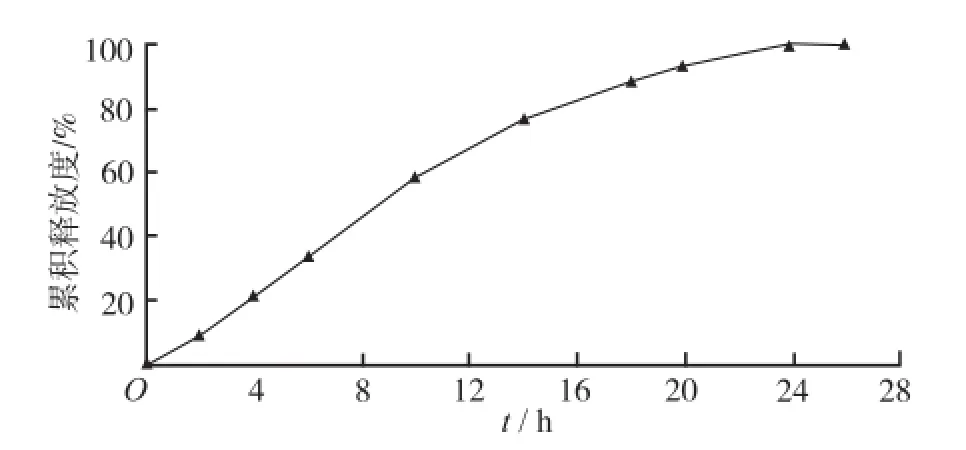
图5 缓释微丸片中硝苯地平的体外释放度曲线Fig.5 In vitro release pr of ile of NF from sustainedrelease tablets
3 讨论
在制备固体分散体时,HME技术与熔融法有相似之处,但HME技术实现了混合、剪切以及挤压的协同作用,使药物能更加均匀、紧密地分散在载体中,从而更大地提高药物的溶出度[6]。
Soluplus是制备固体分散体的新型载体材料,是聚乙烯己内酰胺、聚乙酸乙烯酯、聚乙二醇共聚物。其玻璃化转变温度仅为70℃,挤压性、流动性好,特别适合热熔融挤出操作。大多数固体分散体的载体材料吸水后黏度较高,若载体用量亦偏大,则严重制约药物剂型的选择。在本实验中,Soluplus对硝苯地平的增溶作用优于其他载体,且药物与载体的比例仅为1∶1,为制剂成型提供很大的辅料空间,尤其突破固体分散体难以制备微丸剂的障碍。
Eudragit®RS 30D渗透性较低,在水中只能形成0.1~0.6μm的孔径,具有良好的限制药物释放的作用。但单纯用Eudragit®RS 30D包衣时,可能会在释药末期出现药物释放不完全的现象。所以通常在包衣材料中加入PEG、乳糖等水溶性好的物质作为致孔剂,通过调节致孔剂的用量来调控制剂的释放行为[7]。
缓释微丸制剂的释药行为是组成一个剂量的、若干个缓释微丸的释药行为的总和,可避免出现由于个别微丸的制备失误,而对整个制剂的释药行为产生严重影响的情况,其释药规律具有很好的重复性和稳定性[8],同时,缓释微丸还具有微丸作为剂量分散型剂型,易于在胃肠道均匀分散,局部刺激性小,生物利用度高等共性优点。
微丸压片后最显著的优势是剂量可分割,且分割后仍能保持多单元的缓控释能力,能为临床提供更为灵活的用药方案。该剂型既能保证制剂在体内平稳的释药,又可以提高临床用药的安全性,优化给药方案,必将成为药剂学研究的热点。
[1] 王新刚,李全胜,蔡悠悠,等.硝苯地平缓释片临床前药动学及生物利用度研究[J].药物评价研究,2013,36(3): 161-165.
[2] YE L L,JIANG G Q,CHEN J,et al.Preparation andin vitrorelease of oral osmotic pump system with single room and layer nifedipine as themodel drug[J].Fine Chem,2002,19 (11):628-647.
[3] 李永林,贡联兵.国产硝苯地平控释片的临床应用评价[J].中国医院用药评价与分析,2013,13(3):195-197.
[4] 王芳,李艳丽,郑文,等.硝苯地平探针高效液相色谱法测定大鼠肝微粒体CYP3A酶活性[J].烟台大学学报:自然科学与工程版,2013,26(2):119-122.
[5] JUDIT D,ISTVAN A.Evaluation of mathematical models describing durg release from lipophilic matrices[J].Int J Pharm,1996,145(1):61-64.
[6] 陈美婉,陈文荣,陈桐楷,等.热熔挤出技术制备固体分散体的应用研究[J].药学学报,2012,47(2):163-167.
[7] 佟杰,王东凯.罗红霉素包衣缓释微丸的体外释放研究[J].中国药剂学杂志,2005,3(1):1-8.
[8] 陆斌.药物制剂新剂型与新技术[M].2版.北京:人民卫生出版社,2005:448.
DOI 10.3870/yydb.2014.06.028
Preparation of Nifedipine Sustained-Release Pellet Tablets and Study of Its Release Behavior in vitro
ZHANG Yi1,YUAN Zhong-wen2,GUAN Shi-xia1,LI Qing-guo1,ZHOU Xiang-ping1
(1.College of Chinese Pharmacy,Guangzhou University of ChineseMedicine,Guangzhou 510006,China;2.Macau University of Science and Technology,State Key Laboratory of Quality Research in Chinese Medicines,Macau,China)
ObjectiveTo prepare nifedipine(NF)sustained-release pellet tablets,and study of its release behaviorin vitro.MethodsSoluplus was selected as a carrier to prepare solid dispersion of NF by hotmelt extrusion technique(HME), and the ratio of the drug to carrier was 1∶1.The samples were validated as the solid dispersion by differential scanning calorimetry(DSC).Extrusion-spheronization technique was introduced to prepare NF pellets and Eudragit®RS 30D was used as the coatingmaterial.The NF sustained-release tablets were prepared by direct compression of the coated pellets and suitable excipients.ResultsThe release data in vitro proved that the drug release from the tablets was steady and complete over 24 hours.ConclusionThe release of NF from sustained-release tablets is slow and steady.Themethod is easy to operate.Thein vitrodrug release pattern follows first-order kinetics.
Nifedipine;Hotmelt extrusion technique;Extrusion-spheronization technique;Pellet tablets;Release,in vitro
R972.4;TQ460.6
A
1004-0781(2014)06-0790-04
2013-10-11
2013-12-02
张怡(1989-),女,广东广州人,硕士,研究方向:主要从事药物制剂新技术研究。电话:020-39358312,E-mail:jane8393@163.com。
关世侠(1965-),男,辽宁沈阳人,教授,博士,研究方向:主要从事新型给药系统研究。电话:020-39356872, E-mail:drguan@163.net。
