丹参胶囊质量标准研究*
2014-05-15程月发蓝建芳任新平张珺谢跃生
程月发,蓝建芳,任新平,张珺,谢跃生
(1.河北联合大学冀唐学院,唐山 063300;2.海南赛立克药业有限公司,海口 571124)
丹参胶囊质量标准研究*
程月发1,蓝建芳2,任新平2,张珺1,谢跃生1
(1.河北联合大学冀唐学院,唐山 063300;2.海南赛立克药业有限公司,海口 571124)
目的 建立丹参胶囊的质量标准。方法参照《中华人民共和国药典》丹参药材的质量标准,分别采用荧光反应、薄层色谱(TLC)鉴别法对丹参胶囊内容物进行丹参酮ⅡA定性鉴别;采用高效液相色谱(HPLC)法进行丹参酮ⅡA、隐丹参酮、丹酚酸B、丹参素和原儿茶醛5种主要成分的含量测定。结果丹参酮ⅡA的TLC鉴别分离度好,专属性强。HPLC检测的浓度范围:丹参酮ⅡA在2.046~40.92μg·mL-1、隐丹参酮在1.482 25~59.29μg·mL-1、丹酚酸B在1.502 55~60.102μg·mL-1、丹参素在11.49~459.582μg·mL-1、原儿茶醛在0.617 4~24.696μg·mL-1分别具有良好的线性关系,相关系数r均为0.999 9,平均加样回收率分别为99.66%(RSD=0.91%),99.26%(RSD=0.88%), 99.09%(RSD=0.76%),100.51%(RSD=0.62%)和100.62%(RSD=0.82%)。3批号丹参胶囊中,除原儿茶醛检出量较低外,其余4种成分均有一定的含量。结论建立的鉴别、检查与含量测定方法,简便、准确,重复性好,可用于丹参胶囊的质量控制。
丹参胶囊;质量标准;活性成分;色谱法,高效液相;色谱法,薄层
丹参胶囊是单味丹参药材通过醇提和水提工艺制得的胶囊制剂,功能为活血化瘀,主要用于治疗冠心病、心绞痛等疾病。经醇提的成分主要为丹参酮ⅡA和隐丹参酮等二萜醌类化合物,经水提的成分主要为丹酚酸B、丹参素和原儿茶醛等酚酸类化合物。为保证丹参胶囊产品有效成分的稳定性和可靠性,建立简便易行的鉴别、测定方法和控制标准,笔者对丹参胶囊进行了质量标准的规范研究,现报道如下。
1 仪器与试药
1.1 仪器 Agilent1260型高效液相色谱仪、可变波长扫描紫外检测器和Agilent Chemstation色谱工作站(均为美国Agilent公司);BP211D型电子天平(德国Sartorius);SK5200H超声波清洗器(上海科导超声仪器有限公司,频率53 kHz,功率200 W)。
1.2 药品与试药 丹参胶囊(批号:110401,110701, 110901,供鉴别及检查实验,120901,120902,120903,供含量测定实验,规格:每粒0.28 g)由海南赛立克药业有限公司提供,空白对照胶囊制备除丹参提取物外,按处方量称取辅料,混匀即得。甲醇、乙腈为色谱纯;重蒸水(自制);其他试剂均为国产分析纯。
1.3 对照品 丹参对照药材(批号:120923-200509)、丹参酮ⅡA对照品(批号:110766-200619)、丹酚酸B对照品(批号:111562-201212),均购于中国食品药品检定研究院;隐丹参酮(批号:GZDD-0096-201112)、丹参素钠对照品(批号:0071-201102)、原儿茶醛对照品(批号:GZDD-0806-201201)均购自贵州迪大生物有限公司,纯度≥98%(实验中计算按纯度98%执行)。
2 方法与结果
2.1 鉴别
2.1.1 荧光反应 取本品1粒的内容物,研细,加乙醇5 m L,充分搅拌,滤过,取滤液数滴,滴在滤纸上,干燥后,置紫外光灯(365 nm)下观察,显蓝色荧光;将滤纸条置氨蒸气中熏20 min,取出,置紫外光灯(365 nm)下观察,显淡亮蓝绿色荧光。另取空白胶囊内容物,按供试品的荧光鉴别实验进行阴性对照实验。对3批次的供试品进行检查,3批供试品均呈现相应的荧光反应;空白胶囊均未呈现荧光反应。
2.1.2 薄层色谱 取3批胶囊各10粒的内容物,研细,混匀,加乙醚20 mL,置具塞试管中,放置1 h,滤过,滤液挥干,残渣加乙酸乙酯1mL使溶解,作为供试品溶液。另取丹参对照药材1 g,同法制成对照药材溶液。取丹参酮ⅡA对照品,加乙酸乙酯制成浓度2 mg·mL-1,作为对照品溶液。吸取上述3种溶液各5μL,分别点于同一硅胶G薄层板上,以环己烷-乙酸乙酯(6∶1)为展开剂,展开,取出,晾干。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点;在与对照品色谱相应的位置上,显相同的暗红色斑点。
2.2 检查
2.2.1 一般项目 胶囊剂的水分、装量差异、崩解时限、重金属、微生物限度检查按《中华人民共和国药典》2010年版一部附录[1]进行,均符合标准。
2.2.2 砷盐 取3批样品,按《中华人民共和国药典》2010年版(一部)附录ⅦJ第一法进行测定。结果表明,砷在样品中含量均<1 ppm。
2.3 含量测定 丹参酮ⅡA、丹酚酸B遵照《中华人民共和国药典》2010年版(一部)中规定的方法[1];丹参素按照《中华人民共和国药典》2005年版一部中规定的方法[2];原儿茶醛按照国家药品标准《WS-10149 (ZD-0149)-2002丹参颗粒》中规定的方法;隐丹参酮参照有关文献办法,分别进行含量测定[3]。
2.3.1 溶液制备
2.3.1.1 对照品溶液的制备 分别按照文献办法制备丹参酮ⅡA含量为16μg·mL-1、隐丹参酮和丹酚酸B含量各为10μg·mL-1、丹参素钠含量为100μg·mL-1(相当于丹参素90μg·mL-1)和原儿茶醛含量为5μg·mL-1的对照品溶液。
2.3.1.2 供试品溶液的制备 取10粒丹参胶囊内容物,精密称定、研细、混匀,取约0.3 g,精密称定,置磨口锥形瓶中,精密加入甲醇50 mL,塞紧,称定质量,加热回流1 h,放冷后,密塞,称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得丹参酮ⅡA供试品溶液提取液。取本品内容物约0.35 g,精密称定,置50 mL量瓶中,加入流动相约35 mL,超声处理15 min,放冷,再用流动相稀释至刻度,摇匀,过滤,取续滤液,即得隐丹参酮供试品溶液。取本品内容物约0.2 g,精密称定,置50 mL量瓶中,加水适量,超声处理20 min,放冷,加水至刻度,摇匀,滤过,精密量取续滤液1 m L,置25 mL量瓶中,加水至刻度,摇匀,即得丹酚酸B供试品溶液。取本品内容物约0.45 g,精密称定,置25 mL量瓶中,加流动相约15 mL,超声处理15 min,放冷,加流动相至刻度,摇匀,2 000 r·min-1离心5 min,取上清液,即得丹参素供试品溶液。取本品内容物约1.3 g,精密称定,置50 m L量瓶中,加入流动相约35 mL,超声处理15 min,放冷,加流动相稀释至刻度,摇匀,滤过,取续滤液,即得原儿茶醛供试品溶液。
2.3.1.3 阴性对照品溶液制备 如上法分别取空白胶囊内容物约0.5 g,分别精密称定,按法分别制备5种待测成分的阴性对照品溶液。
2.3.2 色谱条件与系统适用性实验
2.3.2.1 色谱条件 色谱柱为ZORBAX SB-C18stableBond Analytical(250 mm×4.6 mm,5μm);柱温: 35℃。丹参酮ⅡA测定以甲醇-水(75∶25)为流动相;检测波长:270 nm,理论板数按丹参酮ⅡA峰计算应不低于2 000。隐丹参酮测定以乙腈-水(80∶20)为流动相;检测波长:263 nm,理论板数按隐丹参酮峰计算应不低于2 000。丹酚酸B测定以甲醇-乙腈-冰醋酸-水(30∶10∶1∶59)为流动相;检测波长:286 nm,理论板数按丹酚酸B峰计算应不低于4 000。丹参素测定以0.5%冰醋酸-甲醇(88∶12)为流动相,检测波长:280 nm;理论板数按丹参素峰计算应不低于2 000。原儿茶醛测定以0.5%冰醋酸-甲醇(88∶12)为流动相,检测波长:280 nm;理论板数按原儿茶醛峰计算应不低于6 000。以上进样量均为20μL,流速均为1 mL·min-1。
2.3.2.2 系统适用性实验 在上述各自色谱条件下,分别精密吸取5种成分的对照品、供试品和阴性对照品溶液各20μL注入液相色谱仪,记录图谱。实验结果表明供试品的色谱图中,分别有一个色谱峰与对照品色谱峰的相对保留时间一致,阴性对照品在与对照品相同保留时间位置上,色谱图中没有出现丹参酮ⅡA、隐丹参酮、丹酚酸B、丹参素和原儿茶醛的吸收峰。结果理论板数、分离度和拖尾因子均符合要求,在各自色谱条件下,样品得到良好分离。
2.3.3 线性关系考察 分别配制质量浓度丹参酮ⅡA为204.6μg·mL-1、隐丹参酮为59.29μg·mL-1L、丹酚酸B为60.102μg·mL-1、丹参素为459.582 3μg·mL-1和原尔茶醛为123.48μg·mL-1的对照品贮备液,然后再用各自溶剂稀释成不同质量浓度的的测试液,进样测定,记录色谱峰面积。分别以峰面积(Y)对照品质量浓度(X,μg·mL-1)绘制标准曲线,进行线性回归,得回归方程。结果见表1。
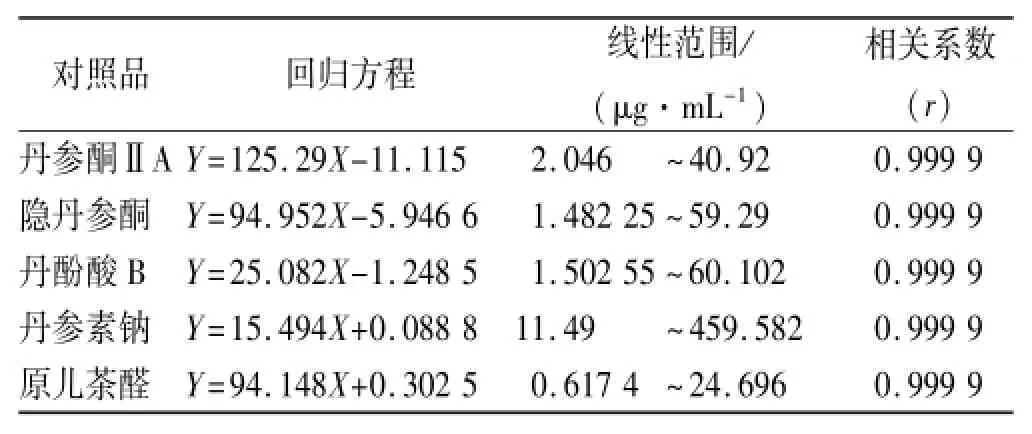
表1 5种成分线性关系实验结果Tab.1 Experimental result of linear relation of five kinds of constituents
2.3.4 精密度实验 取丹参酮ⅡA对照品10.23 mg,置50 mL量瓶中,甲醇超声溶解稀释至刻度。摇匀,精密吸取2 mL,置25 mL量瓶中,加甲醇稀释至刻度,摇匀。取隐丹参酮对照品10.89 mg,流动相稀释1 000倍。取丹酚酸B对照品12.60 mg,流动相稀释1000倍。取丹参素钠对照品10.42 mg,流动相稀释100倍。取原尔茶醛对照品12.60 mg,置25 mL量瓶中,加流动相超声溶解并稀释至刻度。摇匀,精密吸取1 mL,置100 mL量瓶中,加水稀释至刻度,摇匀。分别吸取上述对照品溶液各20μL,连续进样6次,分别测定峰面积,计算RSD。结果丹参酮ⅡA对照品峰面积平均值为2 041.94,RSD为0.25%;隐丹参酮对照品峰面积平均值为1 223.27,RSD为0.04%;丹酚酸B对照品峰面积平均值为299.75,RSD为0.24%;丹参素对照品峰面积平均值为1459.90,RSD为0.21%。原尔茶醛对照品峰面积平均值为448.67,RSD为0.07%。
2.3.5 重复性实验 取批号120901丹参胶囊,平行取样品各6份,精密称定,依法分别配制成丹参酮ⅡA、隐丹参酮、丹酚酸B、丹参素和原儿茶醛供试品溶液,连续进样测定,计算含量。结果丹参酮ⅡA的RSD为0.85%、隐丹参酮的RSD为0.88%、丹酚酸B的RSD为0.89%、丹参素的RSD为0.82%、原尔茶醛的RSD为0.92%。
2.3.6 稳定性实验 取批号120903供试品适量,分别配制5种成分的供试品溶液,置棕色量瓶中密闭保存,常温下分别于0,2,4,6,8 h,按各自色谱条件进行测定,计算峰面积和RSD。结果丹参酮ⅡA、隐丹参酮、丹酚酸B、丹参素和原儿茶醛的峰面积RSD分别为0.82%,0.54%,1.46%,0.39%和0.84%。说明5种成分的溶液在避光密闭容器中保存,含量变化不大,比较稳定。
2.3.7 加样回收率实验 取丹参胶囊供试品(已知丹参酮ⅡA、隐丹参酮、丹酚酸B、丹参素和原儿茶醛的质量分数分别为0.24%,0.15%,5.08%,0.53%, 0.02%)各9份,平均分成3组。分别精密添加不同质量浓度的对照品储备液,每个梯度平行3份;然后按“2.3.1.2”项方法制备样品溶液,按法处理并测定含量,计算回收率。结果见表2。
2.3.8 样品含量测定 取3批丹参胶囊,分别按“2.3.1.2”项下方法制备供试品溶液,按相应的色谱条件对供试品进行丹参酮ⅡA、隐丹参酮、丹酚酸B、丹参素和原儿茶醛的含量测定(每批3次),用外标法计算,取均值。结果见表3。
3 讨论
3.1 丹参胶囊的质量标准制定依据 丹参含有以丹参酮为主的脂溶性成分和以酚酸为主的水溶性成分,其中丹参酮ⅡA和丹酚酸B含量较高,分别为药材的0.1%~0.9%和2%~8%,成为丹参药材质量评价的主要指标[4-5]。《中华人民共和国药典》2010年版(一部)规定丹参药材用高效液相色谱法测定,含丹参酮ⅡA(C19H25O3)应不得少于0.20%,丹酚酸B(C36H30O16)不得少于3.0%[1]。以丹参单味药材和以丹参为主药开发的复方制剂剂型多达十余种,该类制剂广泛应用于心、脑血管疾病的临床治疗。但丹参制剂的质量标准一直存在某些争议[6],一般是针对不同提取方法、生产工艺和剂型的产品,围绕着水溶性酚酸类和脂溶性菲醌类两大类型活性成分开展质量控制。例如丹参片规定测定丹酚酸B的含量(每片折合质量分数相当于3.67%);复方丹参片和复方丹参颗粒都以丹参酮ⅡA和丹酚酸B作为含量测定指标[1];而丹参颗粒、丹参合剂、丹参口服液、丹参注射液等则以原儿茶醛为质量控制成分[7],丹参滴丸则以丹参素为控制对象。丹参胶囊则除了采用薄层色谱法定性丹参酮ⅡA外,还同时采用高效液相色谱法测定丹参酮ⅡA、隐丹参酮、丹酚酸B、丹参素和原儿茶醛的含量,质量控制兼顾丹参胶囊的水溶性和脂溶性两大类主要活性成分。测定结果表明,除原儿茶醛含量较低之外,其他4种活性成分含量均相对较高,且与丹参原料药的成分含量分布比较一致,较单纯选择丹参酮ⅡA和丹酚酸B控制制剂质量更客观,更实用。关于限量标准,仍然建议以《中华人民共和国药典》标准中相同或者相似剂型的质量分数作为参考来制定。为更好地进行质量控制,笔者下一步拟对该品种的指纹图谱标准进行深入研究。
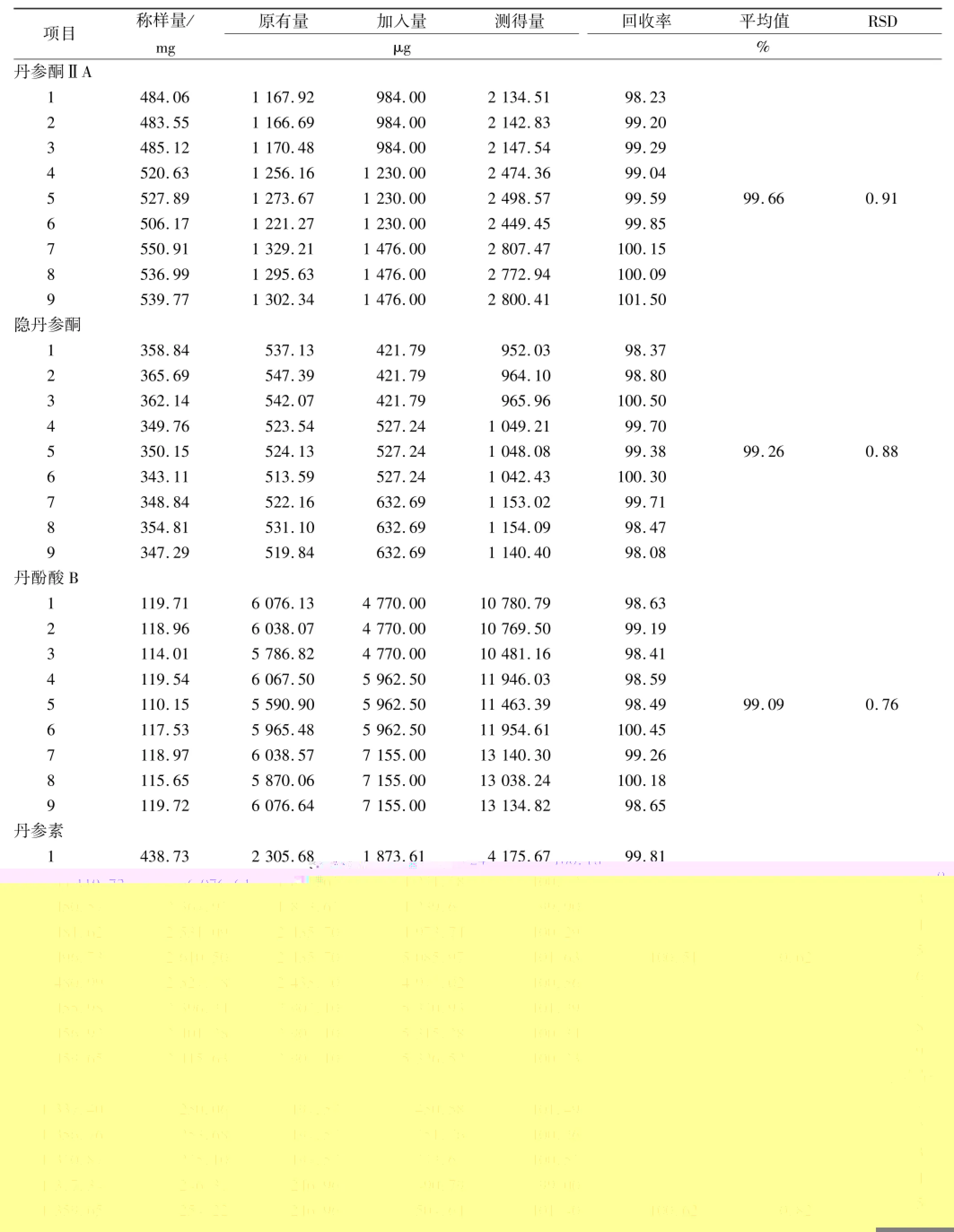
表2 5种成分加样回收实验结果Tab.2 Results of recovery tests on five kinds of constituents

续表2 5种成分加样回收实验结果Tab.2 Results of recovery tests on five kinds of constituents
表3 丹参胶囊样品含量测定结果Tab.3 Results of conten t determ ination on sam p les of Danshen capsules %,±s
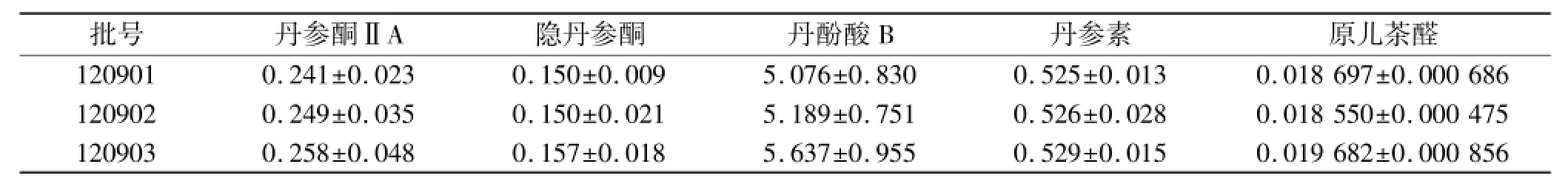
表3 丹参胶囊样品含量测定结果Tab.3 Results of conten t determ ination on sam p les of Danshen capsules %,±s
?
3.2 丹参胶囊与丹参舒心胶囊质量标准的比较 丹参舒心胶囊也是单味丹参药材提取物制得的胶囊剂,原为卫生部药品标准中药成方制剂第7册所收载,其主要是提取脂溶性部位入药,标准内容简单,关键项目为丹参酮ⅡA薄层层析鉴别,没有含量测定[8]。由于该产品开发较早,丹参提取物的工艺过于简单,设计上也存在一些缺陷,因而导致产品质量参差不齐,含量差异悬殊[9]。因为缺乏定量标准,导致国内对该产品的质量标准研究方法多种多样,存在定量指标难以统一的问题[10-15]。而丹参胶囊是研究者根据[Z]GPH3-1《中药、天然药物制剂研究技术指导原则》(第二稿)的相关规定,在参阅相关标准和文献的基础上,采用丹参药材脂溶性和水溶性有效部位均入药的思路研制而成,较好地提升了制剂的质量。因此,笔者认为,在理想状态下,既然现有的技术工艺已经完全能够满足同时提取丹参的两大类有效成分,丹参药材作为单一入药的原料,其制剂应该尽量参照《中华人民共和国药典》中该药材的质量标准来制定,以确保临床疗效。
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:70-71,579-580.
[2] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:528.
[3] 陈常兴.HPLC法测定丹参酮片中隐丹参酮含量[J].中国实验方剂学杂志,2010,16(6):114-115.
[4] 叶勇.丹参有效成分分离的研究进展[J].药品评价, 2005,2(2):146-148.
[5] ZHOU L,ZUO Z,CHOW M S.Danshen:an overview of its chemistry,pharmacology,pharmacokinetics,and clinical use [J].J Clin Pharmacol,2005,45(12):1345-1359.
[6] 张国明,谢家骏,徐晓英,等.关于2005版《中华人民共和国药典》中丹参片质量标准商榷[J].中成药,2009,31 (4):609-610.
[7] 肖禾,宋民宪,赖娟.国家药品标准中丹参的质量控制情况[J].中国药事,2006,20(1):57-59.
[8] 国家药典委员会.《卫生部药品标准》中药成方制剂第7册[M].北京:化学工业出版社,1993.WS3-B-1294-93.
[9] 黄丽丹,张亚中,王鼎,等.丹参舒心胶囊检验结果与质量评价[J].中国药事,2011,25(6):584-586.
[10] 张亚中,金斌,黄丽丹,等.HPLC测定128批丹参舒心胶囊中丹参酮Ⅰ、隐丹参酮、丹参酮ⅡA的含量及结果分析[J].中成药,2011,33(1):65-69.
[11] 庄瑞.RP-HPLC法测定丹参舒心胶囊中丹酚酸B的含量[J].数理医学杂志,2010,23(5):581-582.
[12] 龙梦林.HPLC法测定丹参舒心胶囊中丹参素钠的含量[J].齐鲁药事,2008,27(3):149-150.
[13] 侯广杰.HPLC法测定丹参舒心胶囊中丹参酮ⅡA的含量[J].安徽医药,2012,16(4):469-470.
[14] 曹澜,曹流,曹虹,等.丹参舒心胶囊质量标准研究[J].中国卫生工程学,2009,8(6):359-360.
[15] 褚奇星,王玉焕.RP-HPLC测定丹参舒心胶囊中丹参酮ⅡA的含量[J].中国误诊医学杂志,2008,8(27):6617-6618.
DOI 10.3870/yydb.2014.06.027
Study on Quality Standard of Danshen Capsules
CHENG Yue-fa1,LAN Jian-fang2,REN Xin-ping2,ZHANG Jun1,XIE Yue-sheng1
(1.Jitang College of Hebei United University,Tangshan 063300,China;2.Hainan Selection Pharmaceutical Co.,Ltd,Haikou 571124, China)
ObjectiveTo establish a new quality control standard fordanshencapsules.MethodsThe qualitative identification ofdanshencapsules was characterized by ultraviolet fluorescence and thin-layer chromatography(TLC).The contents of tanshinoneⅡA,cryptotanshinone,salvianolic acid B,danshensuand protocatechuic aldehyde indanshencapsuleswere determined by high performance liquid chromatography(HPLC)on a C18column.The flow rate was 1 mL·min-1,and the column temperature was 35℃.ResultsThe HPLC linear ranges of tanshinoneⅡA,cryptotanshinone,salvianolic acid B,danshensuand protocatechuic aldehyde were 2.046-40.92μg·mL-1,1.482 25-59.29μg·mL-1,1.502 55-60.102μg·mL-1,11.49-459.582μg·mL-1,and 0.617 4-24.696μg·mL-1,respectively,andrvalueswere 0.999 9.The average recoverieswere99.66%(RSD of 0.91%)for tanshinoneⅡA,99.26%(RSD of 0.88%)for cryptotanshinone,99.09% (RSD of 0.76%)for salvianolic acid B,100.51%(RSD of 0.62%)fordanshensu,and 100.62%(RSD of 0.82%)for protocatechuic aldehyde,respectively.The contents of the tanshinoneⅡA,cryptotanshinone,salvianolic acid B,danshensushowed a certain high level in the 3 batches ofdanshencapsule samples,but protocatechuic aldehyde was low by comparison.ConclusionThe HPL Cmethod is proven to be sensitive,accurate,repeatable,and can be used for quality control of thedanshencapsules.
Danshencapsules;Quality standard;Active component;Chromatography,high performance liquid; Chromatography,thin-layer
R286;R927.11
A
1004-0781(2014)06-0785-05
2013-08-06
2013-11-20
*唐山市2013年科学技术研究与发展基金项目(13130298z)
程月发(1967-),男,安徽桐城人,博士,主要研究方向:天然产物药理学。电话:0315-8114108,E-mail:arthurcyf@163.com。
