利用赤星病菌毒素快速高通量鉴定烟草抗性种质的方法研究
2014-05-15孙丽萍雒振宁张峻铨王凤龙
孙丽萍,时 焦,孟 坤,雒振宁,张峻铨,王凤龙
利用赤星病菌毒素快速高通量鉴定烟草抗性种质的方法研究
孙丽萍1,2,时 焦1*,孟 坤1,2,雒振宁1,2,张峻铨3,王凤龙1*
(1.中国农业科学院烟草研究所,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.山东中烟工业有限责任公司青岛卷烟厂,青岛 266101)
为寻求一种快速高通量筛选鉴定烟草抗赤星病种质或材料的方法,本研究以烟草(L.)种质净叶黄、Beinhart1000-1、NC89和G140作为供试材料,利用烟草赤星病菌毒素就烟草种质对赤星病的抗病性鉴定方法进行研究,试验设计3种鉴定方法:毒素液浸根法、毒素液浸种法和毒素培养基法。为验证毒素培养基法鉴定结果的可靠性,对烟草种质材料净叶黄、Beinhart1000-1、NC89、G140、K326、G28和中烟100的室内鉴定结果,与其对烟草赤星病的田间抗性鉴定结果进行了相关性分析。结果表明,室内鉴定结果与田间鉴定结果之间极显著相关(=-0.9588),室内鉴定结果可准确反映烟草种质对赤星病的抗病性。
烟草;赤星病;真菌毒素;筛选方法
烟草赤星病是由链格孢菌[(Fries) Keissler]引起的为害相当严重的叶斑真菌病害之一[1-2]。防治该病最经济有效的措施是选育和利用抗病种质[3]。鉴定烟草种质对赤星病抗性的常规方法有3种,一是毒素液浸根法[4],二是离体叶片接种法(也称悬滴接种法)[5],三是田间鉴定。这些方法都是利用成苗或成熟烟株或叶片进行鉴定。不仅需要时间长,而且占地面积大。因此,研究简便快捷的烟草抗赤星病种质鉴定方法十分必要。
植物病原真菌能够产生真菌毒素[6],包括寄主专化性毒素(Host Specific Toxins, HST)及非寄主专化性毒素(Non-Host Specific Toxins, NHST)[7-8]。赤星病菌在寄主体内和培养过程中均可产生毒素[9]。董汉松等[4]利用毒素液浸根法开展了赤星病菌毒素对烟草幼苗致病性的研究,发现烟草品种幼苗对毒素的抗性与悬滴接种法测定的相同品种对病原菌的抗病性一致,肯定了运用毒素筛选烟草抗赤星病种质的可靠性。Ishida等[10]将赤星病菌产生的毒素液加到培养基中,用于培养对烟草赤星病抗性不同的烟草种质的细胞,结果发现,抗病种质细胞的死亡率比感病种质的低很多。郭永峰[11]报道,运用毒素对烟草种质的成熟叶片进行鉴定具有可靠性。Kodama等[12]研究表明,提纯的毒素引起感病种质、中抗种质叶片坏死的浓度分别是1 μg/mL和20 μg/mL。以前科研工作者只是利用毒素对烟苗或者烟草成熟叶片的抗性水平进行了初步的探索,尚无人利用毒素直接对烟草种子进行鉴定的研究报道。为研制一种既快捷,又节省资源的新方法,我们开展了利用毒素直接对烟草种子进行鉴定的方法研究。
1 材料与方法
1.1 供试烟草种质
烟草种质材料净叶黄、Beinhart1000-1、NC89、G140、K326、G28和中烟100均由国家烟草中期库提供。
1.2 菌株来源
烟草赤星病菌A1号菌株,由中国农业科学院烟草研究所烟草病虫害监测与综合治理重点开放实验室提供。
1.3 毒素液的制备
参照董汉松等[4]介绍的方法并加以修改。首先从培养皿中繁殖的赤星病菌上取1个直径5 mm的菌饼接种于120 mL查彼培养液中,在28 ℃条件下振荡培养4周,纱布过滤除菌丝体,再经3~5次离心(8 000 r/min,10 min)、镜检无细胞,121 ℃湿热灭菌15~30 min,得毒素液,用生物测定方法[13]确定毒素活性,然后贮藏备用。
1.4 鉴定方法研究
2011年在中国农业科学院烟草研究所开展试验,设置了毒素液浸根法、毒素液浸种法和毒素培养基法3种鉴定方法,并对其进行了研究。
1.4.1 毒素液浸根法 将毒素液用无菌水按不同倍比(原液、1/2、1/4、1/8、1/16、1/32、1/64)稀释,设相应稀释倍比的查彼培养液为对照,共14个处理。将2~3叶期烟草幼苗的根部洗净,放入含有8 mL处理液的青霉素小瓶中,每瓶15~20株,重复4次。于25~28 ℃,14 h/d光照条件下培养,培养过程中应及时补足蒸发的水分,96 h后观察并测量根长。以查彼培养液浸种的烟苗根长为对照处理根长,计算毒素液对根长的抑制率[14]。

采用DPS软件Duncan’s新复极差法(<0.05)对烟苗根长抑制率进行差异显著性分析。
1.4.2 毒素液浸种法 种子经10%H2O2消毒后,放入灭菌的毒素液中浸泡,浸泡时间设4、8、16、24 h,同时设查彼培养液分别浸泡4、8、16、24 h的处理为对照,共8个处理。各处理按设计时间先浸于毒素或者查彼培养液中,后浸于水中,保证每个处理实际总浸种时间均为24 h。然后取20粒烟草种子置于含水琼脂培养基的培养皿(直径9 cm)内,每皿为1个处理,重复4次。25~28 ℃,14 h/d光照条件下培养,第20天测量记录根长,并以查彼培养液浸种的烟苗根长为对照处理根长,计算毒素液对根长的抑制率。采用DPS软件Duncan’s新复极差法(<0.05)对烟苗根长抑制率进行差异显著性分析。
1.4.3 毒素培养基法 将同批次未消毒的毒素液与琼脂或者水琼脂混合,配制成不同稀释倍比的含毒素固体培养基:原液(每升毒素液中加入琼脂18 g)、1/2、1/4、1/8、1/16,121 ℃湿热灭菌15~30 min。同时设相应稀释倍比的查彼固体培养基和水琼脂培养基为对照,共11个处理,重复4次。其他操作同毒素液浸种法,以根系紧贴或伸入培养基中的程度以及叶片颜色为鉴定指标,采用DPS软件Duncan’s新复极差法(<0.05)对根系深入培养基中烟苗的比率进行差异显著性分析。
1.5 毒素培养基法可靠性的进一步验证
为进一步验证毒素培养基法的可靠性,就毒素培养基法对烟草种质材料净叶黄、Beinhart1000-1、NC89、G140、K326、G28和中烟100的室内鉴定结果,与相应烟草种质材料对烟草赤星病的田间抗性鉴定结果(数据为中国农业科学院烟草所植保室2012年田间试验调查结果)进行相关性分析。数据分析采用DPS统计软件进行。
2 结 果
2.1 鉴定方法研究
2.1.1 毒素液浸根法 从毒素对烟苗生长的抑制率来看(表1),不同稀释倍比的毒素液对烟苗根系生长的影响不同。差异显著性分析的结果(表1)显示,毒素液浓度过高(原液)或者过低(1/64)时,其对4个种质烟苗根系生长的影响差异不显著;毒素液稀释倍比为1/2、1/4时,抗病种质和感病种质之间的差异不能反映出种质在田间的实际抗病性。这种现象的原因可能是在毒素选择压力很大时,抗病种质不能克服毒素的抑制作用,在毒素选择压力过低时,感病种质也能克服毒素的抑制作用。
毒素液稀释倍比为1/8~1/32时,毒素对感病种质NC89和G140根系生长的抑制作用显著高于对抗病种质Beinhart1000-1和净叶黄的抑制作用(<0.05),见表1。因此,毒素稀释倍比在1/8~1/32时,能够鉴定不同烟草种质对赤星病的抗感性。
2.1.2 毒素液浸种 抗感病种质在毒素液中浸种后各处理幼苗根长抑制率之间差异显著性分析结果显示(表2),在4~24 h时,抗感病种质幼苗根长抑制率之间差异不显著,难以鉴定种质抗感性差异。

表1 毒素液不同稀释倍比对根长的抑制率
注:同列数据后不同字母表示差异显著(<0.05),表2、表3同。.

表2 抗感病种质浸种处理的根长抑制率
2.1.3 毒素培养基法 对烟草抗感赤星病种质幼苗根系深入毒素培养基中的比率进行差异显著性分析结果(表3)显示,在5%的显著水平下,抗病种质净叶黄幼苗根系在稀释倍比为1/2的毒素培养基上深入基质中的比率同其他3个种质间差异不显著,而在原液以及稀释倍比为1/4~1/16的毒素培养基上时,均显著高于同等条件下NC89和G140;从幼苗根系在不同稀释倍比的含毒素培养基上的深入比率来看,Beinhart1000-1均高于NC89和G140。通过对比分析种质间烟草幼苗根系在各个稀释倍比含毒素培养基上紧贴或深入基质中生长的比率,能够鉴定出不同种质对赤星病的抗感水平。
从叶片大小、颜色等外观性状来看(图1),抗感病种质烟株在培养基上生长情况的优劣次序依次为:水琼脂培养基、查彼培养基和毒素培养基。
2.2 进一步验证的相关分析结果
毒素培养基法鉴定的烟草幼苗根系深入基质的比率同田间病情指数之间相关系数为=-0.9588,达极显著水平(表4),进一步说明了本方法的可靠性,能够鉴定出不同品种对赤星病的抗性水平。

表3 抗感病种质幼苗根系深入培养基中的比率

图1 抗感病种质在不同培养基上的生长情况
注:从上而下第1排为生长在查彼培养基上的净叶黄幼苗;第2排为生长在查彼培养基上的NC89幼苗;第3排为生长在毒素培养基上的净叶黄幼苗;第4排为生长在毒素培养基上的NC89幼苗。
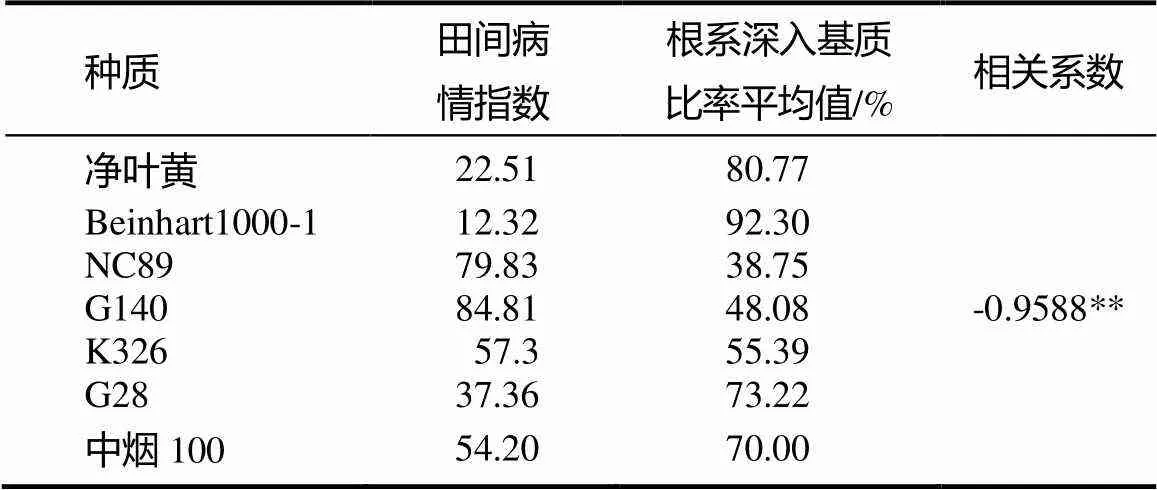
表4 毒素培养基法鉴定烟苗根系深入基质的比率与田间病情指数的相关性
注:“**”表示极显著相关,<0.01。
3 讨 论
诸多学者运用植物病原真菌毒素进行植物抗感种质的筛选鉴定研究,如无胁迫培养基法、胁迫培养基法[15-16]和双层培养基法[17],多建立在品系数量较少的基础上。本文直接利用烟草种子作为鉴定材料,能够在培养皿中于5周内完成抗病性鉴定,为种质材料的快速高通量鉴定提供了方法。对3种鉴定方法的研究结果显示,毒素浸种法不能鉴定烟草种质对赤星病的抗性水平。毒素浸根法能够应用于烟草种质对赤星病的抗性水平鉴定,因抗感病种质在一定稀释倍比的毒素液中能够表现出抗感差异,且与抗感病种质在田间对赤星病的抗性表现相一致,这与董汉松等[4]的研究结果一致。但是在研究过程中我们发现此方法存在一定的弊端,首先试验所用的瓶口不能封闭,易被杂菌所污染,从而影响烟草幼苗根系的生长;其次,这种方法需要一定的烟苗培育过程,比毒素培养基法耗时长1个多月。
毒素培养基法是依据在毒素影响下种子萌发后的生长过程,依据生长产生的差异进行鉴定。在试验过程中,我们发现查彼培养基能对烟草幼苗的生长产生一定的抑制作用,这与先前的研究报道一致[4],烟草抗感赤星病种质在一定稀释倍比的毒素培养基上,抗性水平存在差异,与田间表现相一致,证明了其作为烟草抗赤星病种质材料筛选方法的可行性,它作为一种新方法,具有以下特点:第一,直接利用种子鉴定,就可以在培养皿中完成烟草种质对赤星病的抗性鉴定,比常规鉴定试验省略了培养烟株的繁琐,不仅节省了人力和物力,而且大幅缩短了鉴定时间。第二,使烟草对赤星病的抗性鉴定不受生长季节的限制,任何季节都能开展鉴定工作。第三,不受其他杂菌的干扰,亦不会产生类似悬滴接种法因接种用孢子分布不均而出现接种强度不一致的现象,从而造成鉴定误差。
目前我国已启动烟草基因组计划,该方法的建立对于烟草突变体库研究所获得的大量突变体材料的快速鉴定奠定了基础。
[1] 朱贤朝,王彦亭. 中国烟草病虫害防治手册[M]. 北京:中国农业出版社,2002:10.
[2] 张亚,何可佳,罗坤,等. 烟草赤星病研究进展及对策[J]. 陕西农业科学,2007(2):82.
[3] 吴中心,姚根怀,张同庆,等. 烟草赤星病抗病鉴定方法的研究[J]. 烟草科技,1994(1):45.
[4] 董汉松,曲建军,王智发,等. 赤星菌毒素对烟草幼苗致病特性的研究[J]. 山东科学,1993(6):36-41.
[5] 刘化冰,张小全,尚晓颍,等. 烟草赤星病抗病性鉴定方法研究进展[J]. 中国农学通报,2009,25(21):261-265.
[6] 刘品贤,李久香. 寄主专化性毒素的研究现状和成果[J]. 植物保护,1992,6(2):8-10.
[7] 张利辉,董金皋,刘云惠. 植物病原真菌毒素的分离与纯化技术[J]. 现代农业科学,2001(2):56-62.
[8] 时焦,王凤龙,张成省,等. 寄主专化性毒素及其在烟草上的研究进展[C]//王凤龙. 烟草有害生物调查研究与防治实践. 北京:中国农业出版社,2012:32-34.
[9] 杜雷. 安徽烟草赤星病菌生物学特性及致病力分化研究[D]. 合肥:安徽农业大学,2009.
[10] Ishida Y, Kumashiro T. Expression of tolerance to the host-specific toxin of Alternaria alternata (AT toxin) in cultured cells and isolated protoplasts of tobacco[J]. Plant Diseases,1988, 72(10): 892-895.
[11] 郭永峰. 烟草赤星病抗性鉴定的新方法[J]. 中国烟草,1995(3):44-47.
[12] Kodama, M, Kohmoto K, Nishimura S, et al. Purification and bioassay of host-selective AT-toxin from Alternaria alternata causing brown spot of tobacco [J]. Phytopathol Sci. Japan, 1990, 56(1): 628-636.
[13] 白涛,王元存,王荣. 烟草赤星菌毒素诱导烟草微细胞死亡及对TMV的抗性[J]. 中国烟草科学,2006,27(2):26-28.
[14] 张欣芳,苏前富,宋淑云. 玉米弯孢病菌毒素的研究进展[J]. 玉米科学,2009,17(6):118-120.
[15] Daub M E. Tissue culture and the selection of resistance to pathogens[J]. Auna. Rev. Phytopathol, 1986, 24: 159-186.
[16] Harlman C L. Selection of alfalfa () cell Lines and regeneration of plants resistant to the toxin(s) produced by Fusurium oxysporum f. sp medicaginis[J]. Plant Sci. Lett, 1984, 34: 183-194.
[17] 吴中心,张同庆,姚根怀. 利用细胞工程筛选烟草抗赤星病突变体的研究[J]. 中国烟草,1993(1):14-17.
Investigation on the Method of Rapid Identifying Resistant Tobacco Germplasms toby Using its Mycotoxins
SUN Liping1,2, SHI Jiao1*, MENG Kun1,2, LUO Zhenning1,2, ZHANG Junquan3, WANG Fenglong1*
(1. Tobacco Research Institute of CAAS, Qingdao 266101, China; 2. Graduate School of CAAS, Beijing 100081, China; 3. Qingdao Cigarette Factory of China Tobacco Shandong Industrial Co., Ltd, Qingdao 266101, China)
In order to find out an approach to rapidly identify resistant tobacco germplasm to, tobacco varieties Jingyehuang, Beinhart1000-1, NC89 and G140 were used as test materials. Using toxins produced by brown spot fungus (), we carried out a comparative test to choose a better screening method. Three kinds of screening methods were designed: toxins liquid soaking root of tobacco, toxins liquid soaking seeds of tobacco, and toxin-containing medium screening method. To verify the reliability of the toxin-containing medium screening method, Correlation between laboratory test results and field data on tobacco varieties Jingyehuang, Beinhart1000-1, NC89, G140, K326, G28 and Zhongyan100 was analyzed, and correlation coefficient of -0.9588 was found, which suggests the effectiveness of laboratory method is close to those of field.
tobacco; brown spot disease; mycotoxin; identifying method
S572.08
1007-5119(2014)01-0080-05
10.13496/j.issn.1007-5119.2014.01.015
中国烟草总公司科技重点项目(110201002022)
孙丽萍,女,硕士研究生,研究方向为植物病理学。E-mail:sunlpgod@163.com。
通信作者,E-mail:jshi42@sohu.com;wangfl64@gmail.com
2013-01-07
2013-03-27
