谷氨酰胺合成酶抑制剂对衰老期烟叶氮代谢的影响
2014-05-15武云杰杨铁钊张小全
武云杰,杨铁钊,张小全
谷氨酰胺合成酶抑制剂对衰老期烟叶氮代谢的影响
武云杰,杨铁钊*,张小全
(河南农业大学烟草学院,郑州 450002)
通过质外体提取和测定氮素代谢相关酶等方法,调查了不同浓度谷氨酰胺合成酶(GS)抑制剂(Glufosinate)对2个氮效率烤烟品种氮代谢相关生理指标的影响。结果表明,GS抑制剂可以有效抑制衰老期间烟叶GS活性,使氮素再同化能力下降,促进氮素营养物质的降解,并诱导谷氨酸脱氢酶(GDH)活性升高和硝酸还原酶(NR)活性下降,使叶片NH4+积累,增大了氨气挥发潜力,且随着GS抑制剂浓度的升高,抑制效果更加明显。氮低效品种与氮高效品种相比,衰老速度快,叶片NH4+的积累量小,氨气挥发潜力大,品种间差异显著。GS抑制剂可以加速叶片衰老,促进氮素降解和再转移。
烤烟;氮代谢;氮利用率;谷氨酰胺合成酶抑制剂
氮是影响烟叶产量和品质的重要营养元素之一,不同品种烤烟具有不同的氮代谢特性[1-2]。烟叶衰老期是碳氮代谢转化的关键时期,叶片衰老的主要目的是进行营养的再分解和再转移,氮素再转移速率与叶片衰老程度有关[3]。谷氨酰胺合成酶(GS)是烟株氮代谢关键酶,植物体内95%的NH4+首先通过GS催化合成谷氨酰胺[4-5],GS也是调控植物和大气氨气交流的关键酶,叶片GS活性对植物叶片NH4+浓度有显著影响[6],是造成品种间氨气补偿点和氨气挥发量差异的决定因素[7-8]。GS抑制剂(Glufosinate,4-[羟基(甲基)膦酰基]-D/L一高丙氨酸)的靶标酶是GS[9],其作用是通过降低GS活性,减少氮素化合物的合成,在植物体内传导能力强,半衰期短[10],而且对哺乳动物安全[11]。相关研究表明,GS抑制剂处理小麦叶片后,叶片氮含量显著下降,并转移到其他器官[12]。由于烤烟生产是以叶片为收获目标的,衰老期氮素合成量过大,使烟株生长过旺,氮代谢延长,烟叶成熟期推迟,造成烟叶品质低劣[13]。生产上通过减少生育后期的土壤肥力和控制打顶时间等方法来控制烟叶衰老速度,但是通过GS抑制剂控制GS活性来调控烤烟叶片氮素代谢的研究未见报道。本试验选用氮高效品种K326和氮低效品种中烟100为试验材料[14-15],在烟叶衰老期间通过喷施不同浓度的GS抑制剂,研究烤烟氮素代谢生理指标的变化及其品种间差异,为调控烟叶氮素代谢和指导优质烟叶生产提供参考。
1 材料与方法
1.1 试验材料与设计
试验于2011年在河南农业大学科教园区进行(郑州),采用盆栽培养方法。供试土壤为壤质潮土(取自河南农业大学科教园区),耕层土壤的基本理化性状为有机质9.58 g/kg、全氮0.87 g/kg、速效氮64.46 mg/kg、速效磷25.42 mg/kg、速效钾105.00 mg/kg,pH 7.88。参试烤烟品种为K326和中烟100。5月15日选取生长一致的壮苗,分别移栽于装有15 kg土壤的塑料盆中,每盆1株。分别施用分析纯NH4NO3、NaH2PO4和K2SO4,N、P、K的用量分别为0.13、0.13、0.39 g/kg,穴施,分移栽时、移栽后第1周、第2周3次施入,3次施肥量比例为2:1:1。每品种300株,常规水分管理。每个品种各选取整齐一致的单株100株,以第11片叶(自下向上数)为试验对象,在叶龄40 d用浓度0.005%和0.01%的GS抑制剂均匀喷施叶片(第11片叶),以清水处理为对照,第1次取样在喷施后6 h,之后在叶龄50 d(即喷施后10 d,以此类推)、60 d和70 d(以幼叶长1 cm,宽0.5 cm时作为叶龄第1天)取不同浓度GS抑制剂和清水处理的叶片为待测样品。各项指标测定重复3次。
1.2 测定项目与方法
1.2.1 叶片铵态氮、总氮和可溶性蛋白含量的测定 叶片铵态氮、总氮和可溶性蛋白分别用茚三酮法、凯氏定氮法、考马斯亮蓝G-250法[16]进行测定。
1.2.2 谷氨酰胺合成酶(GS)、谷氨酸脱氢酶(GDH)和硝酸还原酶(NR)活性的测定 按照O’Neal等的方法[17]测定粗酶提取液GS活性。一个GS活性单位定义为该反应条件下,在15 min反应时间内催化形成1 μmolγ-谷氨酰异羟肟酸需要的酶量,总活性为:每克鲜样酶粗液在每小时的反应时间内催化形成的μmol数。总GS活性计算以每分钟每毫克粗蛋白催化产生的γ-谷氨酰异羟肟酸μmol数表示。GDH参照Turano等的方法[18]。在340 nm处测定30 s内吸光值的变化。以每分钟反应混合液于30 ℃减少1 μmol的NADH定义为一个酶活性单位。总GDH活性计算以每分钟每毫克粗蛋白催化NADH减少的μmol数表示。NR采用活体法[16],在540 nm处测定,以每克鲜样酶粗液在每小时的反应时间内催化形成的1 μg亚硝态氮(NO2-)为一个酶活性单位。
1.2.3 质外体铵离子浓度和pH测定 质外体提取参照Husted等[19]的方法,在室温(20~25 ℃)进行渗透,从取叶到提取结束控制在20 min以内。细胞质污染检验:采用苹果酸脱氢酶(EC 1.1.1.38)测定法检验提取出的质外体溶液纯度,即质外体受细胞质污染的程度[15]。称取采集的叶片0.5 g左右剪碎,加入提取液(0.1 mol/L的TES,2 mmol/L的DTT和0.2 mmol/LEDTA,pH 7.5)研磨成匀浆(叶片与提取液质量比1:5),在4 ℃以下10 000g离心10 min,取上清液100 μL与质外体提取液100 μL分别加入3 mL比色介质(0.094 mmol/L NADH,0.17 mmol/L草酰乙酸,0.05 mol/L TES)在340 nm处比色,比较两者苹果酸脱氢酶活力。若质外体溶液苹果酸脱氢酶活力与叶片苹果酸脱氢酶活力比值小于3%即合格,本试验测定值为1.73%。用连续流动分析仪(Bran Luebbe AA3)测定质外体NH4+浓度。选用1.0和10.0 μg/L NH4+的标准溶液(NH4Cl去离子水溶液),去离子水为零标准。质外体pH用微电极(Mettler Toledo, Inlab 423, Electroly, 9811)直接在微型离心管内测定。
1.2.4 气孔氨气补偿点的计算 参考文献[20-21]的方法,在质外体pH范围内,当K<[H+]apo时,可根据以下方程计算氨气补偿点(χs,浓度单位nmol NH3/mol,air):
χs= Г × K×K
其中,Г是[NH4+]apo和[H+]apo之比,代表不依赖于温度的氨气交换潜力,[H+]apo是测定的质外体NH4+浓度,[H+]apo通过测定的质外体pH换算成氢离子(H+)浓度而得到。K和K是热动力学常数,分别为10-1.76L/mol和10-9.25mol/L(25 ℃)。由于质外体中离子生理强度通常在14到28 mmol/L之间[22-23],依照Debye-Hückel方程[24]将K值调整为K= 10-9.32mol/L(25 ℃),K值不变。
1.3 数据处理
采用SPASS 17.0 对数据进行统计分析。
2 结 果
2.1 叶片谷氨酰胺合成酶(GS)、谷氨酸脱氢酶(GDH)和硝酸还原酶(NR)活性的变化
GS是氮素代谢中同化和转移NH4+的关键酶,也是防止叶片NH4+积累到有害浓度的关键酶[5,8],GDH是氮代谢的调节酶,具有合成氨和脱氨的功能[25],在衰老后期的主要功能是脱氨[26],而NR是植物氮同化代谢关键步骤硝酸盐同化中的限速酶和调节酶[27]。由表1可知,衰老过程中GS和NR活性大幅下降,GDH则呈现先升后降的趋势,品种间差异极显著。喷施GS抑制剂后,明显抑制了GS的活性。0.005%的抑制剂浓度在处理当天,分别使中烟100和K326的GS活性下降14.82%和30.13%,叶龄50~70 d,中烟100和K326的GS活性与对照相比降幅分别在21.03%~24.34%和39.49%~42.45%。而用浓度0.01%的GS抑制剂处理后,在叶片衰老期间中烟100和K326的GS活性与对照相比降幅分别在40.19%~43.52%和48.94%~55.61%。处理间均达到极显著差异。
GDH活性表现为处理均高于对照,且两品种随GS抑制剂处理浓度的增大而逐渐增大,但品种间同一处理下K326的增幅均大于中烟100,处理间仅在叶龄40 d时差异未达到极显著水平。NR活性与GS活性变化趋势一致,但降幅较小,而且不同浓度的GS抑制剂处理烟叶后,NR活性降幅变化不大。说明GDH和NR作为氮素代谢的调控酶其活性可能受诱导而变化。中烟100与K326相比的GS和NR活性低,GDH活性高,氮素合成能力弱,转移量大,GS抑制剂可以有效抑制氮素的同化,增大对氮素的转移,同化量随抑制剂浓度的增大而减少。
2.2 叶片NH4+浓度、可溶性蛋白和总氮含量变化
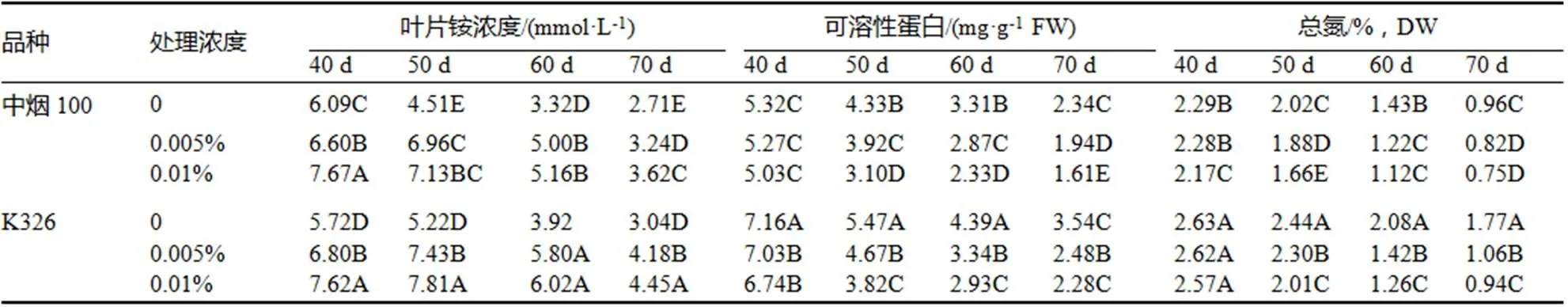
叶片衰老过程中NH4+的积累是氮素物质降解的结果[28],而且NH4+是氮素代谢的一个核心中间体[29]。由表2可以看出,衰老过程中未经处理的烟叶叶片NH4+浓度、可溶性蛋白和总氮含量均呈下降趋势,中烟100总氮含量降幅达到57.85%,K326只有32.39%,中烟100的可溶性蛋白降解量显著高于K326。随着GS抑制剂浓度的升高,可溶性蛋白和总氮含量明显下降,K326的降解量大于中烟100,两品种在叶龄60 d以后的总氮含量相差不大。氮素物质的降解伴随着叶片NH4+浓度的大幅上升,中烟100和K326均在叶龄50 d达到高点,0.005%的抑制剂浓度与对照相比增幅分别达到54.22%和42.45%,0.01%的抑制剂浓度与对照相比增幅分别57.96%和49.72%。而且K326的高峰期较长,衰老期处理后的叶片NH4+浓度均在(4.18±0.10) mmol/L以上,与中烟100相比差异达到极显著水平。但是从降解量来看,总氮和可溶性蛋白与叶片NH4+浓度的变化并不完全一致。表明中烟100氮素物质降解快,对NH4+的转移能力强,随GS抑制剂浓度的增加,氮素营养物质降解量增大,K326产生了大量的NH4+并长期积累到较高浓度,可能与不同品种的NH4+再转移途径和能力有关。
表1 不同浓度GS抑制剂对叶片GS、GDH和NR活性的影响
Table 1 The influence of GS inhibitors concentrations on the GS, GDH and NR activities in tobacco leaves
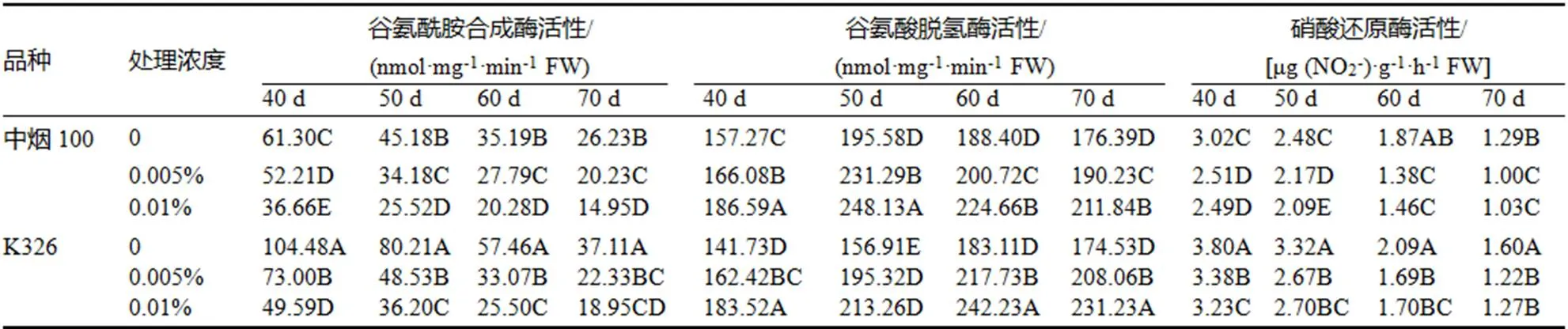
注:同一列内大写字母不同表示1%极显著差异,下同。
表2 不同浓度GS抑制剂对叶片铵、可溶性蛋白和总氮含量的影响
Table 2 The influence of GS inhibitors concentrations on the concentration of ammonium, soluble protein and total nitrogen in tobacco leaves
2.3 叶片质外体NH4+浓度、pH和氨气补偿点的变化动态
氨补偿点是根据叶片质外体NH4+浓度与pH计算得到的,氨气补偿点随着叶片的衰老而升高,叶片具有更大的氨气挥发潜力[7-8]。由表3可知,正常叶片中烟100质外体NH4+浓度显著高于K326,pH也高于K326,氨气补偿点在叶龄40~60 d均达到了K326的一倍以上,品种间差异极显著。烟叶喷施GS抑制剂后质外体NH4+浓度均大幅升高,而且K326高峰阶段时间长,不同浓度均在叶龄60 d和70 d大于中烟100,质外体pH也有小幅上升。氨气补偿点大幅升高,表现为中烟100增幅大于K326,并且增幅随抑制剂浓度的增加而增大。与表2对比可以看出,氨气补偿点、质外体和叶片NH4+浓度的变化趋势一致。说明GS抑制剂明显提高了叶片的氨气挥发潜力,在同化量减弱的情况下,叶片可以通过质外体挥发氨气达到对NH4+的调控,既减少了叶片NH4+积累而产生的毒害,又使其同化量减少,品种间氨气补偿点存在显著差异。
表3 不同浓度GS抑制剂对叶片质外体NH4+浓度、pH和氨气补偿点的影响
Table 3 The influence of GS inhibitors concentrations upon the apoplastic NH4+concentration, pH and NH3compensation point in tobacco leaves

3 讨 论
叶片衰老的主要目的是进行营养的再转移和再利用,氮素再转移速率与叶片衰老程度有关[3]。GS是氮代谢中同化和转移NH4+的关键酶,也是防止叶片NH4+积累到有害浓度的关键酶。喷施GS抑制剂后,K326的GS活性大幅下降之后,其衰老速度也明显加快,但叶片NH4+浓度持续偏高。烟叶中GDH在衰老期的主要功能是脱氨[25-26],GDH活性上升和NR活性下降,使烟叶氮素同化能力减弱,大量的NH4+积累加剧了叶片中氮素的流失。但是正常衰老的烟叶和GS抑制剂处理的烟叶,其叶片NH4+浓度并没有表现出持续上升,表明作物可能存在某种相应的补偿机制来消除叶片NH4+的积累[30-31]。
质外体是NH4+的动力池,大量的NH4+运输到质外体成为叶片氨气挥发的来源[32-33],相关研究也证明,由于叶片NH4+的积累,使质外体NH4+浓度和氨气补偿点升高氨气挥发潜力增大[6-7]。喷施不同浓度GS抑制剂后,叶片NH4+的代谢由同化转为再转移,并在喷施当天叶片NH4+浓度和pH均上升,但是K326的质外体pH上升幅度较小,造成了氨气补偿点较低。结果表明氮高效烤烟叶片在衰老速度加快、NH4+同化量低和积累量大的情况下,其氨气挥发潜力也大幅增加,但调控能力较弱,调节时间长,可能与其自身调节NH4+的运输方式和质外体环境有关[5,8]。通过质外体挥发氨气等途径是叶片NH4+再转移量增大,减少了NH4+的积累和毒害。
本试验通过对2种氮效率烤烟衰老期间的叶片进行不同浓度GS抑制剂处理,结果表明,GS抑制剂可有效抑制烟叶GS活性,并有效促进了烟叶氮素物质的降解,氨气挥发潜力增大,而且随着GS抑制剂浓度的升高,抑制效果更加明显。氮低效类型烤烟叶片衰老速度快,氮素降解量和再转移量大,同化量小,有利于烟叶成熟落黄[1,34]。而氮高效品种烤烟GS活性较高,对NH4+的同化量大,在加速衰老的情况下,对NH4+调控时间长,因此不同品种和代谢阶段的烟叶对GS抑制剂的反映存在差异。另外氮素再转移途径与氨气挥发所必备的气孔开关、质外体微环境和pH等条件有关[33],品种间再转移途径的差异需要做进一步研究。
4 结 论
本试验结果表明,GS抑制剂在烟叶成熟期间明显抑制了GS活性,并通过诱导GDH和NR活性的变化,使叶片衰老加快,氮素降解量增大,再转移能力增强。GS抑制剂浓度越高,抑制效果越强。氮低效品种烤烟衰老速度快,时间早,氮素再同化能力弱,再转移能力强,与氮高效品种相比差异极显著,对GS抑制剂的反映不同。合适浓度的GS抑制剂可以促进氮素的降解和再转移,有利于烟叶的成熟落黄。氮素再利用和再转移途径的不同,可能是导致品种间氮素代谢差异的重要因素。
[1] 窦玉青,陈刚,王树声. 氮素调理剂对烟叶质量及土壤速效氮的影响[J]. 中国烟草科学,2006,27(3):6-9.
[2] 李春俭,张福锁,李文卿,等.我国烤烟生产中的氮素管理及其与烟叶品质的关系[J]. 植物营养与肥料学报,2007,13(2):331-337.
[3] Agüera E, Cabello P, De La Haba P. Induction of leaf senescence by low nitrogen nutrition in sunflower () plants[J]. Physiologia Plantarum, 2010, 138(3): 256-267.
[4] Olsen C, Mattsson M, Schjoerring J K. Nitrogen nutrition, photosynthesis and ammonia volatilization in relation to nitrogen nutrition of young Brassica napus plants growing with controlled nitrogen supply[J]. Journal of Plant Physiology, 1995, 147: 306- 312.
[5] 莫良玉,吴良欢,陶勤南. 高等植物GS/GOGAT循环研究进展[J]. 植物营养与肥料学报,2001,7(2):223-231.
[6] 刘化冰,杨铁钊,张小全,等. 不同耐肥烤烟品种质外体NH4+浓度差异和有关指标分析[J]. 中国农业科学, 2010,43(14):3036-3043.
[7] 段旺军,杨铁钊,刘化冰,等. 烟叶氨气补偿点的品种间差异及其与氮素代谢的关系研究[J]. 植物营养与肥料学报,2011,17(2):149-158.
[8] 陈明霞,黄见良,催克辉,等. 不同氮效率基因型水稻植株氨挥发速率及其与氮效率的关系[J]. 作物学报,2010,36(5):879-884.
[9] Bellinder R R, Hatzions K K, Wilson H P. Mode of action investigations with the herbicides HOE-39866 and SC-0224[J]. Weed Sci , 1985, 33: 779-785.
[10] Faber M J, Stephenson G R, Thompson D G. Persistence and leachability of glufosinate-ammonium in a Northern Ontario terrestrial environment[J]. Agric Food Chem, 1997, 45: 3672-3676.
[11] Tachibana K, Watanaba T, Seikizawa Y. Accumulation of ammonia in plants treated with bialaphos[J]. Pestic. Sci, 1986, 11: 33-37.
[12] 杨铁钢, 戴廷波, 曹卫星. 高蛋白和低蛋白型小麦花后氮素的同化特性[J]. 生态学报,2008,28(5):2357-2364.
[13] 许威,彭耀东,何宽信. 烤烟打顶后吸氮过旺的不良影响及调控措施[J]. 中国烟草科学,2003,24(4):43-45.
[14] 梁景霞,梁康迳,林文雄,等. 烟草氮素营养的基因型差异初探[J]. 中国烟草学报,2007,13(6):36-40.
[15] 张生杰,黄元炯,任庆成,等. 不同基因型烤烟烟叶碳氮代谢差异研究[J]. 华北农学报,2010,25(3):217-220.
[16] 邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社,2000.
[17] O’Neal D, Joy K W. Glutamine synthetase of pea leaves. I. Purification, stabilization, and pH optima[J]. Archives of Biochemistry and Biophysics, 1973, 159: 113-122.
[18] Turano F J, Dashner R, Upadhyaya A, et al. Purification of mitochondrial glutamate dehydrogenase from dark-
grown soybean seedlings[J]. Plant Physiology, 1996, 112: 1357-1364.
[19] Husted S, Schjoerring J K. Apoplastic pH and ammonium concentration in leaves of Brassica napus L[J]. Plant Physiology, 1995, 109: 1453-1460.
[20] Massad R S, Loubet B, Tuzet A, et al. Relationship between ammonia stomatal compensation point and nitrogen metabolism in arable crops: Current status of knowledge and potential modeling approaches[J]. Environmental Pollution, 2008, 154: 390-403.
[21] Husted S, Schjoerring J K. Ammonia flux between oilseed rape plants and the atmosphere in response to changes in leaf temperature, light intensity and air humidity[J]. Plant Physiology, 1996, 112: 67-74.
[22] Cosgrove D J, Cleland R E. Solutes in the free space of growing tissues[J]. Plant Physiology, 1983, 72: 326-331.
[23] Speer M, Kaiser W M. Ion relations of symplastic and apoplastic space in leaves from Spinacia oleracea L. and Pisum sativum L. under salinity[J]. Plant Physiology, 1991, 97: 990-997.
[24] Atkins P W. Physical Chemistry[M]. Oxford: Oxford University Press, 1990.
[25] Masclaux C, Valadier M H, Brugière N, et al. Characterization of the sink/source transition in tobacco (Nicotiana tabacum L.) shoots in relation to nitrogen management and leaf senescence[J]. Planta, 2000, 211:, 510-518.
[26] Purnell M P, Botella, J R. Tobacco isoenzyme 1 of NAD (H)-dependent glutamate dehydrogenase catabolizes glutamate in vivo[J]. Plant Physiology, 2007, 143(1): 530-539.
[27] Foyer C H, Notor G, Lelandais M, et al. 1994. Short-term effects of nitrate, nitrite and ammonium assimilation and amino biosynthesis in maize[J]. Planta, 192:21l-220.
[28] Feller U, Fischer A. Nitrogen metabolism in senescing leaves[J]. Crit. Rev. Plant Sci., 1994, 13: 241-273.
[29] Joy K W. Ammonia, glutamine and asparagine: a carbon-nitrogen interface[J]. Can. J. Bot., 1988, 66: 2103-2109.
[30] Häusler R E, Bailey K J, Lea P J, et al. Control of photosynthesis in barley mutants with reduced activities of glutamine synthetase and glutamate synthase. 111. Aspects of glyoxylate metabolism and effects of glyoxylate on the activation state of ribulose-1, 5-bisphosphate carboxylase-oxygenase[J]. Planta, 1996, 200: 388-396.
[31] Häusler R E, Blackwell R D, Lea PJ, et al. Control of photosynthesis in barley leaves with reduced activities of glutamine synthetase or glutamate synthase. I. Plant characteristics and changes in nitrate, ammonium and amino acids[J]. Planta 1994, 194: 406-417.
[32] Dubois F, Brugiere N, Sangwan R S, et al. Localization of tobacco cytosolic glutamine synthetase and the corresponding transcrips shows organ-and cell-specific patterns of protein synthesis and gene expression[J]. Plant Molecular Biology, 1996, 31: 803-817.
[33] 吴小庆,徐阳春,沈其荣. 植物叶片氨挥发研究进展[J]. 生态与农村环境学报,2006,22(2):80-84.
[34] 张本强,马兴华,王术科,等. 施氮方式对烤烟氮素吸收积累及品质的影响[J]. 中国烟草科学,2011,32(5):56-62.
The Influence of Glutamine Synthetase Inhibitors on Nitrogen Metabolism of Tobacco Leaves during Senescence Period
WU Yunjie, YANG Tiezhao*, ZHANG Xiaoquan
(Collage of Tobacco, Henan Agricultural University, Zhengzhou 450002, China)
By using the method of apoplast extraction and determination of enzymes related nitrogen metabolism, the influence of Glufosinate (GS) inhibitor concentrations on nitrogen metabolism physiological indices of flue-cured tobacco varieties with two nitrogen use efficiency were studied. The results show that GS inhibitors could inhibit GS activity of tobacco leaf during senescence, reduce the ability of nitrogen assimilation, promote the degradation of nitrogen nutrient, induct the increasing of glutamate dehydrogenase (GDH) activity and decreasing of nitrate reductase (NR) activity and promote accumulation of leaf NH4+, increase ammonia volatilization potential. These inhibition effects became more obvious with increasing GS inhibitor concentration. Compared with high nitrogen efficiency varieties, low nitrogen efficiency varieties aged more rapidly and had a lower NH4+accumulation and ammonia volatilization potential. There was significant difference between varieties. This shows that GS inhibitors can accelerate leaf senescence and promote nitrogen degradation and transfer.
flue-cured tobacco; nitrogen metabolism; physiological N utilization efficiency; glutamine synthesis inhibitors
S572.01
1007-5119(2014)01-0037-06
10.13496/j.issn.1007-5119.2014.01.007
中国烟草总公司重大专项(Ts-01-2011003);中国烟草总公司项目(110201602008)
武云杰,男,硕士研究生,研究方向为烟草遗传育种与品质改良。E-mail:wuyunjie6@163.com。
通信作者,E-mal1:yangtiezhao@126.com
2012-04-24
