内质网应激PERK途径在高糖诱导血管平滑肌细胞向成骨样细胞转化中的作用
2014-05-15申红远马清华刘秀华
申红远,白 静,汤 喆,梁 伟,马清华,刘秀华,王 禹*
(解放军总医院:1老年心血管病研究所,4病理生理研究室,北京 100853;2解放军第324医院心血管内科,重庆 400020;3临沂市沂水中心医院心血管内科,临沂 276400)
血管钙化在糖尿病和尿毒症患者中十分常见,与心肌梗死、血管顺应性下降、血管成形术时夹层形成有关,血管钙化也被认为是心血管疾病的重要危险因素之一[1,2]。钙化的血管对血管舒张剂抵抗,比正常血管更加僵硬,更容易导致血栓形成和动脉粥样硬化斑块破裂。最近的研究表明,血管钙化不是一个被动的、血管疾病终末期、退行性变的表现,是一个主动的受到精确调控的过程,和骨生成极为相似[3]。血管钙化是在多种刺激因素下血管平滑肌细胞(vascular smooth muscle cells,VSMCs)向成骨样细胞表型转化(transformation)的过程[4]。VSMCs向成骨样细胞转分化(transdifferentiation)后碱性磷酸酶(alkaline phosphatase,ALP)活性增加,基质小泡形成,表达骨形态发生蛋白(bone morphogenetic proteins,BMPs),例如BMP2,以及骨基质蛋白,如骨钙素(osteocalcin bone Gla protein,BGP)、骨连蛋白(osteonectin)、骨唾液酸蛋白(bone sialoprotein)[1]。高糖刺激可以引起VSMCs向成骨样细胞转分化,引起成骨样细胞标志性分子核心转染因子(Cbfα-1)和BGP表达升高,ALP活性增加[5]。高糖和葡萄糖代谢产物葡萄糖胺可以引起血管平滑肌细胞内质网应激,与动脉粥样硬化形成有关[6]。内质网应激可以引起未折叠蛋白反应(unfolded protein response,UPR),UPR包括IRE1α、XBP1和蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)途径[7]。VSMCs向成骨样细胞表型转化的机制还未完全阐明,本实验旨在揭示内质网应激PERK途径是否在高糖诱导VSMCs向成骨样细胞转分化过程中发挥作用。
1 材料与方法
1.1 试剂
低糖DMEM培养液(Gibco),优质胎牛血清(PPA),D-Hanks液(北京索莱宝科技有限公司),胰蛋白酶、D-葡萄糖、D-甘露醇(Amresco公司),抗Cbfα-1抗体、抗p-PERK抗体、抗GRP78、抗BGP抗体购自(Santa Cruz公司),抗PERK抗体、抗eIF2α抗体、抗p-eIF2α抗体、抗ATF4抗体(CST公司),辣根过氧化物酶标记的羊抗兔、羊抗鼠二抗(北京中彬金桥生物科技有限公司),ALP活性检测试剂盒(南京建成生物公司),PCR引物由上海生工生物工程股份有限公司合成。其余试剂均为国产分析纯。
1.2 细胞培养和分组
植块法进行大鼠胸主动脉VSMCs培养,方法简述如下:健康雄性SD大鼠100g,由军事医学科学院实验动物中心提供。乙醚吸入麻醉,颈椎脱臼处死,无菌条件下迅速取出胸主动脉,立即移入有冰的含有无菌D-Hanks液的平皿中。剥离血管外的纤维脂肪组织,去除血管腔的血污,移入另一有冰的无菌D-Hanks液的平皿中,纵向剪开血管,用眼科弯镊钝头轻刮血管腔内膜面,分离血管中层平滑肌细胞,移入含有20%胎牛血清的DMEM培养液中,将中膜剪成1mm×1mm×1mm的组织块,将组织块转移入25cm2塑料培养瓶瓶底,培养瓶预先用少许胎牛血清润湿包被,组织块摆置均匀,间距0.2~0.5cm翻转培养瓶使瓶底朝上,向培养瓶内加2~3ml含20%胎牛血清的DMEM培养液,拧松培养瓶盖,置于37℃,5%的CO2培养箱中4~6h(如组织贴壁不牢可延长时间),待组织块与瓶底贴附后,再次翻转培养瓶,注意操作轻柔,使培养液轻轻漫过组织块,置于37℃,5%的CO2培养箱,绝对静止培养5d,一般在5~7d见有细胞从组织块边缘长出,以后每3d换液1次。约2周组织块周围可爬满细胞,细胞达到80%融合时即可传代,0.125%胰酶(含EDTA)消化、传代,取4~8代细胞用作实验。培养的VSMCs传至第2代时,用α平滑肌抗体(α-smooth muscle antibody,α-SMA)作为标志分子进行免疫荧光染色鉴定。
实验前24h更换无血清的DMEM培养基,VSMCs随机分为5组:(1)正常对照组(5mmol/L D-葡萄糖),细胞常规培养48或72h至实验结束;(2)甘露醇组(5mmol/L D-葡萄糖+25mmol/L甘露醇),细胞培养48或72h至实验结束;(3)高糖组(30mmol/L D-葡萄糖),高糖培养基培养48或72h至实验结束;(4)高糖+PERK-小干扰RNA(siRNA)转染组(30mmol/L D-葡萄糖+PERK-siRNA转染),转染前换OpitMEM培养液,采用Lipo2000阳离子脂质体进行转染,转染4~6h后换高糖培养基培养48或72h至实验结束;(5)高糖+RNA干扰阴性对照组[30mmol/L D-葡萄糖+乱序(scramble)RNA转染],将PERK-siRNA换为乱序RNA,余同组(4)。
1.3 逆转录-聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)
采用TRIzol-A+提取总RNA,Thermo NanoDrop 2 000分光光度计测定RNA浓度,琼脂糖凝胶电泳显示清晰的18S条带。按VigoScript第一链互补DNA(cDNA)合成试剂盒操作步骤将RNA逆转录成cDNA,进行PCR扩增,各目的基因上下游引物(P1,P2)见表1。PCR产物电泳图像采用Image-Pro Plus4.1图像分析软件分析平均吸光度值,以目的片段和18S平均吸光度值的比值表示目的基因信使RNA(mRNA)的相对水平。
1.4 Western blot
收取各组第48和72小时细胞,采用RIPA蛋白提取液提取平滑肌细胞总蛋白,BCA法蛋白定量后分装,-80℃保存。各组样品蛋白上样量为80µg,进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE,相对分子质量>90ku为10%分离胶,而<90ku为12%分离胶)。电转移蛋白至硝酸纤维膜上,5%的牛血清白蛋白(BSA)封闭40min后分别加入抗GRP78、p-PERK、eIF2α、p-eIF2α、ATF4、Runx2、α-SMA多克隆抗体(均为1∶500)、抗PERK多克隆抗体(1∶1000)4℃孵育杂交过夜,用1×TBS-T洗膜后以相应辣根过氧化物酶标记的二抗孵育1h,以GAPDH(1∶1000)单克隆抗体重复上述实验,作为上样对照及内参照。抗原-抗体复合物用ECL法显示,暗室X线胶片曝光,采用Image-Pro Plus图像分析软件分析各蛋白条带的平均吸光度值,以目标蛋白吸光度值/β-actin吸光度值的比值反映目标蛋白相对水平。
1.5 ALP活性检测
ALP活性检测试剂盒测定ALP活性。各组细胞干预48和72h结束后,收集细胞用冷PBS洗3次,加入150µl/孔(24孔板)0.05%的TritonX-100,超声波破碎细胞10s,收集悬液,4℃12 000×g离心15min,上清即为待测样本,蛋白用BCA法定量,各样本按照说明书分别加入反应试剂,紫外分光光度计测520nm处的吸光度值,将计算出的数值除以该样品的蛋白含量,得到各样本单位蛋白中ALP的活性。
1.6 统计学处理
所有实验重复3遍,计量资料用均数±标准差表示,采用SPSS13.0对实验数据进行统计分析,用单因素方差分析(one-way ANOVA)进行多组间比较,多个样本均数两两比较采用q检验。P<0.05为差异有统计学意义。
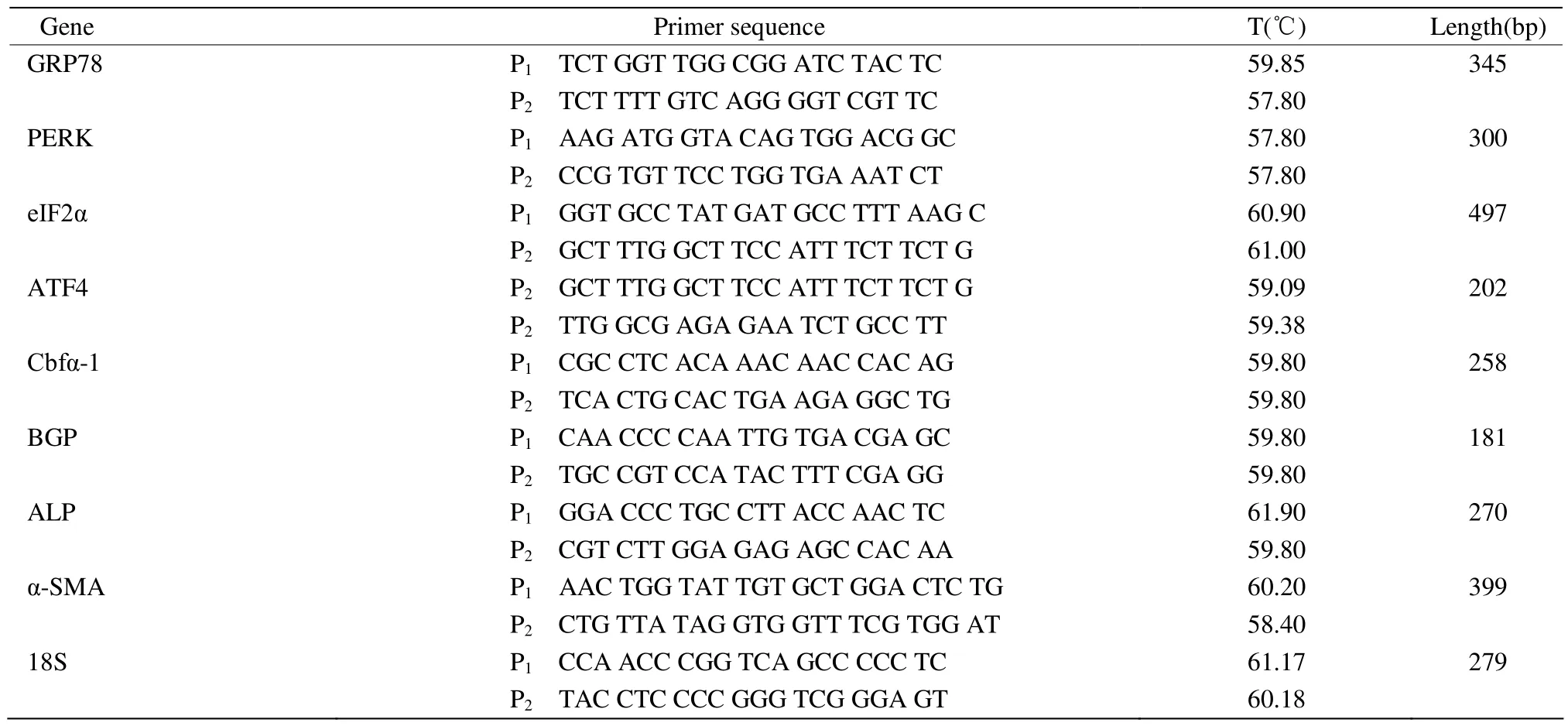
表1 PCR反应目的片段引物Table 1 Primer sequence for PCR
2 结 果
2.1 VSMCs原代培养及其鉴定
VSMCs原代培养及其鉴定结果如图1所示。
2.2 PERK-siRNA在高糖诱导VSMCs向成骨样细胞转分化中的作用
2.2.1 各组VSMCs Cbfα-1,ALP,BGP,α-SMA mRNA的表达变化 PCR结果显示,高糖处理后,相对于正常对照组、甘露醇组和高糖+PERK-siRNA组,Cbfα-1、ALP、BGP mRNA表达升高,差异具有统计学意义(P<0.05);高糖+PERK-siRNA组相对于高糖组和高糖+乱序RNA组,Cbfα-1,ALP,BGP mRNA表达降低,差异具有统计学意义(P<0.05;图2~图4)。各组间α-SMA mRNA表达差异均无统计学意义(P>0.05;图5)。
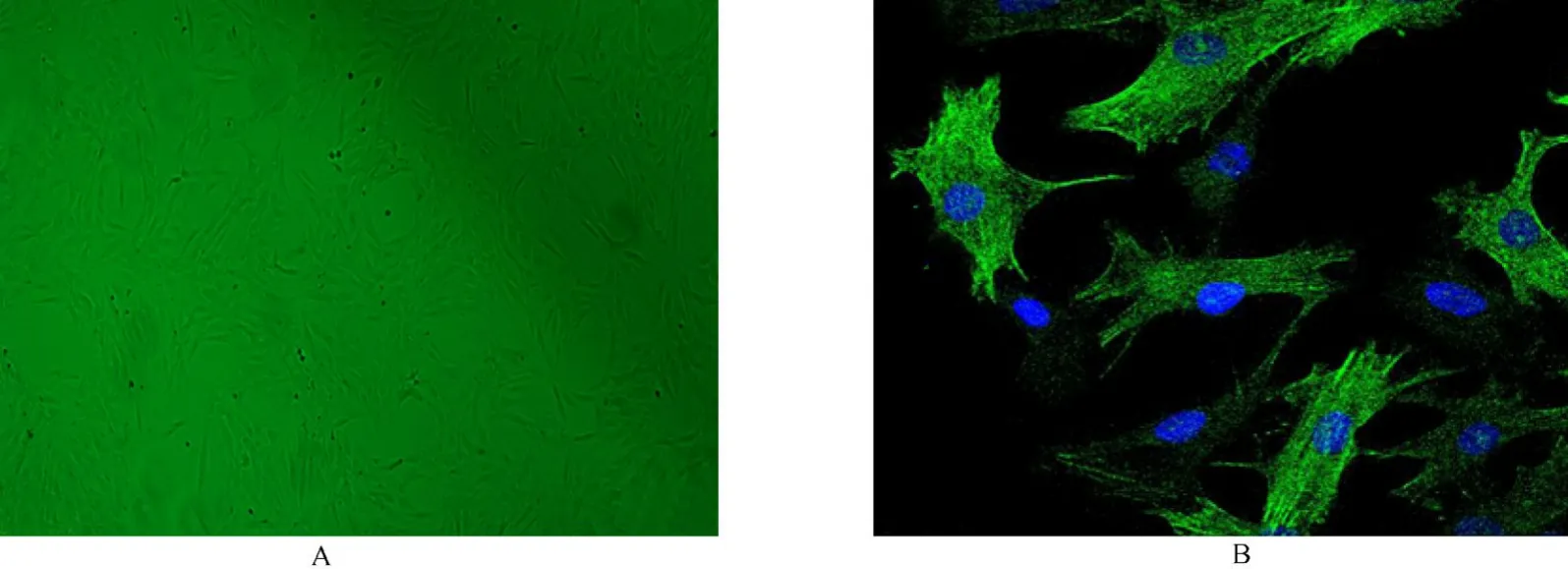
图1 血管平滑肌细胞原代培养及其鉴定Figure 1 Primary culture and identification of vascular smooth muscle cells
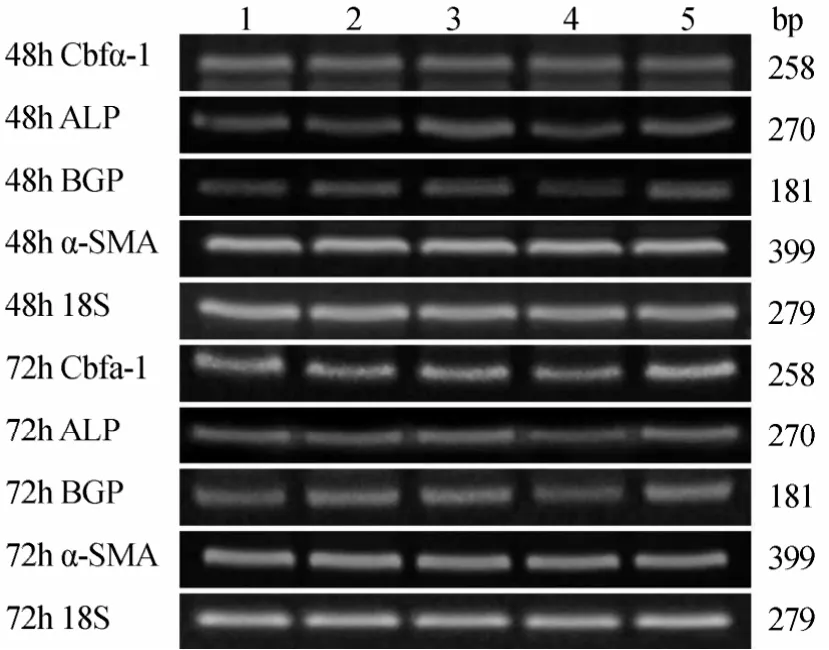
图2 各组细胞作用不同时间Cbfα-1,ALP,BGP和α-SMA mRNA的表达情况Figure 2 Expression of Cbfα-1, ALP, BGP and α-SMA mRNA in five groups at different time points
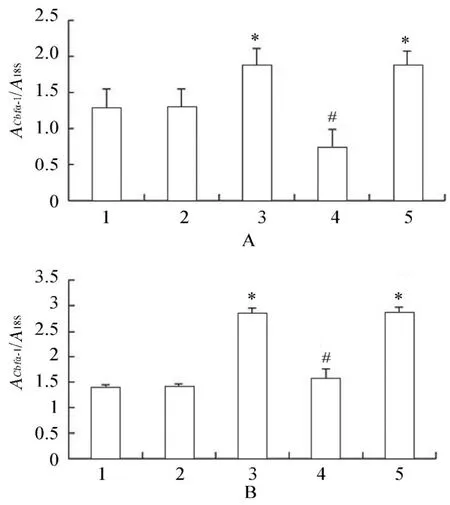
图3 各组细胞作用不同时间Cbfα-1 mRNA的表达情况Figure 3 Expression of Cbfα-1 mRNA in five groups at different time points(n=3)
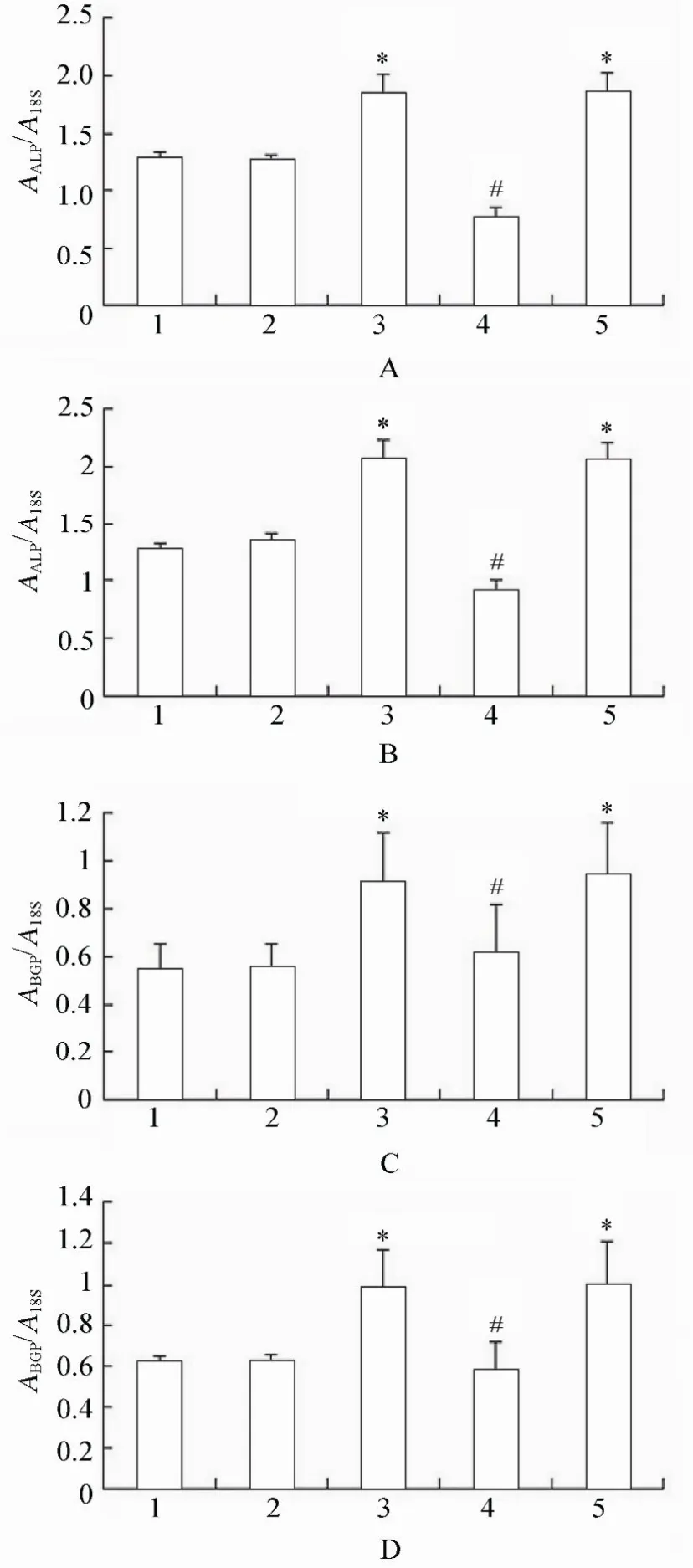
图4 各组细胞作用不同时间ALP mRNA和BGP mRNA的表达情况Figure 4 Expression of ALP mRNA and BGP mRNA in five groups at different time points(n=3)
图5 各组细胞作用不同时间α-SMA mRNA的表达情况Figure 5 Expression of α-SMA mRNA in five groups at different time points(n=3)
2.2.2 各组VSMCs Cbfα-1和α-SMA表达的变化 Western blot结果显示,高糖处理后,相对于正常对照组、甘露醇组和高糖+PERK-siRNA组,Cbfα-1蛋白表达升高,且差异具有统计学意义(P<0.05),高糖+PERK-siRNA组相对于高糖组和高糖+乱序RNA组,Cbfα-1蛋白表达降低,且差异具有统计学意义(P<0.05;图6,图7)。而α-SMA蛋白表达差异均无统计学意义(P>0.05;图8)。
2.3 PERK-siRNA在高糖诱导引起VSMCs内质网应激
2.3.1 各组VSMCs GRP78,PERK,eIF2α,ATF4 mRNA的表达变化 PCR结果显示,高糖处理后,相对于正常对照组、甘露醇组和高糖+PERK-siRNA组,GRP78,PERK,eIF2α和ATF4 mRNA表达升高,且差异具有统计学意义(P<0.05);高糖+PERK-siRNA组相对于高糖组和高糖+乱序RNA组,GRP78,PERK,eIF2α和ATF4 mRNA表达降低,且差异具有统计学意义(P<0.05;图9~图13)。
2.3.2 各组VSMCs GRP78,PERK,p-PERK,eIF2α,p-eIF2α,ATF4蛋白水平表达的变化 PCR结果显示,高糖处理后,相对于正常对照组、甘露醇组和高糖+PERK-siRNA组,GRP78,PERK,p-PERK,eIF2α,p-eIF2α和ATF4蛋白表达升高,且差异具有统计学意义(P<0.05);高糖+PERK-siRNA组相对于高糖组和高糖+乱序RNA组,GRP78,PERK,p-PERK,eIF2α,p-eIF2α和ATF4蛋白表达降低,且差异具有统计学意义(P<0.05;图14~图16,图17~图20)。

图6 各组细胞作用不同时间Cbfα-1和α-SMA蛋白的表达情况Figure 6 Expression of Cbfα-1 and α-SMA protein in five groups at different time points
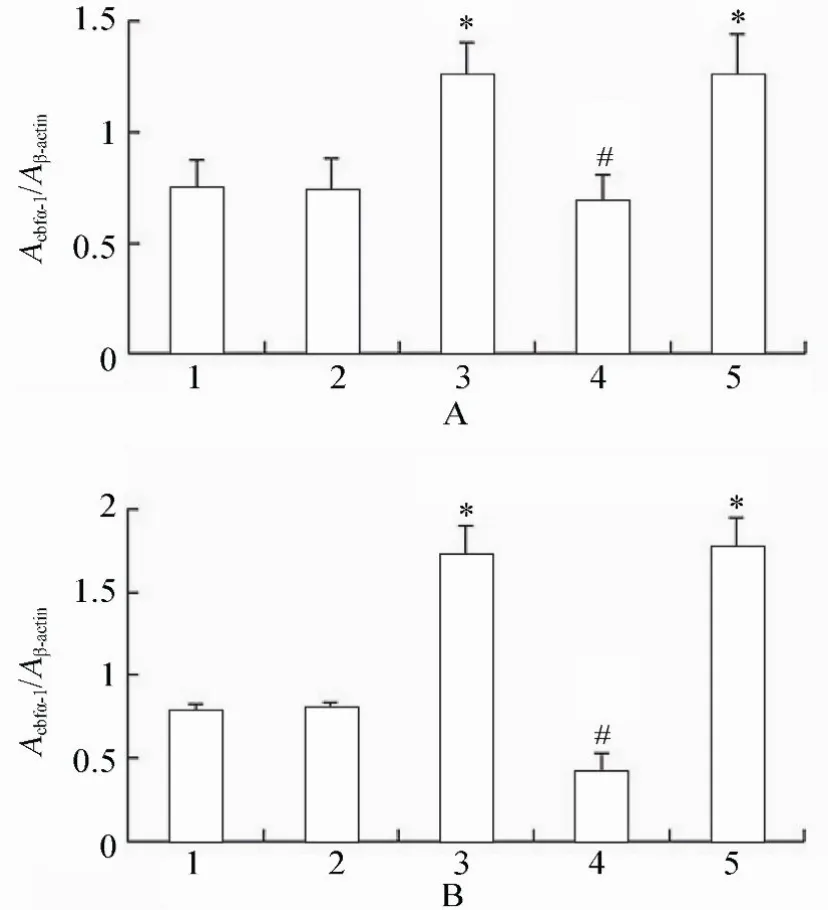
图7 各组细胞作用不同时间Cbfα-1蛋白的表达情况Figure 7 Expression of Cbfα-1 protein in five groups at different time points(n=3)
图8 各组细胞作用不同时间α-SMA蛋白的表达情况Figure 8 Expression of α-SMA protein in five groups at different time points(n=3)

图9 各组细胞作用不同时间GRP78,PERK,eIF2α和ATF4 mRNA的表达情况Figure 9 Expression of GRP78, PERK, eIF2α and ATF4 mRNA in five groups at different time points
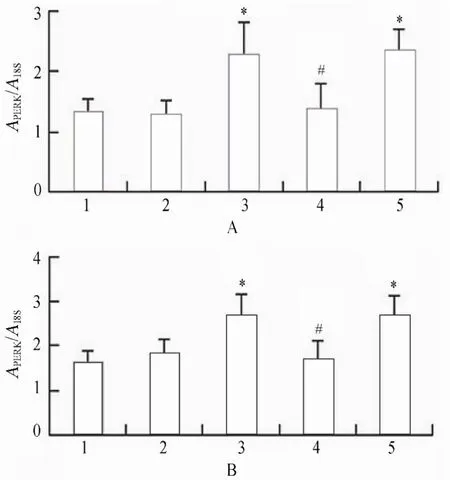
图10 各组细胞作用不同时间PERK mRNA的表达情况Figure 10 Expression of PERK mRNA in five groups at different time points(n=3)
2.4 各组VSMCs ALP活性检测
ALP检测结果显示,高糖处理后,相对于正常对照组、甘露醇组和高糖+PERK-siRNA组,ALP活性差异具有统计学意义(P<0.05);高糖+乱序RNA相对于正常对照组、甘露醇组和高糖+PERK-siRNA组,ALP活性差异具有统计学意义(P<0.05;表2)。
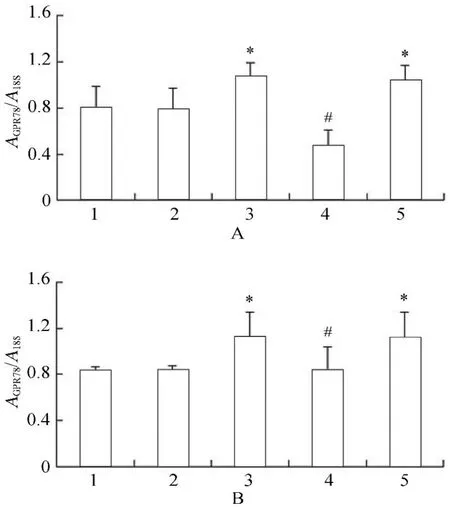
图11 各组细胞作用不同时间GRP78 mRNA的表达情况Figure 11 Expression of GRP78 mRNA in five groups at different time points(n=3)
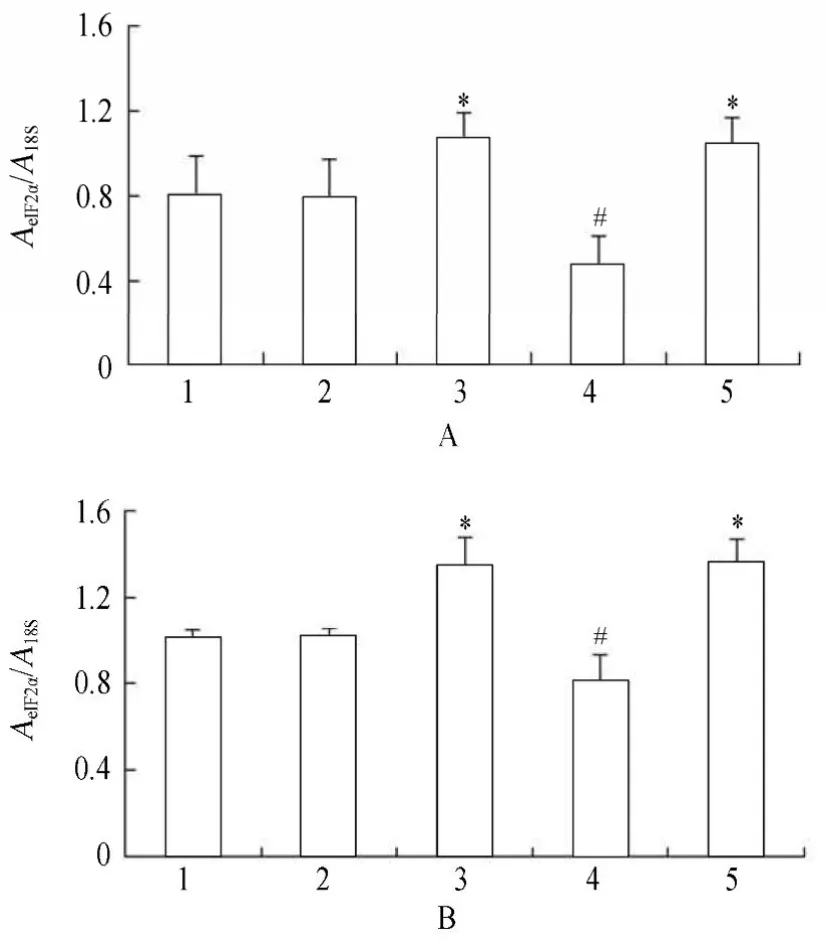
图12 各组细胞作用不同时间eIF2α mRNA的表达情况Table 12 Expression of eIF2α mRNA in five groups at different time points (n=3)
3 讨 论
血管钙化是钙盐沉积在血管壁的一个主动的过程,和骨形成有许多相似之处。VSMCs发生表型转换在血管钙化中发挥重要作用,VSMCs的成骨样细胞表型一经形成,钙化促进因子Cbfα-1就会在血管平滑肌表达升高,Cbfα-1是成骨细胞标志性分子,其出现也标志着血管钙化的起始步骤[8]。血管钙化也和抑制血管钙化的因子减少有关,这些因子包括:无机焦磷酸盐、基质Gla蛋白、骨桥蛋白、骨保护素、胎球蛋白、Smad6等[8]。
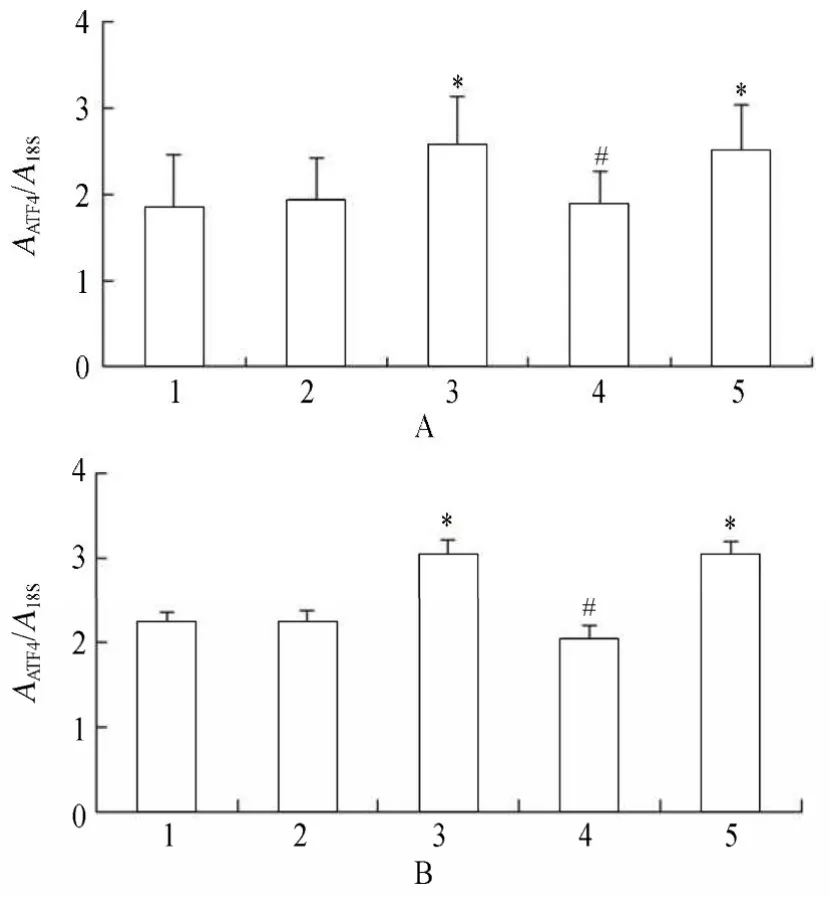
图13 各组细胞作用不同时间ATF4 mRNA的表达情况Table 13 Expression of ATF4 mRNA in five groups at different time points(n=3)
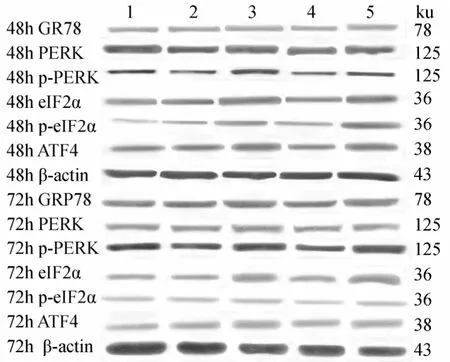
图14 各组细胞作用不同时间GRP78,PERK,p-PERK,eIF2α,p-eIF2α和ATF4蛋白的表达情况Figure 14 Expression of GRP78, PERK, p-PERK, eIF2α, p-eIF2α and ATF4 protein in five groups at different time points
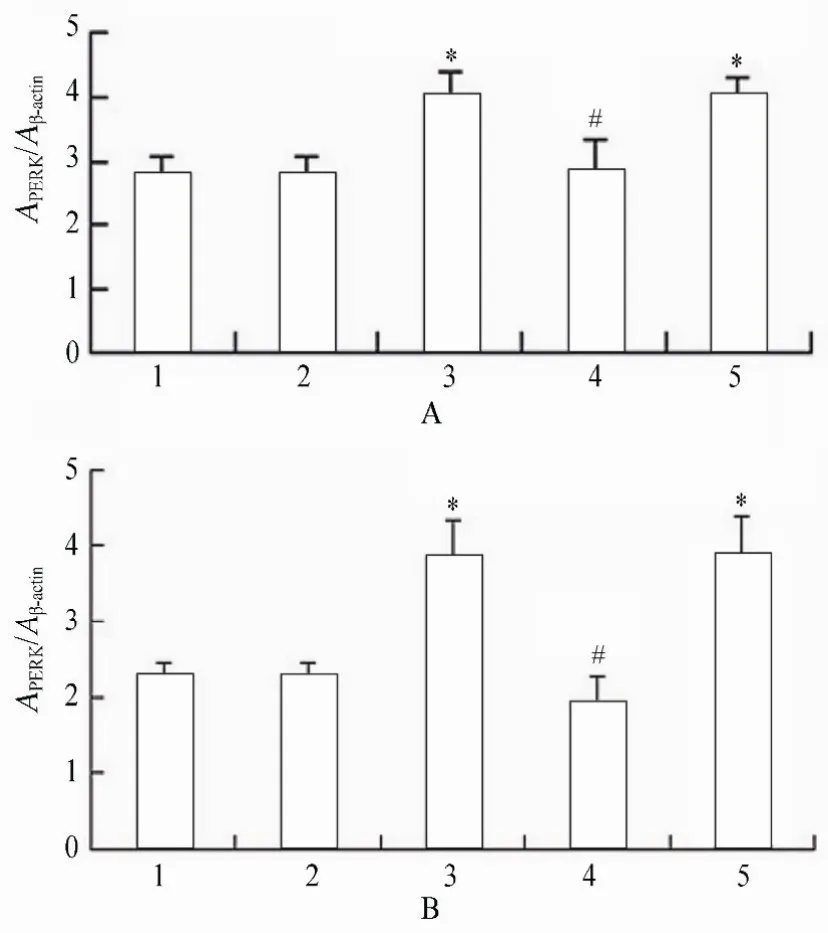
图15 各组细胞作用不同时间PERK蛋白的表达情况Figure 15 Expression of PERK protein in five groups at different time points(n=3)
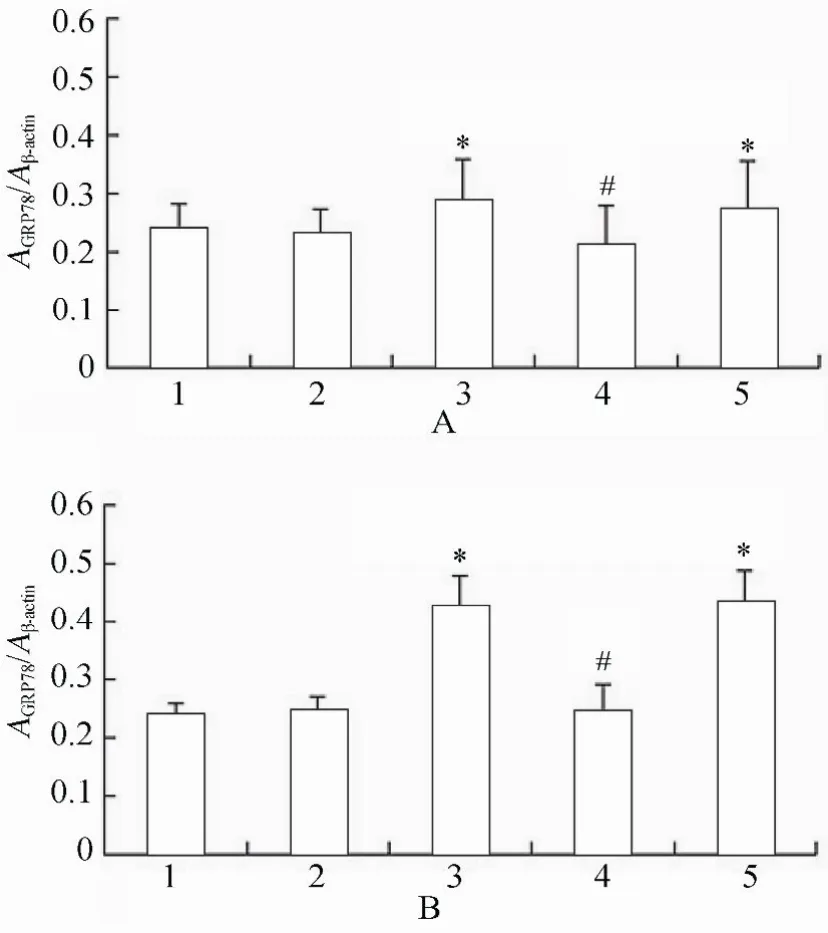
图16 各组细胞作用不同时间GRP78蛋白的表达情况Figure 16 Expression of GRP78 protein in five groups at different time points(n=3)
许多刺激因素可以导致VSMCs转分化,如高糖、糖基化终末产物、高磷、碱性成纤维细胞生长因子、硬脂酸盐、氧化应激、氧化低密度脂蛋白、维生素D等[1,9−11]。本研究中发现高糖刺激可以通过内质网应激PERK途径使VSMCs向成骨样细胞转分化,VSMCs表达成骨样细胞标志物Cbfα-1,BGP,ALP升高,内质网应激PERK通路激活。内质网应激PERK分子在发育过程中扮演重要角色,其功能缺失突变在人和小鼠会导致新生个体发育缺陷,如糖尿病、生长迟滞和多部位骨骼发育异常[12,13]。体外研究表明,内质网应激PERK途径在骨组织和骨细胞发育成熟中起重要作用[14]。
在体外培养和一些心血管病理生理过程中,VSMCs会经历表型转化。它们与其他肌细胞不同,是一种非终末分化细胞[14]。VSMCs是由间胚层分化发育而来,对于血管的收缩和舒张有着十分重要的作用。Cbfα-1又称为Runx2,是成骨细胞发育分化的掌控因子,在骨形成中起关键作用,其在血管平滑肌细胞中表达升高被认为是向成骨样细胞分化的明确的早期标志[15]。Cbfα-1控制着其下游与成骨细胞发育分化有关的蛋白分子,如BGP、骨桥蛋白(osteopontin)和Ⅰ型胶原[16]。
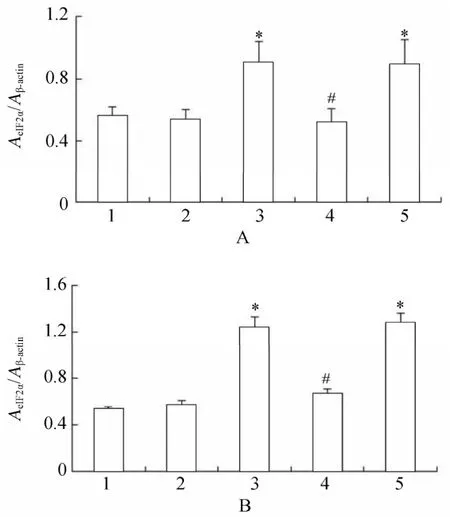
图17 各组细胞作用不同时间eIF2α蛋白的表达情况Table 17 Expression of eIF2α protein in five groups at different time points(n=3)
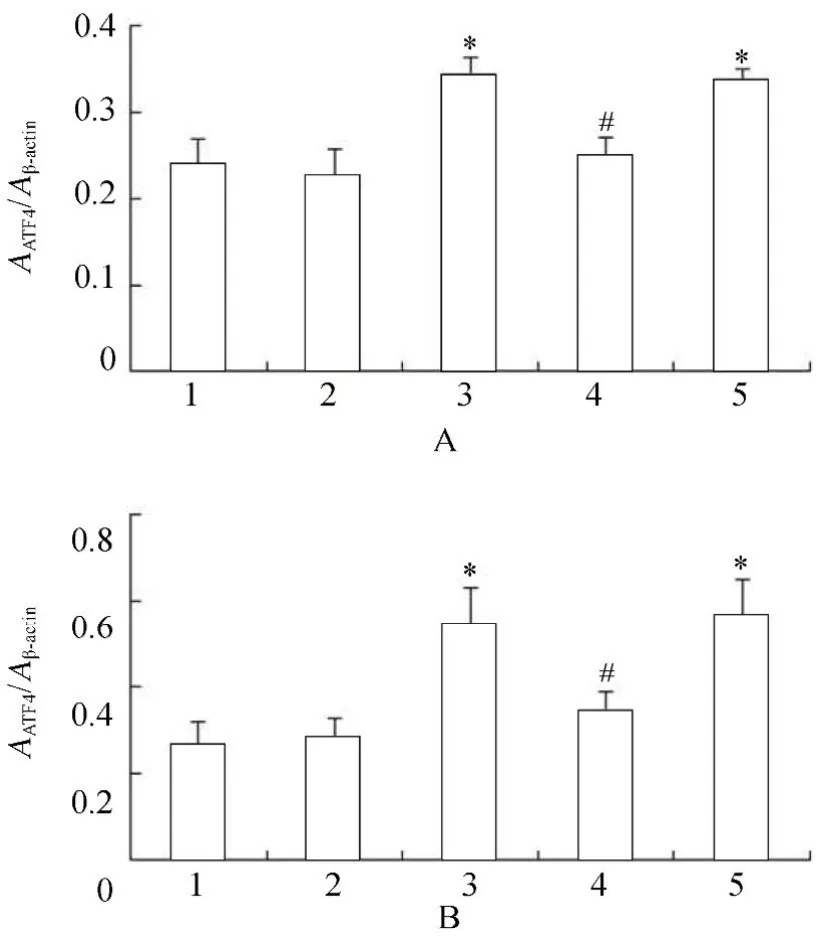
图18 各组细胞作用不同时间ATF4蛋白的表达情况Table 18 Expression of ATF4 protein in five groups at different time points(n=3)
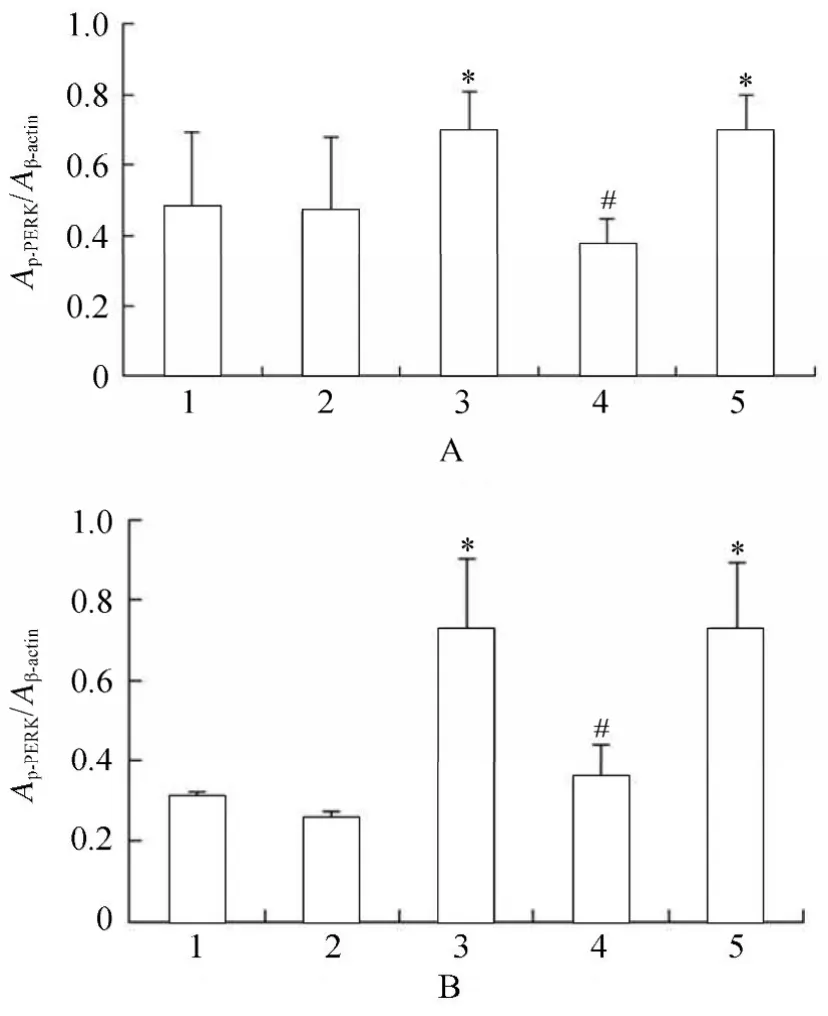
图19 各组细胞作用不同时间p-PERK蛋白的表达情况Table 19 Expression of p-PERK protein in five groups at different time points (n=3)
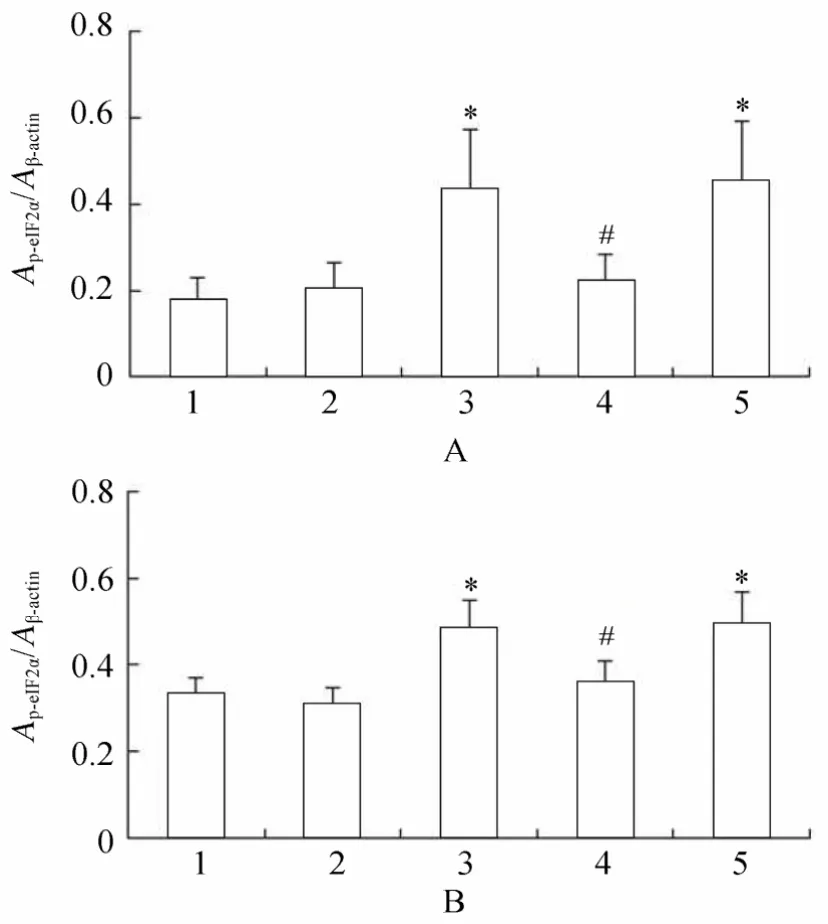
图20 各组细胞作用不同时间p-eIF2α蛋白的表达情况Table 20 Expression of p-eIF2α protein in five groups at different time points(n=3)
本实验中我们用RNA干扰(RNA intenference,RNAi)技术干扰PERK的表达,成功地使其在高糖环境刺激下mRNA和蛋白质水平表达降低,其激活形式——磷酸化的PERK也降低,同时其下游eIF2α在mRNA和蛋白水平也降低,磷酸化的eIF2α表达也下降,成骨样细胞的标志物Cbfα-1和BGP表达下降,ALP mRNA表达也下降。VSMCs在高糖刺激下,PERK-siRNA干预后其ALP活性下降。作为阴性对照的乱序RNA处理组同高糖组相比未见明显差异。甘露醇组和正常对照组相比,未引起内质网应激PERK途径表达改变,也未见成骨样细胞标志表达变化。
表2 各组细胞作用不同时间ALP活性检测Table 2 The activity test of ALP in five groups at different time points(n=3, U/g protein, ±s)
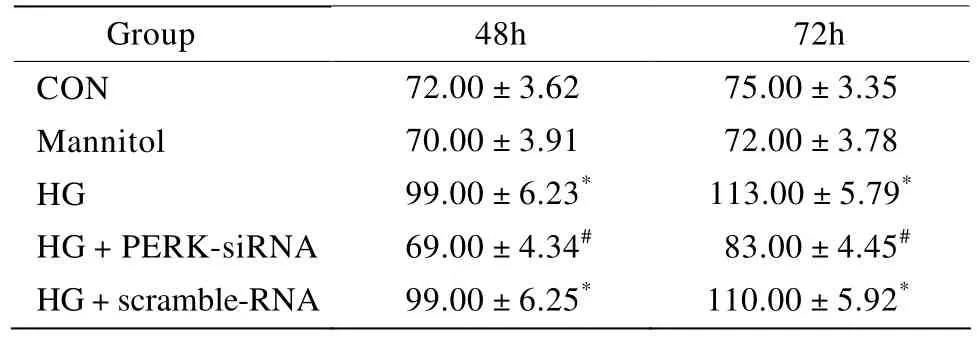
表2 各组细胞作用不同时间ALP活性检测Table 2 The activity test of ALP in five groups at different time points(n=3, U/g protein, ±s)
CON: normal control group; Mannitol: mannitol group; HG: high glucose group; HG+PERK-siRNA: high glucose+PERK-siRNA group; HG+scramble RNA: high glucose+scramble RNA group.Compared with CON, Mannitol, HG+PERKsiRNA groups, *P<0.05;compared with HG, HG+scramble RNA groups, #P<0.05
Group 48h 72h CON 72.00±3.62 75.00±3.35 Mannitol 70.00±3.91 72.00±3.78 HG 99.00±6.23* 113.00±5.79*HG+PERK-siRNA 69.00±4.34# 83.00±4.45#HG+scramble-RNA 99.00±6.25* 110.00±5.92*
血管钙化的确切机制目前仍不十分清楚,但迄今认为其不是一个被动的钙盐沉积的过程,而是一个主动的、和骨形成有许多形似之处的可调控的过程。VSMCs向成骨样细胞转分化这一细胞学行为在血管钙化的发生中发挥重要作用。血管钙化的关键问题是VSMCs由收缩表型向成骨样细胞表型转化,而细胞表型转化是细胞生物学的重大科学问题[17]。本实验利用RNAi技术敲低PERK,成功阐明了内质网应激PERK途径在高糖诱导VSMCs向成骨样细胞转分化过程中发挥作用,并且干预PERK可以抑制这一转分化的细胞生物学过程,有助于对血管钙化这一病理生理现象进行干预,可以作为血管钙化早期预防的靶点。
【参考文献】
[1]Johnson RC, Leopold JA, Loscalzo J.Vascular calcification: pathobiological mechanisms and clinical implications[J].Circ Res, 2006, 99(10): 1044−1059.
[2]Abedin M, Tintut Y, Demer LL.Vascular calcification:mechanisms and clinical ramifications[J].Arterioscler Thromb Vasc Biol, 2004, 24(7): 1161−1170.
[3]Shao JS, Cai J, Towler DA.Molecular mechanisms of vascular calcification: lessons learned from the aorta[J].Arterioscler Thromb Vasc Biol, 2006, 26(7): 1423−1430.
[4]Steitz SA, Speer MY, Curinga G,et al.Smooth muscle cell phenotypic transition associated with calci fi cation:upregulation of Cbfa1 and downregulation of smooth muscle lineage markers[J].Circ Res, 2001, 89(12):1147−1154.
[5]Chen NX, Duan D, O’Neill KD,et al.High glucose increases the expression of Cbfa1 and BMP-2 and enhances the calcification of vascular smooth muscle cells[J].Nephrol Dial Transplant, 2006, 21(12):3435−3442.
[6]Werstuck GH, Khan MI, Femia G,etal.Glucosamine-induced endoplasmic reticulum dysfunction is associated with accelerated atherosclerosis in a hyperglycemic mouse model[J].Diabetes, 2006, 55(1):93−101.
[7]Back SH, Kaufman RJ.Endoplasmic reticulum stress and type 2 diabetes[J].Annu Rev Biochem, 2012, 81:767−793.
[8]Trion A, van der Laarse A.Vascular smooth muscle cells and calci fi cation in atherosclerosis[J].Am Heart J, 2004,147(5): 808−814.
[9]Chen ZJ, Huang SM, Fan WX,et al.Effects of high glucose on expression of core binding factor alpha1 and osteocalcin in vascular smooth muscle cells[J].J Sichuan Univ(Med Sci Ed), 2010,41(5): 784−788.[陈泽君,黄颂敏, 樊文星, 等.高糖刺激血管平滑肌细胞表达cbfα-1和 OC 的实验研究[J].四川大学学报(医学版),2010, 41(5): 784−788.]
[10]Ren X, Shao H, Wei Q,et al.Advanced glycation end-products enhance calcification in vascular smooth muscle cells[J].J Int Med Res, 2009, 37(3): 847 −854.
[11]Sage AP, Tintut Y, Demer LL,et al.Regulatory mechanisms in vascular calcification[J].Nat Rev Cardiol,2010, 7(9): 528−536.
[12]Saito A, Ochiai K, Kondo S,et al.Endoplasmic reticulum stress response mediated by the PERK-eIF2-ATF4 pathway is involved in osteoblast differentiation induced by BMP2[J].J Biol Chem, 2011, 286(6): 4809−4818.
[13]Wei J, Sheng X, Feng D,et al.PERK is essential for neonatal skeletal development to regulate osteoblast proliferation and differentiation[J].J Cell Physiol, 2008,217(3): 693−707.
[14]Iyemere VP, Proudfoot D, Weissberg PL,et al.Vascular smooth muscle cell phenotypic plasticity and the regulation of vascular calcification[J].J Intern Med, 2006,260(3): 192−210.
[15]Johnson RC, Leopold JA, Loscalzo J.Vascular calcification pathobiological mechanisms and clinical implications[J].Circ Res, 2006, 99(10): 1044−1059.
[16]Xiao G, Jiang D, Ge C,et al.Cooperative interactions between activating transcription factor 4 and Runx2/Cbfa1 stimulate osteoblast-specific osteocalcin gene expression[J].J Biol Chem, 2005, 280(35):30689−30696.
[17]Qi YF, Tang CS.Angiosteosis—the common pathological and physiological basis of vascular injury diseases[J].Med Sci J Cent South China, 2011, 39(3): 241−245.[齐永芬, 唐朝枢.血管钙化——血管损伤性疾病的共同病理生理基础[J].中南医学科学杂志, 2011, 39(3):241−245.]
