地西他滨加改良CAG方案联合人白细胞抗原半相合淋巴细胞输注治疗老年急性髓系白血病缓解1例
2014-05-15冯少美王志红杨清明
冯少美,王志红,靖 彧,杨清明*
(1解放军总医院第一附属医院老年肿瘤血液科 北京 100048;2解放军总医院血液科,北京 100853)
1 病例摘要
患者,男,62岁,于2008年8月发现白细胞(white blood cell,WBC)及血小板(platelet,PLT)减低,未经治疗。2010年9月出现乏力、气短症状,就诊于天津血液病研究所。经血液、骨髓、染色体等多项检查,诊断为骨髓增生异常综合征(myelodysplastic syndrome,MDS),未做任何治疗。2012年3月患者因乏力、憋气症状加重,入我院治疗。实验室检查:骨髓增生极度低下,原始粒细胞占4%。基因检测:WT1,EVI1,MN1基因均有不同程度表达增高(中度)。染色体检查结果:46,XY[20]。诊断:MDS。给予氨磷汀(阿米福汀,amifostine)等药物治疗。2012年9月,复查血常规三系减低加重:WBC 1.4×109/L,中性粒细胞(neutrophils,NEUT)0.1×109/L,血红蛋白(hemoglobin,HB)47g/L,PLT 23×109/L。骨髓涂片,骨髓增生减低,原始细胞占15%,诊断骨髓增生异常综合征-难治性贫血伴原始细胞增多型-Ⅱ(myelodysplastic syndrome-refractory anemia with excess of blast Ⅱ,MDS-RAEBⅡ),给予地西他滨(decitabine)50mg/d(d1~3)治疗1个疗程,化疗后骨髓抑制,三系细胞持续降低,继发感染、贫血和出血。化疗后30d,患者因粒细胞缺乏,肺部感染,高热,使用粒细胞集落刺激因子(granulocyte- colony stimulating factor,G-CSF)300U皮下注射1次/d至化疗后41d(2012年11月5日)。2012年11月初粒细胞缺乏短暂缓解,但用G-CSF后,粒细胞再次下降。2012年10月23日骨髓检查,原始细胞消失,但细胞增生极度低下。2012年11月7日骨髓检查,骨髓仍增生极度低下,原始粒细胞占4.5%。开始第2周期地西他滨化疗,剂量50mg/d(d1~3)。此后外周血像持续降低,间断输红细胞、PLT,化疗后60d血像不恢复。2013年1月5日复查骨髓穿刺,骨髓增生低下,原始细胞占7%,2013年1月8日开始给予第3周期地西他滨单药化疗,剂量同前,治疗后血像无改善。各周期化疗后WBC,NEUT,HB,PLT变化见图1。
入院查体贫血貌,精神差,心肺查体无阳性体征。
治疗经过2013年3月15日复查血常规:WBC 1.0×109/L,NEUT 0.1×109/L,HB 63g/L,PLT 16×109/L。骨髓检查,细胞增生减低–极度低下,原始细胞占23%,诊断MDS转化为急性髓系白血病(acute myeloblastic leukemia,AML)。2013年3月23日开始给予地西他滨+阿糖胞苷、阿克拉霉素和粒细胞集落刺激因子(cytarabine,aclacinomycin and granulocyte-colony stimulating factor,CAG)+淋巴细胞输注治疗,具体方案:地西他滨20mg/m2静滴1次/d(d1~5),阿糖胞苷20mg,静滴每12h 1次(d1~5),阿克拉霉素20mg静滴隔日1次(d1,3,5),重组人G-CSF 300µg皮下注射1次/d至WBC 2×109/L以上,于化疗结束后36h输注患者儿子未经动员外周血单个核细胞0.54×108/kg。2013年4月1日因进食不洁饮食,发生恶心呕吐、腹泻及高热。给予抗感染治疗,1d后体温恢复正常,恶心呕吐及腹泻停止。2013年4月12日细胞输注14d,NEUT和PLT开始升高,2013年4月14日于细胞输注16d,NEUT明显增多,绝对值>0.5×109/L;2013年4月15细胞输注17d,复查骨髓,原始细胞占1.5%,三系细胞均增生活跃,骨髓缓解。2013年4月23日查血常规:WBC 4.3×109/L,NEUT 3.2×109/L,HB 93g/L,PLT 137×109/L。患者症状、体征消失,病情完全缓解。化疗后WBC,NEUT,HB,PLT变化见图1(注:本次治疗标注4)。
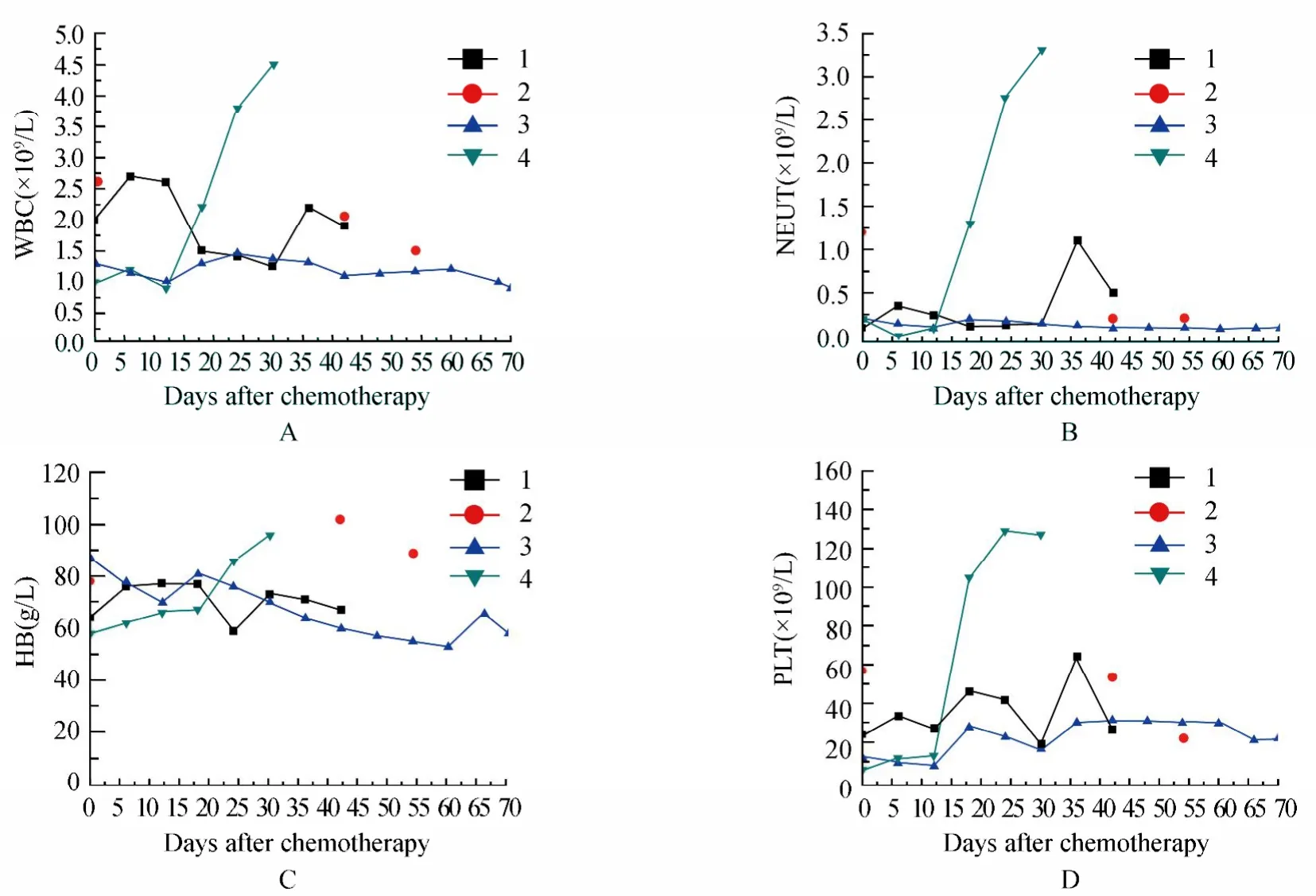
图1 化疗后血像改变Figure 1 Changes in hemogram after chemotherapy
2 临床病理讨论
冯少美经治医师MDS和老年AML预后不良,长期以来没有标准的治疗方案,传统化疗难以有效杀灭或抑制肿瘤细胞,并且患者的骨髓抑制期相当长,由此带来的出血、感染等风险常成为老年患者临床死亡原因。而单纯输血、抗感染等支持治疗,中位存活时间仅有2~3个月[1,2]。减低预处理剂量的异基因移植是治疗老年高危的MDS和AML的方法,但这种方法受供者少和不能普遍开展的限制,仍需要我们寻求其他有效又能适用于老年MDS和AML患者的治疗方法。
王志红主管医师肿瘤表观遗传学研究证实,AML发病与患者体内肿瘤细胞中常伴有抑癌基因启动子异常超甲基化相关,抑癌基因启动子异常超甲基化可导致抑癌基因转录沉默,促进肿瘤的发生[3−6]。地西他滨作为一种表观遗传学调控药物,小剂量通过抑制DNA甲基转移酶发挥去甲基化作用,从而逆转在肿瘤中因DNA高甲基化所导致的基因表达沉默,逆转细胞肿瘤化的进程[6,7]。高剂量地西他滨治疗,可直接杀伤白血病细胞,治疗高龄MDS患者可获得20%~40%的缓解率,在白血病、特别是老年MDS和AML患者治疗中,地西他滨的价值已逐渐为人们所关注并认可[7−10]。国内有研究采用小剂量的CAG方案联合地西他滨(达珂)治疗老年AML,缓解率达到72%,58%达到完全缓解,疗效明显超越单纯CAG方案[11]。但地西他滨仍有一些副作用,特别是骨髓抑制时间长,常常导致患者感染和出血。此例应用半相合淋巴细胞输注既缩短了化疗的骨髓抑制期,减少了感染出血的发生,又使患者获得了缓解,取得了良好的效果。
靖彧教授细胞免疫治疗是指通过输注免疫效应细胞达到恢复与增强患者自身的免疫监测功能,发挥杀灭患者体内肿瘤细胞的效果,特异性较强,副作用较轻。有研究发现,在化疗后应用单倍体供者淋巴细胞治疗老年急性白血病和MDS患者,有效改善了老年患者生存质量,延长存活时间,且移植物抗宿主病发生率低,安全性高[12]。另有研究显示单倍体移植的移植物抗肿瘤效应要强于同胞相合移植[13]。
杨清明主任本例患者病史较长,虽然经过3个周期地西他滨治疗,骨髓原始细胞未能稳定控制,且治疗后骨髓抑制期长,数次并发感染和出血,最终转化为白血病。我科结合以上临床实验与研究,给予地西他滨加改良CAG方案联合人白细胞抗原单倍体供者淋巴细胞输注治疗,首先使病情得到了有效控制,经过1个疗程骨髓缓解,造血功能恢复,并且缩短化疗相关的骨髓抑制期,减少感染和出血的风险。分析其骨髓缓解原因:本例患者MDS转化为AML前,曾经给予3个周期单药地西他滨治疗,第1疗程治疗后30d骨髓未见原始细胞,但增生极度低下,直至41d,骨髓原始细胞上升至4.5%,骨髓仍为造血极度低下状态。第2疗程结束至第3周期开始,历经56d,骨髓仍为增生低下,原始细胞上升至7%。第3疗程后,骨髓同样经过70d迟迟不能恢复造血,并且原始细胞升高至23%,转化为AML。单药地西他滨使用过程中,累积剂量增加不仅未见疗效,且原始细胞逐渐升高,并且最终转化为AML。本次使用地西他滨+CAG+淋巴细胞回输后14d,NEUT和PLT开始升高,16d时NEUT绝对值>0.5×109/L;17d时复查骨髓,原始细胞占1.5%,三系细胞均增生活跃。AML缓解原因,考虑与地西他滨累积剂量作用相比,联合CAG增加疗效及淋巴细胞的抗肿瘤作用起效可能性更大。骨髓抑制期较前3个疗程明显缩短的原因,可能与本疗程治疗达到缓解,骨髓恢复造血有关。但患者第1疗程单药地西他滨使用后,骨髓原始细胞由治疗前的13%下降至治疗后原始细胞消失,骨髓造血始终未恢复,因此考虑本次治疗联合半相合外周血淋巴细胞输注,促进了患者本身造血恢复。细胞输注不但提高疗效,而且促进患者骨髓造血恢复,减少了感染出血的风险,这对老年人群的MDS和AML有重要意义,因此我们的治疗方案值得进一步探讨,今后将增加病例、完善相关措施。希望通过继续不断实践及探索,为老年白血病及MDS患者找到一条生存之路。
【参考文献】
[1]Cashen AF, Schiller GJ, O’Donnell MR,et al.Multicenter,phase Ⅱ study of decitabine for the first-line treatment of older patients with acute myeloid leukemia[J].J Clin Oncol, 2010, 28(4): 556−561.
[2]Lübbert M, Suciu S, Baila L,et al.Low-dose decitabineversusbest supportive care in elderly patients with intermediate- or high-risk myelodysplastic syndrome(MDS) ineligible for intensive chemotherapy: final results of the randomized phase Ⅲ study of the European Organisation for Research and Treatment of Cancer Leukemia Group and the German MDS Study Group[J].J Clin Oncol, 2011, 29(15): 1987−1996.
[3]Issa JP, Baylin SB, Herman JG.DNA methylation changes in hematologic malignancies: biologic and clinical implications[J].Leukemia, 1997, 11 (Suppl 1): S7−S11.
[4]Santini V, Kantarjian HM, Issa JP.Changes in DNA methylation in neoplasia: pathophysiology and therapeutic implications[J].Ann Intern Med, 2001, 134(7):573−586.
[5]Leone G, Teofili L, Voso MT,et al.DNA methylation and demethylating drugs in myelodysplastic syndromes and secondary leukemias[J].Haematologica, 2002, 87(12):1324−1341.
[6]Plumb JA, Strathdee G, Sludden J,et al.Reversal of drug resistance in human tumor xenografts by 2’-deoxy-5-azacytidine-induced demethylation of the hMLH1 gene promoter[J].Cancer Res, 2000, 60(21):6039−6044.
[7]Qin T, Youssef EM, Jelinek J,et al.Effect of cytarabine and decitabine in combination in human leukemic cell lines[J].Clin Cancer Res, 2007, 13(14): 4225−4232.
[8]Issa JP, Kantarjian HM.Targeting DNA methylation[J].Clin Cancer Res, 2009, 15(12): 3938−3946.
[9]Niitsu N, Hayashi Y, Sugita K,et al.Sensitization by 5-aza-2’-deoxycytidine of leukaemia cells with MLL abnormalities to induction of differentiation by all-trans retinoic acid and 1alpha, 25-dihydroxyvitamin D3[J].Br J Haematol, 2001, 112(2): 315−326.
[10]Lübbert M, Rüter BH, Claus R,et al.A multicenter phaseⅡ trial of decitabine as first-line treatment for older patients with acute myeloid leukemia judged unfit for induction chemotherapy[J].Haematologica, 2012, 97(3):393−401.
[11]Qian SX, Li JY, Tian T,et al.Effect of low-dose cytarabine and aclarubicin in combination with granulocyte colony-stimulating factor priming (CAG regimen) on the outcome of elderly patients with acute myeloid leukemia[J].Leuk Res, 2007, 31(10):1383−1388.
[12]Guo M, Hu KX, Yu CL,et al.Infusion of HLA-mismatched peripheral blood stem cells improves the outcome of chemotherapy for acute myeloid leukemia in elderly patients[J].Blood, 2011, 117(3): 936−941.
[13]Wang Y, Liu DH, Xu LP,et al.Superior graft-versus-leukemia effect associated with transplantation of haploidentical compared with HLA-identical sibling donor grafts for high-risk acute leukemia: an historic comparison[J].Biol Blood Marrow Transplant, 2011, 17(6):821−830.
