产油脂酵母菌株的筛选及发酵条件的初步研究
2014-05-14郝玉芹
李 艾,郝玉芹
(唐山学院a.环境与化学工程系;b.基础教学部,河北 唐山063000)
随着人类生活水平的提高和工业的迅猛发展,人们对油脂的需求量逐步增大,传统的油脂来源如植物油脂和动物油脂已不能满足需求,因此,开发新的油脂资源成为必然趋势[1]。微生物油脂是继植物油脂、动物油脂之后开发出来的又一人类食用油脂新资源。微生物油脂又称单细胞油脂,是由霉菌、酵母菌、细菌和藻类等微生物在一定的条件下利用碳氢化合物、碳水化合物和普通油脂作为碳源、氮源而合成的油脂。它主要是由不饱和脂肪酸组成的甘油三酯[2],与一般植物油脂有相似的脂肪酸组成,脂肪酸多以C16,C18为主。与动植物油生产相比,微生物油脂生产具有适应性强、生长周期较短、生长所需原料丰富,同时不受场地、季节、气候变化等因素限制等优点,且生产工艺较简单,开发潜力大,适宜进行连续化大规模的工业生产和开发。微生物油脂在解决各国油脂原料供应问题,以及人类能源和环境问题将会发挥越来越重要的作用。研究表明,利用微生物发酵生产油脂是开拓油脂新资源的一条有效途径[3],我国也一直将筛选优良的高产油脂酵母菌株作为科研的重点。由于同一种微生物在不同的培养条件下,其产油量和油脂成分不尽相同[4],因此,优化微生物的发酵条件对进一步探索微生物的油脂积累具有重要的意义。
本实验拟对14份土样和7株实验室保藏菌株进行初筛、摇瓶复筛,以便得到1株油脂产量较高的酵母菌,继而再以该菌株为材料,在摇瓶水平上对影响油脂积累的发酵条件进行研究。
1 材料与方法
1.1 材料的选取和制备
分离材料:取自不同地区的菜地、修车厂等附近的土样共14份及实验室保藏酵母菌7株。
染液的配制。苏丹黑B液:称取苏丹黑B 0.5 g,溶于100 m L70%的酒精中,搅拌使其充分溶解。番红染液:量取2.5%番红酒精液10 mL,加100 mL蒸馏水稀释,搅拌使其充分溶解。
培养基的制备。富集培养基(g/L):葡萄糖20,酵母膏10,蛋白胨20,青霉素钠0.06。YEPD培养基(g/L):葡萄糖20,酵母粉10,蛋白胨10,p H值自然。固体培养基在YEPD基础上加入1.5%琼脂。液体种子培养基:同YEPD培养基。发酵基础培养基(g/L):葡萄糖40,酵母粉0.5,KH2PO41.0,MgSO4·7H2O 0.5,p H 值自然,在此培养基的基础上,对氮源进行调整以优化油脂酵母生长条件。
种子液的制备。从保藏的菌种斜面上取一环菌体接种于50 mL液体种子培养基中,于28℃,250 r/min摇床培养48 h制备种子培养液。
摇瓶培养条件下的发酵条件优化。设置氮源、发酵周期、接种量3个因素。取5 m L种子液转接至45 m L发酵基础培养基中,于28℃,250 r/min振荡培养96 h后,收集菌体进行分析。
1.2 分析方法
1.2.1 干重法
取一定体积的发酵液于离心管中,在4 000 r/min下离心15 min,弃上清液,得到湿菌体,湿菌体于105℃烘干至恒重得到干菌体,以g(干菌体)/L发酵液表示菌体的生物量[5]。

1.2.2 油脂含量和产量测定
采用索氏抽提法[6]:首先将圆底烧瓶洗净放入105℃烘箱中烘干至恒重,用天平准确称其质量,然后将一定量的干菌体研磨成粉末,用两层滤纸包裹放进索氏抽提器的提取管中,以60~90℃沸程的石油醚为溶剂回流,于90℃水浴中提取3 h左右,菌体内油脂随石油醚进入到平底烧瓶内,回流6~8 h,拆去索氏提取器,换上蒸馏装置,蒸馏回收烧瓶内石油醚。随后将平底烧瓶放在105℃烘箱中烘至恒重,用天平准确称其重量。抽提前后烧瓶的质量差即为所提油脂的重量。

2 结果与讨论
2.1 平板初筛
采集的14份土样和7株实验室保藏的酵母菌,经平板分离和苏丹黑染色后,选取苏丹黑染色深、脂肪粒明显的16株菌株作为摇瓶初筛的初始菌株。最终初筛结果见表1。从表1可以看出,微生物主要集中于潮湿的山底及营养丰富的菜地。这可能是由于不同成分的土壤对微生物生长的影响不同。

表1 平板初筛结果
2.2 摇瓶初筛
将平板初筛所获得的酵母菌株,一株接两瓶进行摇瓶发酵初筛。发酵结束后染色,镜检,观察细胞内脂肪粒的生成情况,从而得到了7株油脂含量较高的菌株并对其编号,结果见表2。

表2 摇瓶初筛油脂含量较高菌株
初筛过程中比较了不同浓度的葡萄糖对酵母产脂的影响,结果见图1。由图1可以看出用葡萄糖含量为40 g/L发酵液的酵母经苏丹黑染色后明显比20 g/L发酵液的着色深,初步确定在摇瓶复筛中发酵液葡萄糖含量为40 g/L。
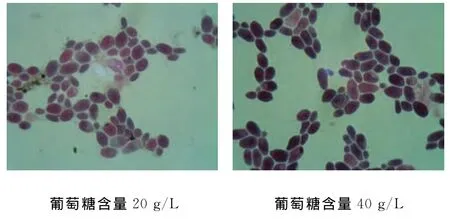
图1 不同葡萄糖含量对同一酵母产脂的影响
2.3 摇瓶复筛
将初筛得到的7株高产菌株摇瓶发酵,收集菌体,用索氏提取器抽提细胞内的油脂并测定其含量,同时测定细胞生物量和残糖,测定结果见表3。由表3可知,3-1号酵母的油脂含量和生物量均最高,因此,选择来自于汽车修理厂的3-1号酵母菌株作为最终筛选出的产油脂较高的菌株,用于酵母菌产油脂最佳发酵条件确定的实验。
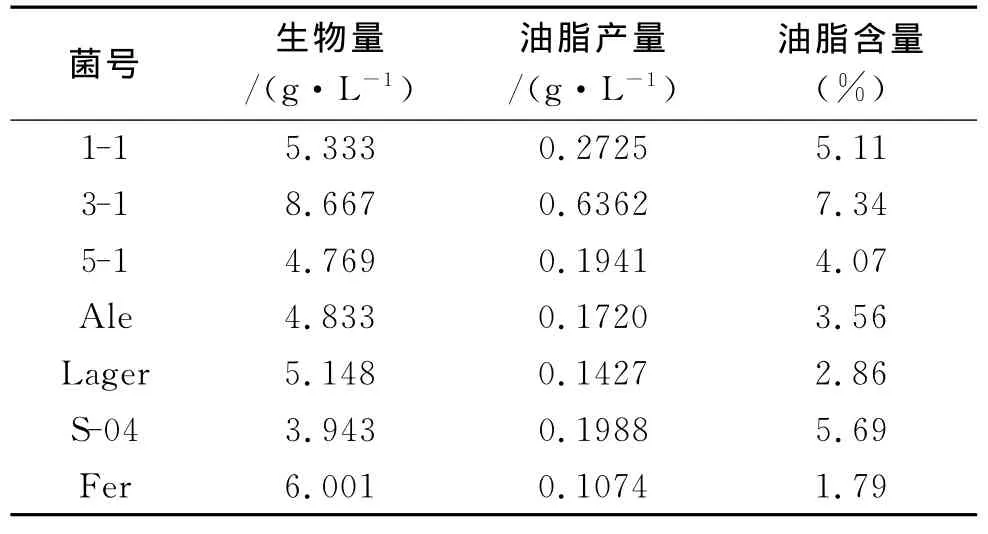
表3 摇瓶复筛菌株指标
2.4 酵母菌产油脂的最佳发酵条件
2.4.1 发酵周期对酵母产油的影响
发酵周期为2 d,3 d,4 d,5 d和6 d,营养物质均相同的情况下,28℃,250 r/min振荡培养,考察发酵周期对菌体生物量和油脂含量的影响,结果见图2。由图2可知,生物量随着培养天数的增加而增加;油脂含量则随天数的增长先上升后下降,在第4 d时油脂含量达到最大值。因此选择发酵周期为4 d。
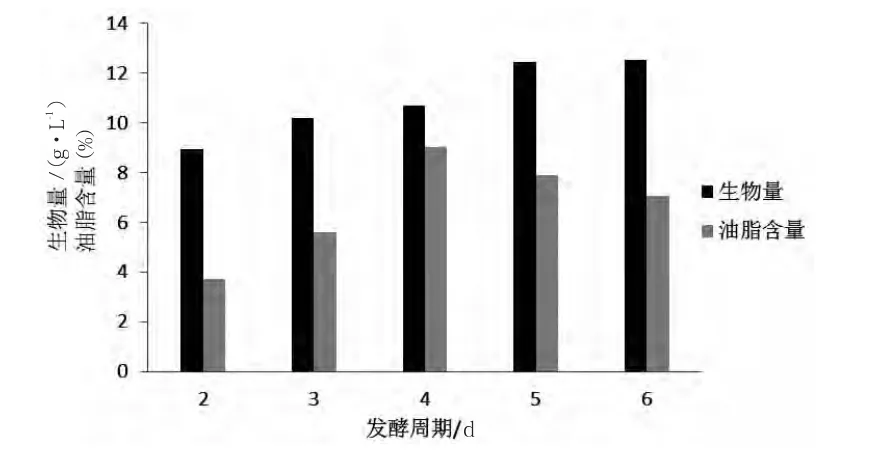
图2 发酵周期对酵母生物量和油脂含量的影响
2.4.2 氮源对酵母产油的影响
分别选择酵母膏、硫酸铵、蛋白胨为氮源,添加量均为0.4%,其他成分均相同,28℃,250 r/min摇瓶发酵4 d,考察氮源对酵母菌生物量和油脂含量的影响,结果见图3。由图3可知,当氮源为酵母膏时,菌体的生物量最高;当氮源为硫酸铵时,酵母菌生长的油脂含量最高,即酵母膏最适合菌体生长,而硫酸铵对油脂合成最有利。综合考虑两因素,选定氮源为酵母膏和硫酸铵的混合物。
2.4.3 接种量对酵母产油的影响
选择接种量为5%,10%,15%,20%(以种子培养液为1×108为基准),营养物质均相同的情况下,28℃,250 r/min摇瓶发酵4 d,考察接种量对酵母菌生物量和油脂含量的影响,结果见图4。由图4可知,生物量随接种量的增加而增加,而油脂含量则随接种量的增加先上升后下降,在接种量为10%时达到最大值,因此选择最佳接种量为10%。
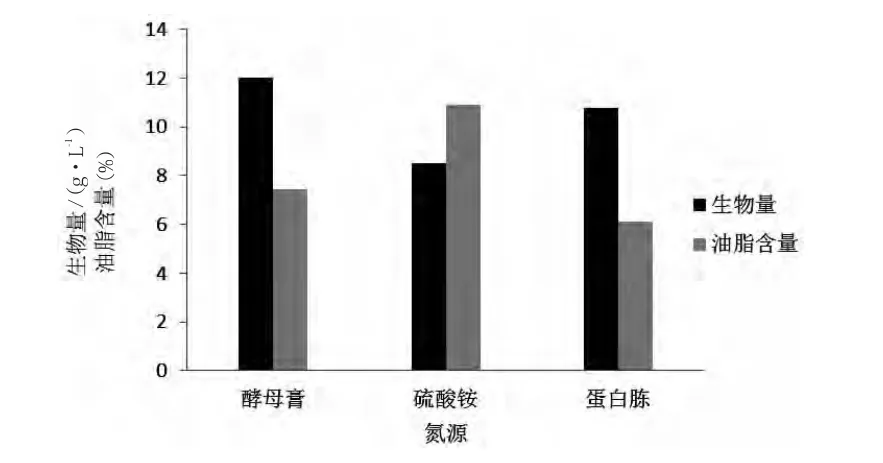
图3 氮源对酵母菌生物量和油脂含量的影响
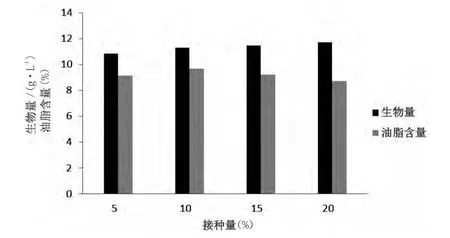
图4 接种量对酵母菌生物量和油脂含量的影响
2.5 酵母菌产油脂最佳发酵条件的优化
以发酵周期、氮源和接种量为因素做正交实验。正交因素水平表见表4,菌株产油发酵条件的正交实验结果见表5。由表5中生物量的R值可以看出,影响酵母菌细胞生物量的因素排序为:B>A>C,即氮源的影响最大,接种量的影响最小;影响酵母菌油脂产量的因素排序为:A>B>C,即发酵周期的影响最大,接种量的影响最小;影响酵母菌油脂含量的因素排序为A>B>C,即发酵周期的影响最大,接种量的影响最小。通过正交实验结果可得出理论上高产油脂酵母菌产油脂的最佳条件为:A2B4C3,即在培养期为4 d,氮源为酵母膏和硫酸铵,接种量为12%时,该酵母菌的油脂含量最高。

表4 正交因素水平表
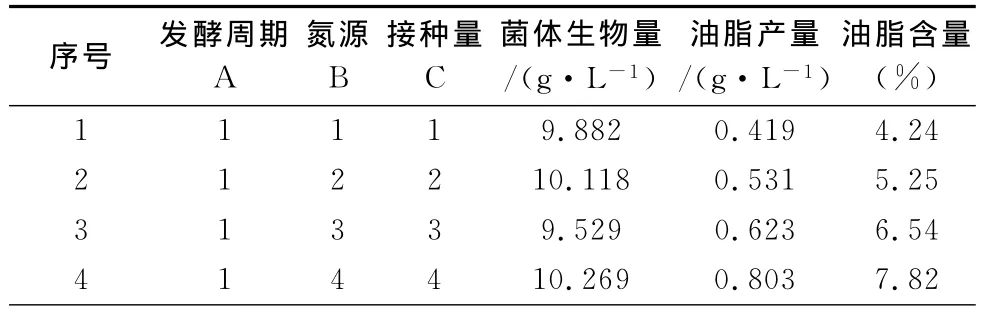
表5 菌株产油发酵条件的正交实验结果

(续表5)
3 结论
本实验能够从汽车修理厂土壤中筛选出一株高产油脂的酵母菌株,这可能因为该土壤富含的油渍较有利于油脂菌株的富集。通过对该菌株产油脂发酵条件的研究,结果发现发酵周期、接种量、氮源会影响菌株生长和代谢产物的积累。通过单因素和正交实验,得出摇瓶发酵培养的最佳产油脂条件为:发酵周期为4 d,酵母膏和硫酸铵混合物为氮源,接种量为12%。在该条件下所测得的菌体生物量为12.211 g/L,油脂产量为1.524 g/L,油脂含量为12.48%。
[1] 张东辉,梁焯,万霞,等.橘林油脂酵母发酵条件的初步研究[J].中国油料作物学报,2012,34(1):82-86.
[2] 徐华顺,罗玉萍,李思光.微生物发酵产油脂的研究进展[J].中国油脂,1999,24(2):34-36.
[3] 高媛,李元媛,王常高.高产油脂酵母的筛选及发酵条件的研究[J].化学与生物工程,2010,27(1):55-58.
[4] 蒲海燕,贺稚非,刘春芬.微生物功能性油脂研究概况[J].粮食与油脂,2005,3(3):12-14.
[5] 刘淑君,杨文博,施安辉.高产油脂酵母筛选机摇瓶发酵条件的研究[J].微生物学通报,2000,27(2):93-97.
[6] 何东平,陈涛.微生物油脂学[M].北京:化学工业出版社,2006:228-232.
