胰腺癌干细胞的分离培养及生物学特性鉴定
2014-05-14曾军英伍贤进李胜华皮建辉
曾军英,胡 兴,伍贤进,李胜华,皮建辉
肿瘤干细胞(cancer stem cell,CSC)被认为是存在于肿瘤细胞系或肿瘤组织中的具有自我更新、多向分化潜能、高耐药性及高致瘤性等特点的一群细胞,约占肿瘤细胞总数的0.01%~2.00%,在肿瘤形成、生长、浸润、转移和复发中起着关键性的作用[1]。1997年 Bonnet等[2]首次从急性髓系白血病 (acute myeloid leukemia,AML)患者中分离获得CSC。研究人员随后相继在一些实体瘤,如肺癌、乳腺癌、黑素瘤、前列腺癌、结直肠癌、脑肿瘤、头颈部鳞癌、卵巢癌及子宫内膜癌等癌组织中分离获得了 CSC[3-5]。2007年 Li等[6]从xenograft模型中分选出CSC,但是从胰腺癌细胞株中分离获得CSC的相关报道目前尚较少。因此,本研究尝试分离和培养胰腺癌干细胞,并鉴定其生物学特性,以期为将来进行胰腺癌靶向干预治疗及新药筛选提供研究模型。
1 材料与方法
1.1 主要试剂与仪器 MEM-F12细胞培养液、胎牛血清(fetal bovine serum,FBS)和干细胞培养添加剂B27均购自Gibco公司;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮生长因子 (epidermal growth factor,EGF)购自 Pepro-Tech Inc;胰岛素、L-谷氨酰胺购自 Sigma公司;胰蛋白酶购自Amresco公司;低黏附培养板购自Corning公司;FITC-anti CD24、FITC-anti CD44和 FITC-anti ESA购自 eBioscience公司;兔抗 c-Met、RON、CD24、CD44、ESA单克隆抗体购自Abcam或Cell Signaling公司;IVISSpectrum小动物活体成像系统(美国,Life Sciences公司);Eclipse TE200荧光倒置显微镜(日本,Nikon)。
1.2 磁性细胞分选技术纯化 CD24+CD44+ESA+细胞L3.6pl细胞用EDTA消化液(含2.5 mmol·L-1乙二胺四乙酸钠及1% 胎牛血清的PBS,pH 7.4),在4℃培育30 min;收集细胞,调整细胞密度至1×1010·L-1,加入兔抗人CD24(每106个细胞加1μg抗体),4℃培育30 min;用含10%胎牛血清的培养液离心洗涤1次,加入羊抗兔IgG免疫磁珠(德国MACS公司产品,每105个细胞加1μl磁珠),4℃培育30 min;用含1%胎牛血清的MEM-F12培养液(美国Hyclone公司产品)离心洗涤1次;按照德国MACS公司提供的操作指南,用MiniMACS分离柱分选并分别收集CD24+阳性细胞。再依次重复以上操作,获得CD44+ESA+阳性细胞。通过3次磁性细胞分选,最终获得CD24+CD44+ESA+3阳性细胞。
1.3 CD24+CD44+ESA+细胞的体外培养 收集磁性细胞分选的CD24+CD44+ESA+3阳性细胞,用无血清、含生长因子EGF和bFGF的MEM-F12培养基重悬、培养,收集细胞制成单细胞悬液,以1×105·L-1接种于低黏附96孔细胞板内的无血清MEM-F12培养基,以获得CSC CD24+CD44+ESA+干细胞球单克隆。
1.4 免疫荧光 收集二代细胞球,取对数生长细胞,制备细胞涂片,固定后加入一抗(抗人CD24、抗人CD44、抗人ESA,均购自美国Santa Cruz公司,浓度为1∶100)温育1 h,PBS冲洗,加入荧光标记的二抗(浓度为1∶50),冲洗、封片,荧光显微镜观察。根据荧光显示的亮度,测定其灰度值,代表蛋白的相对表达量,检测细胞标志物。
1.5 CD24+CD44+ESA+细胞体内成瘤实验 收集二代悬浮细胞球,用0.25%胰蛋白酶消化获得单个细胞悬液,PBS洗涤 细胞2次。取8周龄NOD/SCID♀小鼠24只,饲养于SPF级环境。分为3组,每组8只,分别接种102、103、104数量级的细胞于小鼠左侧腹部皮下,每周用IVIS Spectrum小动物活体成像系统(美国,Life Sciences公司)观察成瘤情况及肿瘤大小,12周后处死小鼠。移植瘤取出后切片,进行免疫组化染色。
1.6 免疫组化 采用二步法免疫组化染色(EnVision System),c-Met与RON(美国Santa Cruz公司)一抗的工作浓度均为1∶100。常规脱蜡、水化、抗原修复,一抗和二抗分别温育、DAB显色、苏木精复染,中性树脂封片观察。用非免疫血清代替一抗作为阴性对照。
1.7 耐药实验 将细胞球用0.25%胰蛋白酶消化成单细胞悬液,1×104个细胞 /孔接种96孔板,每组细胞设4个复孔,培养 24 h后分别加入终浓度均为0.01、0.1、1、10、100、1 000 nmol·L-1的紫杉醇和吉西他滨,对照组不加任何药物;培养至d 3时,加入20μl MTT(5 g·L-1)继续培养4 h,800×g离心20 min,小心吸去上液,加入150μl DMSO振荡20 min,用酶标仪在波长570 nm处检测各孔吸光度OD值,按照公式计算各组细胞抑制率。细胞抑制率/% =(OD对照组-OD实验组)/OD对照组×100% 。
1.8 蛋白表达检测 采用1%NP40冰上裂解细胞球30 min,4℃条件下6 500×g离心30 min提取细胞总蛋白,BCA试剂进行蛋白定量。取各组细胞总蛋白20μg上样,行8%SDS-PAGE分离蛋白,电转移至聚偏二氟乙烯 (polyvinylidene difluoride,PVDF)膜上。5%脱脂奶封闭2 h后,分别加入一抗 Bmi-1、E-cadherin、Vimentin、β-actin(1∶1 000稀释),室温反应2 h,TBST洗涤后加入相应二抗再反应1 h,膜经TBST洗涤后与电化学发光检测试剂反应,X线胶片压片曝光,显示结果。
1.9 统计学方法 采用SPSS 13.0统计学软件进行统计分析。所有实验均重复3次。实验数据用¯x±s表示,组间差异比较采用配对t检验。
2 结果
2.1 L3.6pl细胞在无血清干细胞培养基中的成球生长L3.6pl细胞在用无血清干细胞培养基和普通培养皿培养时,仍贴壁生长,即使添加成纤维细胞生长因子和表皮生长因子也不能形成细胞球。当使用经Poly-Hema包被过的培养皿或低黏附板和无血清干细胞培养基进行悬浮培养时,有一定比例的细胞球形成。经对成球培养条件进行优化后,L3.6pl细胞在d 3出现折光性强的较小细胞球,至d 10长成较大的细胞球,细胞球经机械打散后进行传代培养,传代细胞仍能悬浮球状生长。在30、60 d具有更强的成球能力(Fig 1)。
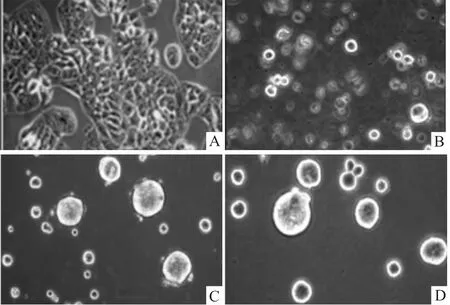
Fig 1 Tumor spheres derived from isolated L3.6pl cancer cells cultured in tumor sphere medium
2.2 干细胞表面标志检测 CD24+CD44+ESA+肿瘤细胞球形成干细胞的特征性标志分子。磁性细胞分选技术纯化CD24+CD44+ESA+细胞,收集磁性细胞分选的CD24+CD44+ESA+3阳性细胞,用无血清、含生长因子B27、EGF、bFGF的MEM-F12培养基重悬、培养。流式细胞仪检测结果显示,与L3.6pl细胞相比,这些来源于悬浮细胞球的细胞表达细胞黏附分子CD24+、CD44+和上皮特异性抗原(epithelial specific antigen,ESA)明显增强(如 Fig 2所示,CD24+、CD44+和ESA+分别是P<0.01,P<0.05,P<0.05),表明磁性细胞分选技术纯化得到高纯度的CD24+CD44+ESA+细胞。
2.3 肿瘤干细胞相关信号通路因子的表达 “自我更新”与上皮细胞间质化转变(epithelial mesenchymal transformation,EMT)是肿瘤干细胞的两个重要特性。Western blot检测肿瘤干细胞球中 Bmi-1、E-Cadherin和 Vimentin的表达(Fig 3)。结果表明,与L3.6pl细胞相比,CSC细胞的Bmi-1的表达在成球30 d的时候表达最强,分别是L3.6pl对照的12.4倍和成球15 d的1.8倍(P<0.05);Vimentin的表达分别是L3.6pl对照的18.2倍和成球15 d的2.1倍(P<0.05);与此相反,CSC细胞E-Cadherin的表达则下调了6.3倍和24.5倍(P<0.05)。研究结果提示,分离得到的CSC细胞具有“自我更新”与EMT两个重要的干细胞特性。
2.4 肿瘤干细胞球的致瘤性分析 将CD24+CD44+ESA+细胞接种于NOD/SCID小鼠右侧腹部,CD24-CD44-ESA-细胞接种于小鼠左侧腹部皮下,观察小鼠成瘤率。102组:CD24-CD44-ESA-细胞均未成瘤(0/8),CD24+CD44+ESA+细胞有4例成瘤(4/8);103组:CD24-CD44-ESA-细胞均未成瘤(0/8),CD24+CD44+ESA+细胞均成瘤(8/8)(P<0.05);104组:CD24-CD44-ESA-细胞有3例成瘤(3/8),CD24+CD44+ESA+细胞均成瘤(8/8)。移植瘤取出后切片,进行HE染色及c-Met、RON免疫组化染色。免疫结果显示(Fig 4),与L3.6pl组相比,CSC组中RON的表达成强阳性,c-Met的表达成中度阳性,提示CSC细胞具有很强的致瘤性,具有很强的侵袭、迁移和恶化的能力。

Fig 2 Molecular markers expressed in CSC spheres analyzed by fluorescence microscope
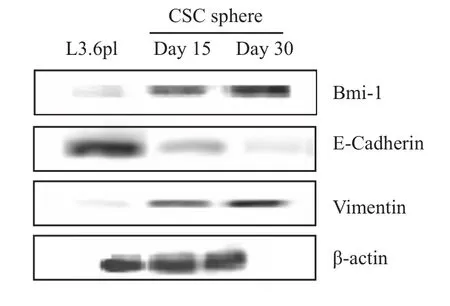
Fig 3 Expression levels of EMT and self-renewal indicated proteins in the spheriod cells examined by immunoblotting
2.5 干细胞球细胞分化潜能检测结果 细胞球细胞置于含10%胎牛血清的 DMEM培养基中常规培养0、3、6、12 h,使其贴壁生长并分化。Western blot检测CSC球细胞分化前后“自我更新”EMT表达变化。结果显示,Bmi-1和Vimentin在分化后表达水平降低,而E-cadherin在分化后表达水平升高(Fig 5),表明细胞球细胞具有分化潜能。

Fig 4 Tumorigenic assay of tumor sphere forming cells

Fig 5 CSC differentiation in epithelial culture conditions
2.6 干细胞球耐药性 能够耐受化疗药物的杀伤作用是癌的恶性特征之一,近年来研究发现其基础是癌细胞群中包含癌干细胞,提示癌干细胞可有较强耐药特性。吉西他滨和紫杉醇是治疗胰腺癌的临床药物。CSC细胞表现出对吉西他滨和紫杉醇具有一定的耐药性(Fig 6)。L3.6pl对吉西他滨的IC50为2.7 nmol·L-1,而 CSC对吉西他滨的 IC50为54.8 nmol·L-1,增加了 20.3倍(P<0.01);L3.6pl对紫杉醇的IC50为 12.1 nmol·L-1,而 CSC对紫杉醇的 IC50为 192.2 nmol·L-1,增加了 15.9倍(P<0.01),提示 CSC对吉西他滨和紫杉醇均具有明显的耐药性(Tab 1)。
3 讨论
传统放化疗针对的是多数无或低分化潜能的肿瘤细胞,无法根除其中的CSC,而这些残留的CSC是恶性肿瘤复发、放化疗抵抗、侵袭转移的根源[7]。自我更新能力、表达干细胞标志、耐药基因表达和免疫缺陷鼠体内成瘤等是肿瘤干细胞的“干性”标志[8]。分离胰腺癌干细胞的方法主要有两种:(1)特异的细胞表面标志物结合流式细胞术分选[6],如CD44+CD24+ESA+、CD133+、ALDH1、c-Met等;②特有的细胞功能结合流式细胞术分选[9],如SP(sidepopulation)细胞以及DiI+/SCC细胞。Li等[6]于2007年首次从手术标本分离到了 CD44+CD24+ESA+胰腺癌干细胞。Hermann等[10]研究采用磁珠分选系统,分别从胰腺癌组织和胰腺癌细胞株L3.6pl中分离出了约1.8%CD133+细胞;将500个该类细胞注入到NOD/SCID小鼠皮下,3周就能从小鼠皮下分离到肉眼可见的肿瘤,且该移植瘤与初始胰腺癌的组织学特性相同。本研究采用无血清与低黏附细胞培养板诱导胰腺癌L3.6pl细胞产生肿瘤细胞球,采用磁性细胞分选技术纯化胰腺癌L3.6pl细胞株中的CD24+CD44+ESA细胞,并将其植入非肥胖糖尿病/重症联合免疫缺陷NOD/SCID小鼠皮下具有很强的致瘤性,表明分离得到的细胞具有肿瘤干细胞的特性。本研究结合了目前分离胰腺癌干细胞的两种方法,方法简单实用,是一种有益的方法学补充。

Tab 1 Compared with L36pl group,CSCs were significantly increased drug resistance to gemcitabine and paclitaxel,respectively
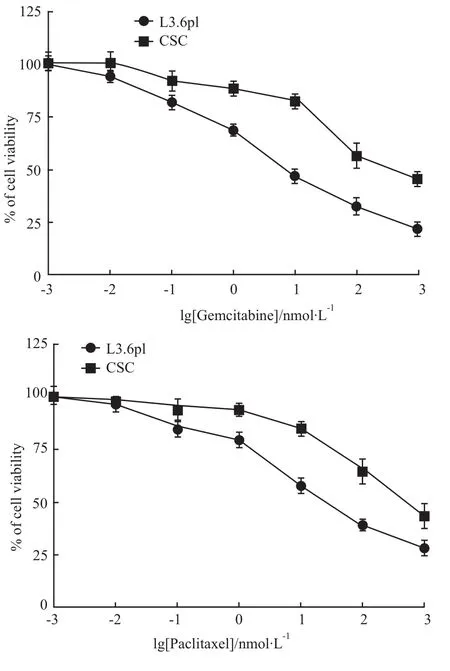
Fig 6 Result of drug sensitivity of pancreatic cancer cell lines L36pl and CSC
上皮-间质转化(EMT)是指上皮细胞在形态学上向成纤维细胞或间质细胞转变并获得迁移能力的过程,它是上皮来源肿瘤侵袭转移的主要机制。发生播散的肿瘤细胞需要经EMT离开原发部位,同时这些细胞还必须有自我更新及重新分化形成新肿瘤细胞的能力,因此CSC与EMT有密切联系[11]。Dembinski等[11]发现源于细胞株 BxPC-3、Panc03.27的 DiI+/SCC高表达Twist、Vimentin和N-Cadherin等EMT相关分子,提示 EMT主要发生在 DiI+/SCC中,说明具有CSC特性的DiI+/SCC更易出现EMT而发生转移。本研究结果表明,分离得到的胰腺癌干细胞球CD24+CD44+ESA+具有EMT现象,主要的EMT标志分子Vimentin明显表达上调,而E-Cadherin则明显表达下调。并且,此过程可随着干细胞的分化而逆转。
Sonic Hedgehog及BMI-1等信号通路在胰腺癌干细胞自我更新中发挥着重要的作用。原癌基因BMI-1是转录抑制因子基因Polycomb家族成员,它通过调节端粒酶的活性控制细胞的增殖和凋亡。Lee等[12]首次发现BMI-1 mRNA在胰腺癌中高表达,尤其高表达于CD44+CD24+ESA+,与正常胰腺上皮之间有明显差异,提示BMI-1可能与胰腺CSC自我更新相关。本研究表明,与L3.6pl细胞相比,CSC球细胞的BMI-1蛋白表达明显上调,并且此过程可随着干细胞的分化而逆转。
越来越多的研究显示胰腺癌干细胞介导了其对放化疗的抵抗。Hermann等[10]在利用吉西他滨干预CD133+CSC、CD133-细胞时发现CD133+CSC对吉西他滨明显耐药,干预5 d后其比例反而升高,达细胞总数的50%。Wang等[13]用含吉西他滨的培养液培养细胞株Panc-1时发现,吉西他滨的持续作用可以富集CD133+CSC;加大吉西他滨的剂量不能诱导CD133+CSC凋亡或死亡,而其他细胞则全部死亡。我们的研究结果亦显示,CSCCD44+CD24+ESA+细胞表现出对吉西他滨和紫杉醇具有很强的耐药性,但其内在分子机制尚不清楚。
研究表明,CSCCD44+CD24+ESA+细胞具有很强的致瘤特性。特别有趣的是,免疫组化分析表明,CSCCD44+CD24+ESA+细胞所诱导的肿瘤中RON和c-Met的表达为强阳性。RON(recepteur d’origine nantais,RON)与其同源基因 Met(proto-oncogene tyrosine kinase,Met)构成人类受体酪氨酸激酶家族(receptor tyrosine kinase,RTK)中的Met原癌基因亚家族。RON信号通路对肿瘤细胞增殖、迁移、侵袭、血管生成与化疗药物耐药性的影响[14]。Li等[15]研究表明c-Met介导了胰腺癌干细胞的生长与转移,可作为一种表面标志进行CSC的分选。Ma等[16]报导MSP刺激人结肠癌细胞HT-29后,使其受体RON磷酸化激活,上调EMT转录因子Snail和间质细胞标记Vimentin的蛋白水平,抑制E-Cadherin的表达,促进细胞形态向间质细胞样转化,增强HT-29的转移潜能。本研究发现RON/c-Met的过表达,与胰腺癌干细胞的特性存在密切相关性,其内在机制还有待于进一步研究。
参考文献:
[1] 李德冠,王小春,孟爱民.肿瘤干细胞靶向治疗[J].中国药理学通报,2009,25(6):701-3.
[1] Li D G,Wang X C,Meng A M.Targeted therapies of cancer stem cell[J].Chin Pharmacol Bull,2009,25(6):701-3.
[2] Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med,1997,3(7):730-7.
[3] Friel A M,Sergent PA,Patnaude C,et al.Functional analyses of the cancer stem cell-like properties of human endometrial tumor initiating cells[J].Cell Cycle,2008,7(2):242-9.
[4] Zhou B B,Zhang H,Damelin M,et al.Tumour-initiating cells:Challenges and opportunities for anticancer drug discovery[J].Nat Rev Drug Discov,2009,8(10):806-23.
[5] 耿 沁,董强刚,姚 明,等.肺癌干细胞的球体形成与致瘤性分析[J].肿瘤,2008,28(9):751-4.
[5] Geng Q,Dong Q G,Yao M.et al.The sphere formation and tumorigenesis of lung cancer stem cells[J].Tumor,2008,28(9):751-4.
[6] Li C,Heidt D G,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030-7.
[7] Reya T,Morrison SJ,Clarke M F,et al.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414(6859):105-11.
[8] Gupta P B,Chaffer C L,Weinberg R A.Cancer stem cells:Mirage or reality[J].Nat Med,2009,15(9):1010-2.
[9] Zhou J,Wang C Y,Liu T,et al.Persistence of side population cells with high drug efflux capacity in pancreatic cancer[J].World J Gastroenterol,2008,14(6):925-30.
[10]Hermann P C,Huber S L,Herrler T,et al.Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J].Cell Stem Cell,2007,1(3):313-23.
[11]Dembinski JL,Krauss S.Characterization and functional analysis of a slow cycling stem cell-like subpopulation in pancreas adenocarcinoma[J].Clin Exp Metastasis,2009,26(7):611-23.
[12]Lee C J,Dosch J,Simeone D M.Pancreatic cancer stem cells[J].J Clin Oncol,2008,26(17):2806-12.
[13]Wang Y H,Li F,Luo B,et al.A side population of cells from a human pancreatic carcinoma cell line harbors cancer stem cell characteristics[J].Neoplasma,2008,56(5):371-8.
[14]Yao H P,Zhou Y Q,Zhang R,et al.Msp-ron signalling in cancer:Pathogenesis and therapeutic potential[J].Nat Rev Cancer,2013,13(7):466-81.
[15]Li C,Wu J J,Hynes M,et al.c-Met is a marker of pancreatic cancer stem cells and therapeutic target[J].Gastroenterology,2011,141(6):2218-27.
[16]Ma Q,Guin S,Padhye S S,et al.Ribosomal protein s6 kinase(rsk)-2 as a central effector molecule in ron receptor tyrosine kinase mediated epithelial to mesenchymal transition induced by macrophage-stimulating protein[J].Mol Cancer,2011,10:66.