草甘膦对GC-1小鼠精原细胞的毒性作用及N-乙酰半胱氨酸的干预效应
2014-05-12曾明黄婷易吉平钟才高关岚王安刘新民
曾明,黄婷,易吉平,钟才高,关岚,王安,刘新民
1.中南大学公共卫生学院卫生毒理学系,长沙410008
2.长沙市疾病预防控制中心理化检验科,长沙410001
现代农业对农药的依赖性越来越大,草甘膦(glyphosate)作为全球销量最大的农药除草剂,在环境中广泛存在,其对生态环境和人类健康的影响越来越受到人们的关注。据统计在全国化学农药万吨级品种中,草甘膦年产量位居第3位。除草剂在施用过程中,仅约有1%作用于靶生物,其余残留在土壤,或通过间接途径进入水体,从而影响土壤生物和水生生物,水环境中的农药可通过食物链逐级浓缩,从而导致对水生态系统的危害,最后危害人类健康。调查表明,近年来包括草甘膦等除草剂在内的各种农药在农田中大量使用,对农田的污染也不断加大,农田中的泥鳅有绝迹的危险[1]。邓晓和李雅琦[2]发现草甘膦对土壤微生物的种群数量及土壤中细菌、放线菌和真菌生长速率均具有一定的抑制作用,而且随药剂浓度的升高抑制作用逐渐增强。Marek等[3]报道低剂量的草甘膦对水生无脊椎动物水蚤(Daphnia magna)有极大的负面影响。Jasper等[4]研究发现小鼠暴露于除草剂草甘膦(农达)后,肝组织血液的生化指标发生变化并受到氧化损伤。虽然草甘膦是一种低毒农药,但其中毒病例仍有报道,患者可出现心、肝、肺、肾损害的临床表现,主要死亡原因是呼吸衰竭、休克及肾功能衰竭[5]。Yousef等[6]报道草甘膦能够引起雄性新西兰大白兔体重减轻、性欲下降、射精体积和精液浓度减少,精液初期的果糖及精液重量克分子渗透压浓度降低,同时伴随异常和死亡精子增多,并且这种危害具有剂量依赖性。Oliveira等[7]以公鸭为实验模型,发现暴露于草甘膦能影响AR蛋白、芳香酶的表达和活性,并影响雄性和雌性激素的合成,产生对动物生殖的不利作用。康菊芳等[8]的研究表明草甘膦对小鼠精子产生损害,对哺乳动物雄性生殖细胞具有潜在的诱变危害。草甘膦作为一种广谱的除草剂,尽管其毒性低,但由于其使用范围极广,在土壤中的渗透力强,不仅可导致其在植物、土壤及水体中的残留,造成生态系统的危害,而且可能危害哺乳动物及人体的健康。因此研究草甘膦对人群及其他生物体的毒性作用尤其是生殖毒性等远期危害已日益引起重视。近50年来全球范围内男性精子数目锐减、精子运动能力低下、精子畸形率上升、男性不育症患者增加以及睾丸癌、前列腺癌发病率上升,被认为可能与人类生活环境中存在大量雄性生殖毒物如农药污染等有关[9-10]。目前关于草甘膦对哺乳动物雄性生殖细胞的毒性作用机制尚不清楚。本研究通过以GC-1小鼠精原细胞为研究对象,运用体外细胞彗星试验、细胞毒性及氧化损伤检测等方法,分析草甘膦对GC-1细胞的毒性作用,并探讨抗氧化剂N-乙酰半胱氨酸(NAC)的干预效应,为阐明草甘膦对雄性生殖细胞的毒性作用机制提供科学依据。
1 材料与方法(Materials and methods)
1.1 细胞株和受试物
GC-1小鼠精原细胞(GC-1细胞),由中南大学生殖与干细胞工程研究所惠赠。41%草甘膦异丙胺盐(商品名农达)购自美国孟山都公司。
1.2 培养基和试剂
DMEM高糖培养基、正常熔点琼脂糖和低熔点琼脂糖购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;0.25%胰酶、MTT粉剂购自美国Amresco公司;N-乙酰半胱氨酸(NAC)、碘化丙啶(PI)、二甲基亚砜(DMSO)、Tris-Base和曲拉通(Trion X-100)购自美国Sigma公司;乳酸脱氢酶(LDH)测定试剂盒、考马斯亮兰蛋白测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽(GSH)测定试剂盒和微量丙二醛(MDA)测定试剂盒均购自南京建成生物工程研究所。
1.3 器材
培养板和培养瓶(美国 Fisher公司)、CO2培养箱(美国SHELLAB公司);BHC-1300ⅡA2生物安全柜(北京阿尔泰实验设备有限公司);DYY-Ⅲ-7型电泳仪(北京六一仪器厂);XD-101型倒置生物显微镜(美国JONEC公司);Thermo Forma超低温冰箱(-80℃,美国Thermo公司);MK3型酶标仪(美国Thermo公司);XS-402型荧光显微镜(江南光电股份有限公司)。
1.4 细胞培养
从液氮罐中取出保存GC-1细胞株冻存管,迅速放入37℃热水中,快速将冻存液融化后,然后加入10倍体积37℃预热含10%(质量分数)胎牛血清的DMEM高糖培养基,1 000 r·min-1离心 5 min,弃上清,用含 10%(质量分数)胎牛血清的DMEM高糖培养基重悬细胞,置于37℃、含5%CO2培养箱中培养,第2天更换新鲜培养基,待细胞密度达到90%时传代。
1.5 检测指标及方法
1.5.1 细胞生存率测定(MTT比色法)
取处于对数生长期终密度为5×104个·mL-1的GC-1细胞,以每孔100 μL细胞悬液接种于96孔培养板中培养24 h后,换成含不同浓度农达的无血清培养液,农达终浓度为 30、60、90、120、150、180、210、240 mg·L-1;并设置NAC干预组:染毒前1 h,加入终浓度为10 mmol·L-1的NAC(通过查阅文献及预试验确定),农达染毒浓度为90 mg·L-1;同时设阴性对照组(PBS缓冲液)和空白对照(不含细胞,仅加培养液);每组设8个复孔。细胞处理并培养24 h后,加入10 μL的5 mg·L-1MTT溶液,继续孵育4 h,每孔再加入100 μL甲臜裂解液,继续培养6 h,置微量振荡器振摇10 min,用酶标仪492 nm波长测吸光度值(OD),计算其平均值。细胞存活率计算公式为:细胞存活率=(处理组吸光度值-空白对照组吸光度值)/(阴性对照组吸光度值-空白对照组吸光度值)×100%。
1.5.2 细胞形态学观察(Giemsa染色法)
取生长良好的GC-1细胞,以1×105个·mL-1传代于已放入灭菌盖玻片的6孔板中,待细胞贴壁生长密度至约80%更换为无血清的DMEM高糖培养基,将细胞分为7组,①对照组:加等体积的DMEM培养液;② ~⑥农达处理组:60、90、120、150、180 mg·L-1;⑦NAC干预组:NAC预处理细胞1 h,再加入90 mg·L-1农达。细胞染毒24 h后,按如下流程进行染色及观察:PBS轻洗细胞爬片3次→95%(体积分数)酒精固定15 min→PBS轻洗2次→Giemsa染色5 min→蒸馏水清洗后晾干→光镜观察并分析。
1.5.3 细胞DNA损伤的检测(彗星试验)
取生长良好的 GC-1细胞,以1×105个·mL-1传代于6孔板,待细胞贴壁生长密度约80%时更换无血清的DMEM高糖培养基,细胞分组同1.5.2。细胞染毒24 h后,采用碱性单细胞凝胶电泳法(彗星试验)检测细胞的DNA损伤,根据形成彗星细胞的百分率来分析细胞DNA损伤的情况。检测基本流程:细胞染毒结束,0.25%胰酶(质量分数)消化离心,用PBS制备单细胞悬液(密度调整为1×105个·mL-1)→按照文献报道的方法[11]制备含GC-1细胞的琼脂糖凝胶玻片→从所制备的胶板上掀除盖玻片,将载有细胞的玻片置于4℃预冷的细胞裂解液中裂解2 h→从细胞裂解液中取出载玻片,置于水平电泳槽中,浸泡于电泳缓冲液解旋20 min,室温下电泳20 min(电压22 V、电流300 mA)→电泳结束后取出载有胶板玻片,置于放有中和液平皿浸泡30 min,取出晾干→向载玻片上滴加5 μg·mL-1PI染色液50 μL,加盖玻片染色20 min→在荧光显微镜下观察,随机选取镜下细胞拍照,并采用单细胞凝胶电泳图像分析软件CASP-1.2.2对细胞图像进行分析。每个处理组分别随机分析100个细胞,以彗星阳性率(%)、彗星尾部 DNA%(TD,%)、彗星头部DNA%(HD,%)、彗星尾长(TL,μm)、尾矩(TM)和 Olive尾矩(OTM)为分析指标。
1.5.4 细胞毒性指标检测(LDH活性检测)
细胞传代及分组同1.5.3。细胞染毒24 h后,分别收集各组培养液,按照南京建成生物工程研究所的LDH测定试剂盒说明书检测培养上清液中LDH活性。
1.5.5 细胞氧化损伤指标测定
细胞传代及分组同1.5.3。细胞染毒24 h后用0.25%(质量分数)胰蛋白酶消化并离心(1 000 r·min-110 min),PBS重悬离心2次,弃上清,加入一定量的细胞裂解液,4℃裂解1 h,取细胞裂解液待测。按照南京建成生物工程研究所的考马斯亮兰蛋白试剂盒、SOD测定试剂盒、GSH测定试剂盒及微量MDA试剂盒说明书分别测定细胞内蛋白含量、SOD活性、GSH及MDA含量。
1.6 统计分析
实验数据采用SPSS 13.0统计软件分析处理。试验结果以均数士标准差士S)表示。计量资料采用ANOVA方差分析和t检验,计数资料采用卡方检验,剂量反应关系采用直线相关分析。P<0.05表示组间具有统计学意义。
2 结果(Results)
2.1 农达对GC-1细胞存活率的影响
如表1所示,不同浓度农达作用24 h后GC-1细胞存活率降低,且随处理浓度的增加而下降,两者存在负相关(r=-0.992,P<0.01),可见农达对GC-1细胞存活率的影响具有剂量依赖关系。用10 mmol·L-1NAC干预后,90 mg·L-1农达染毒组的细胞存活率明显上升,干预前后存活率的差异具有统计学意义(P<0.05)。为能较好观察农达对GC-1细胞的损伤作用及NAC的干预效应,选取细胞存活率为80% ~40%的处理浓度,即 60、90、120、150、180 mg·L-1以及NAC 干预组(10 mmol·L-1NAC+90 mg·L-1农达)进行后续实验。
2.2 农达诱导GC-1细胞形态学改变
如图1所示,光镜下可见对照组细胞大小均匀,排列有序,细胞边界清楚,核及核仁完整深染,胞浆淡染;农达处理后,引起GC-1细胞皱缩,细胞密度减少,部分细胞肿大,有空泡出现,随着农达处理浓度增加,细胞膜和核膜不完整或消失,染色质固缩浓染,细胞成坏死样改变;NAC干预组(10 mmol·L-1NAC+90 mg·L-1农达)坏死样细胞比单独 90 mg·L-1农达处理组明显减少。
表1 农达对GC-1细胞存活率的影响Table 1 Effect of Roundup on survival rate of GC-1 spermatogonium(GC-1 spgs)

表1 农达对GC-1细胞存活率的影响Table 1 Effect of Roundup on survival rate of GC-1 spermatogonium(GC-1 spgs)
注:* 与对照组相比,P < 0.05;Δ NAC干预组(90 mg·L-1农达+10 mmol·L-1NAC)与90 mg·L-1农达组相比,P < 0.05。Note:*P<0.05,compared with the control;Δ P<0.05,10 mmol·L-1NAC+90 mg·L-1Roundup group compared with 90 mg·L-1Roundup group.
?
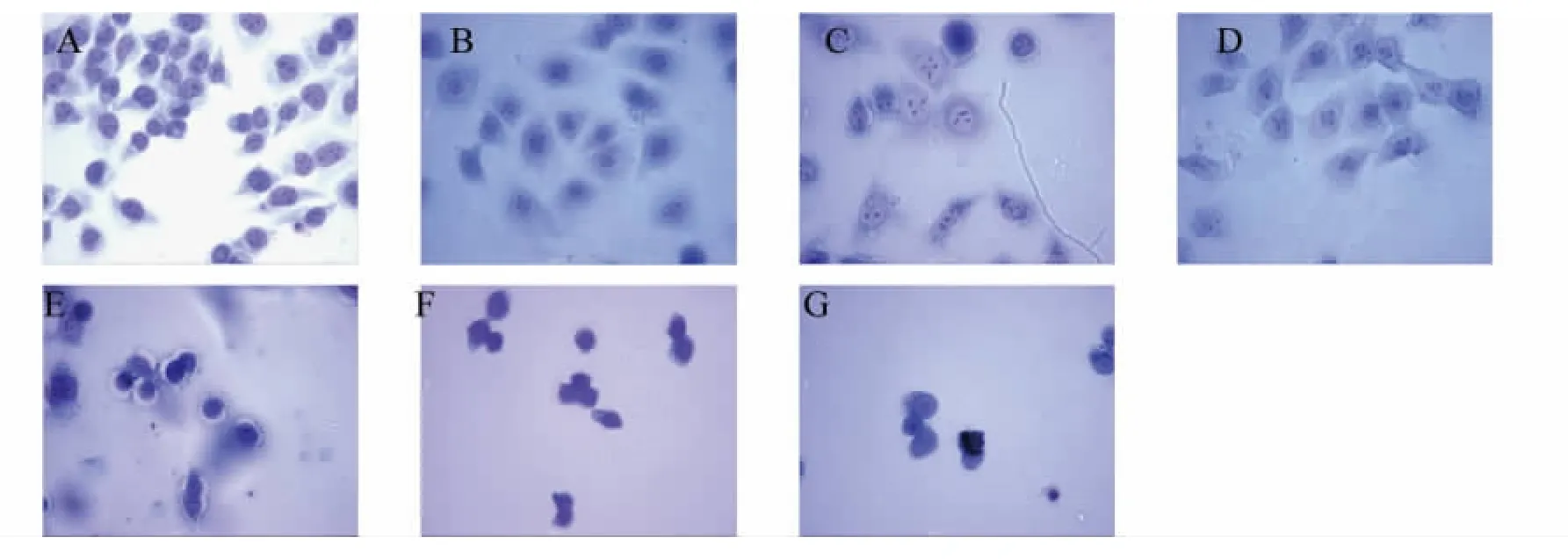
图1 农达处理24 h后GC-1细胞的形态学变化(40×)注:A.对照组,B.60 mg·L-1农达组,C.90 mg·L-1农达组,D.NAC 干预组(10 mmo·lL-1NAC+90 mg·L-1农达),E.120 mg·L-1农达组,F.150 mg·L-1农达组,G.180 mg·L-1农达组。Fig.1 Fig.1 Giemsa strained image of GC-1 spgs treated by Roundup for 24 h(×40)Note:A.control;B.60 mg·L-1Roundup group;C.90 mg·L-1Roundup group;D.10 mmo·lL-1NAC+90 mg·L-1Roundup group;E.120 mg·L-1Roundup group;F.150 mg·L-1Roundup group;G.180 mg·L-1Roundup group.
2.3 农达诱导GC-1细胞DNA损伤
图2可见对照组大部分细胞没有拖尾现象,呈规则的圆形,周围有光晕;而不同浓度农达染毒组均有部分细胞出现彗星拖尾现象,提示农达可引起GC-1细胞DNA损伤。表2显示农达处理组细胞的彗星阳性率明显高于对照组(P<0.05),且具有剂量依赖关系(r=0.986,P<0.01);不同浓度农达处理组细胞的TD、TL、TM及OTM值均明显高于对照组(P<0.05),而各处理组HD值则明显低于对照组(P<0.05)。10 mmol·L-1NAC对90 mg·L-1农达染毒干预后与 90 mg·L-1农达单独处理组相比,细胞拖尾减轻(图2D),彗星阳性率明显下降,TD、TL、TM及OTM值下降,HD值上升(P<0.05),提示DNA损伤程度减轻。
2.4 农达对GC-1细胞的毒性及氧化损伤作用

图1 农达处理24 h后GC-1细胞的DNA损伤彗星图像(40×)注:A.对照组,B.60 mg·L-1农达组,C.90 mg·L-1农达组,D.NAC干预组(10 mmo·lL-1NAC+90 mg·L-1农达),E.120 mg·L-1农达组,F.150 mg·L-1农达组,G.180 mg·L-1农达组。Fig.1 Comet image of DNA damage in GC-1 spgs treated by Roundup for 24 h(×40)Note:A.control,B.60 mg·L-1Roundup group;C.90 mg·L-1Roundup group;D.10 mmo·lL-1NAC+90 mg·L-1Roundup group;E.120 mg·L-1Roundup group;F.150 mg·L-1Roundup group;G.180 mg·L-1Roundup group.
表2 农达作用24 h后对GC-1细胞DNA损伤的影响Table 2 Effect of 24 h Roundup treatment on indicators of DNA damage in GC-1 spgs

表2 农达作用24 h后对GC-1细胞DNA损伤的影响Table 2 Effect of 24 h Roundup treatment on indicators of DNA damage in GC-1 spgs
注:*与对照组相比,P < 0.05;Δ NAC干预组(90 mg·L-1农达+10 mmol·L-1NAC)与90 mg·L-1农达组相比,P < 0.05。Note:*P<0.05,compared with the control;Δ P<0.05,10 mmol·L-1NAC+90 mg·L-1Roundup group compared with 90 mg·L-1Roundup group.
?

表3 农达对GC-1细胞LDH、SOD活性及MDA、GSH含量的影响Table 3 Effect of Roundup on levels of LDH,SOD,MDA and GSH in GC-1 spgs
表3显示农达处理24 h后,GC-1细胞的LDH释放增加,且释放量随农达浓度的增加而增加,两者存在正相关(r=-0.959,P<0.01);其中≥ 90 mg·L-1的农达各处理组LDH与对照组比较有明显差异(P<0.05);NAC干预后90 mg·L-1农达处理组LDH与对照组比较无明显差异,而NAC干预组与农达90 mg·L-1单独处理组相比 LDH释放明显减少(P <0.05)。
表3也显示农达处理24 h后,引起GC-1细胞内SOD活性降低,GSH含量减少,MDA生成增多,与对照组相比有明显差异(P<0.05);各农达处理组中MDA、GSH含量及 SOD活性均有剂量反应关系(MDA,r=0.943,P<0.01;SOD,r=﹣0.781,P<0.01;GSH,r=﹣0.943,P<0.01)。NAC干预组与90 mg·L-1农达单独处理组相比,SOD活性升高、GSH含量增加及MDA生成量减少,两组差异有显著性(P<0.05);而NAC干预组和对照组相比,SOD活性降低,MDA生成量增多,但无明显差异(P>0.05)。
3 讨论(Discussion)
细胞膜是种选择透过性膜,具有维持细胞内环境相对稳定的作用。细胞膜通透性的增大,是化学毒物作用于细胞膜的早期反应,也是细胞损伤的早期表现之一。乳酸脱氢酶(LDH)是胞浆标记酶,在细胞内很稳定,细胞处于正常状态下其不能通过细胞膜,但当细胞受到损伤或死亡时便可释放到细胞外,此时细胞培养液中LDH的活性与细胞损伤或死亡数目呈正比。因此LDH漏出检测是一个敏感的试验指标,特异性反映药物、农药等化学物质引起细胞膜损伤及通透性改变等细胞毒性作用[12]。本研究结果显示,农达处理GC-1细胞24 h后,光镜下可见细胞皱缩,细胞密度降低,部分细胞肿大,细胞质出现空泡,随着农达处理浓度增加,细胞膜和核膜不完整或消失,染色质固缩浓染,细胞成坏死样改变;细胞存活率也随着农达处理浓度增加而下降;同时农达处理24 h的GC-1细胞释放LDH增加,使得培养上清中LDH活性升高,与对照组比较有统计学意义。这些结果提示农达引起细胞膜出现不同程度的损伤,导致细胞膜通透性增加甚至细胞膜破裂、细胞死亡等细胞毒性作用。
正常情况下机体内存在完整的防御系统,细胞中的有关酶类和小分子物质的抗氧化效应可拮抗自由基的氧化损伤效应,从而维持氧化损伤与抗氧化防御体系处于一种动态平衡状态之中[13]。当细胞遭到外来因素的干扰,氧化与抗氧化系统平衡被影响而发生改变,自由基过度产生或机体的抗氧化防御体系功能受损,过多的自由基导致细胞氧化损伤作用。MDA是细胞发生脂质过氧化反应的产物中具有代表性的产物,其含量的多少可反映自由基产生和脂质过氧化的程度,间接反映细胞内 ROS水平和细胞损伤的程度。细胞内的抗氧化系统中,常采用GSH、SOD来反应细胞内的抗氧化能力。SOD是自由基的有效清除剂,具有防止自由基对机体直接或间接的损伤作用。SOD活力的降低,说明体内需清除的自由基较多[14]。GSH是体内重要的非酶性抗氧化系统中的一种重要内源性分子,在谷胱甘肽过氧化物酶(GSH-Px)的催化下,可使体内过氧化物还原为H2O和氧化型谷胱甘肽(GSSG),从而阻断脂质过氧化的连锁反应,保护细胞不受氧化自由基的损伤。GSH的多少是衡量机体抗氧化能力大小的重要标志[15]。在本研究中,笔者发现经农达处理24 h后,MDA含量显著增多,而SOD酶活性与GSH水平均明显降低,与对照组比较有统计学意义,提示农达可能诱导 GC-1细胞 ROS产生增加,引发细胞氧化应激,从而脂质过氧化产物MDA增多,GSH耗竭及SOD活性降低,引起细胞氧化与抗氧化失衡,导致细胞氧化损伤。
NAC是谷胱甘肽的前体,作为小分子物质,易于进入细胞,脱乙酰基后成为GSH合成的前体,促进GSH的合成,提高组织内GSH含量,增强组织的抗自由基及药物和毒物损伤能力。此外,NAC还可通过其还原性巯基,直接捕获未成对电子,阻遏超氧阴离子的生成,并作为谷胱甘肽过氧化物酶(GPx)的底物,可清除具有组织损伤能力的羟自由基和脂肪酰羟基过氧化物,还原氧化型蛋白巯基,维持蛋白质功能,还可通过参与氧化应激基因表达的调控等机制发挥其抗过氧化损伤的作用[16]。本研究结果显示经NAC干预的90 mg·L-1农达处理组,LDH漏出减少,MDA含量下降,SOD活性增加,GSH水平升高,与90 mg·L-1农达单独处理组相比,具有统计学意义;结合细胞形态学观察,可知NAC对农达诱导细胞膜通透性增加及氧化损伤起到一定的保护作用,这与徐德祥等[17]的报道一致。
彗星试验是一种检测单个细胞DNA链断裂损伤的电泳技术。由于其操作简单、快速、灵敏、无需放射性标记、所需细胞少,适用于体内外不同类型实验和各种类型细胞DNA损伤的研究。本研究通过彗星实验检测发现农达可致GC-1细胞DNA链损伤断裂,而且浓度越大,彗星率越高,形成的DNA碎片也越多,拖尾现象更明显,细胞损伤程度越严重。Gasnier等[18]研究也显示农达能够诱导人细胞株DNA损伤。通过NAC预处理后农达染毒组彗星细胞较农达染毒组减少,说明NAC对农达诱导GC-1细胞DNA损伤具有一定的保护作用。有研究表明NAC对DNA的保护可能主要通过以下途径得以实现[19]:①过氧化物会造成DNA损伤,能产生胸腺嘧啶乙二醇、羟甲基尿嘧啶等碱基修饰物,还可能引起DNA单链断裂等损伤。NAC清除活性氧,抑制环氧合酶COX-1及COX-2的活性,还抑制炎症和病毒感染引起的脂质过氧化反应。②NAC还可抑制与DNA修复相关的自然突变,修正DNA的去甲基化,保护核酶如PARP及提高对受损DNA的修复。③NAC抑制诱导突变和DNA的损坏,并能抑制化学诱导的细胞转化。
综上所述,除草剂草甘膦处理可引起GC-1小鼠精原细胞氧化与抗氧化失衡,造成细胞膜脂质过氧化反应,细胞膜通透性增加,造成细胞氧化损伤和DNA损害,导致细胞损伤或死亡;NAC可能通过抗氧化拮抗草甘膦的毒性。
[1]南旭阳,张艳丹,黄小莲.除草剂“草甘膦”对泥鳅白细胞的影响[J].温州师范学院学报:自然科学版,2003,24(2):72-74 Nan X Y,Zhang YD,Huang X L.Effect of Mixgurnus anguillicaudatus induced by glyphosate[J].Journal of Wenzhou Normal College:Natural Science Edition,2003,24(2):72-74(in Chinese)
[2]邓晓,李雅琦.草甘膦对土壤微生物影响的研究[J].农药,2005,44(2):59-62 Deng X,Li Y Q.Effect of glyphosate on soil microorganism[J].Chinese Journal of Pesticides,2005,44(2):59-62(in Chinese)
[3]Marek C,Terje T,Thomas B.Clone-and age-dependent toxicity of a glyphosate commercial formulation and its active ingredient in Daphnia magna[J].Ecotoxicology,2013,22:251-262
[4]Jasper R,Locatelli G O,Pilati C,et al.Evaluation of biochemical,hematological and oxidative parameters in mice exposed to the herbicide glyphosate-Roundup[J].Interdisciplinary Toxicology,2012,5(3):133-140
[5]夏敏,晏志钢,王安伟,等.草甘膦中毒12例临床分析[J].现代预防医学,2005,32(6):701
[6]Yousef M I,Salem M H,Ibrahim H Z,et al.Toxic effects of carbofuran and glyphosate on semen characteristics in rabbits[J].Journal of Environmental Science and Health,1995,30(4):513-534
[7]Oliveira A G,Telles L F,Hess R A,et al.Effects of the herbicide Roundup on the epididymal region of drakes Anas platyrhynchos[J].Reproductive Toxicology,2007,23(2):182-191
[8]康菊芳,曾明,关岚,等.草甘膦对小鼠的致突变作用研究[J].癌变·畸变·突变,2008,20(3):227-230 Kang J F,Zeng M,Guan L,et al.Study on mutagenesis induced by glyphosate in mice[J].Carcinogenesis,Teratogenesis,Mutagenesis,2008,20(3):227-230(in Chinese)
[9]Longnecker M P,Klebanoff M A,Gladen B C,et al.Serial levels of serum organochlorines during pregnancy and postpartum[J].Archives of Environmental Health,1999,54(2):110-114
[10]Longnecker M P,Klebanoff M A,Zhou H B,et al.Association between maternal serum concentration of the DDT metabolite DDE and preterm and small-for-gestation-age babies at birth[J].The Lancet,2001,358(9276):110-114
[11]张遵真,衡正昌,廖艳,等.彗星试验检测间接诱变剂对小鼠睾丸细胞的DNA损伤[J].癌变·畸变·突变,2001,13(1):4-7 Zhang Z Z,Heng Z C,Liao Y,et al.Study on DNA damage induced by indirect mutagens using comet assay in testicular cells in vitro[J].Carcinogenesis,Teratogenesis,Mutagenesis,2001,13(1):4-7(in Chinese)
[12]Korzeniewski C,Callewaert D M.An enzyme release assay for natural cytotoxicity[J].Journal of Immunological Methods,1983,64(3):313-320
[13]Gille J J,Pasman P,van Berkel C G,et al.Effect of antioxidants on hyperoxia-induced chromosomal breakage in Chinese hamster ovary cells:Protection by carnosine[J].Mutagenesis,1991,6(4):313-318
[14]Koppenol W H.A thermodynamic appraisal of the radical sink hypothesis[J].Free Radical Biology and Medicine,1993,14(1):91-94
[15]Regina B F.Tissue-specific functions of individual glutathione peroxidases[J].Free Radical Biology and Medicine,1999,27(9):951-965
[16]巫国谊,赵有蓉.N-乙酰半胱氨酸的药理作用机制研究进展[J].现代医药卫生,2004,20(19):2001-2002
[17]徐德祥,沈汉民,王俊南.N-乙酰半胱氨酸对外源性H2O2和内源性O-2引起的精子DNA损伤的保护作用[J].生殖与避孕,2001,21(5):277-281 Xu D X,Shen H M,Ong C N.The protective effects of N-acetylcysteine on exogenous hydrogen peroxide and endogenous superoxide anion-induced DNA strand breakage in human spermatozoa[J].Reproduction&Contraception,2001,21(5):277-281(in Chinese)
[18]Gasnier C,Dumont C,Benachour N,et al.Glyphosatebased herbicides are toxic and endocrine disruptors in human cell lines[J].Toxicology,2009,262(3):184-191
[19]De Flora S,Izzotti A,D'Aqostini F,et al.Mechanisms of N-acetylcysteine in the prevention of DNA damage and cancer,with special reference to smoking-related endpoints[J].Carcinogenesis,2001,22(7):999-1013
