降落PCR在运动人体科学实验检测中的应用
2014-05-12苏利强赵广涛
苏利强 赵广涛
1江西中医药大学体育教学部(南昌 330004) 2河南教育学院
多聚酶链式反应(PCR)技术是研究基因表达的重要手段[1,2],在生命科学和运动人体科学领域中广泛应用。但实验操作中PCR尚有不足,如常规PCR在引物设计方面需要两个引物的退火温度比较接近,在实验扩增阶段需要针对引物的退火温度摸索实验条件,既浪费耗材又浪费时间。如遇多个目的基因则要逐一扩增,扩增效率比较低。
研究人员对常规PCR进行了改良,在PCR扩增中,将相连循环的退火温度设定得越来越低,这种PCR技术称为降落PCR(TD-PCR)[3,4]。 退火温度逐渐降低,可以使不同退火温度的引物与模板结合,进而延伸-扩增。此方法可以同时扩增不同退火温度的多个目的基因,减少摸索退火温度的次数,提高了PCR的效率。本实验采用TD-PCR方法对与运动密切相关的几个mRNA逆转录后的cDNA进行扩增,探讨TDPCR在运动人体科学中的应用。
1 材料与方法
1.1 取材
清洁级SD大鼠,8周龄, 证号:JZDW,NO:2011-0183,由江西中医学院实验动物中心提供。按照要求进行饲养,自由饮食和饮水。
1.2 方法
1.2.1 分离淋巴细胞
麻醉动物后股动脉取血5 ml,在抗凝管中保存,采用淋巴细胞分离液分离淋巴细胞。取抗凝血5 ml与PBS缓冲液1∶1混匀后,加入10 ml淋巴细胞分离液之液面上,以2000转/分离心15分钟,收集界面上的细胞,放入含有10 ml PBS缓冲液的试管中,充分混匀后,以1500~2000转/分离心10分钟,弃上清液,留沉淀,再加入10 ml PBS缓冲液,1500~2000转/分离心10分钟,这一过程重复2次,所得沉淀即为淋巴细胞。淋巴细胞分离液购自北京索莱宝科技有限公司。
1.2.2 提取RNA
提取RNA用到的玻璃仪器采用烘箱300摄氏度高温烘烤3小时以上,去除RNA水解酶;EP管、塑料软管及移液枪头等通过浸泡于DEPC溶液中过夜。第2天高压蒸汽灭菌,后烘干备用;在提取RNA过程中,按照相关标准清洁实验室、操作台,不受RNA水解酶污染。
收集的淋巴细胞适当溶于PBS缓冲液,定量107个细胞倒入离心管中,8000g、4℃离心2分钟,弃上清后加入l mlTransZol Up,用移液枪反复吹吸直至裂解液中无明显沉淀,室温静置5分钟。TransZol Up购自北京全式金生物科技有限公司。
加0.2 ml氯仿,剧烈振荡30秒,室温孵育3分钟。10000g、4℃离心15分钟。此时样品分成3层,无色的水相(上层)、中间层和粉红色有机相(下层)。RNA主要在水相中,转移无色的水相于新的离心管中,每使用1 ml TransZol Up加入0.5 ml异丙醇,颠倒混匀,室温孵育10分钟。10000g、4℃离心10分钟,去上清,在管侧和管底形成胶状沉淀。
加1 ml 75%乙醇(DEPC处理的水配制),剧烈涡旋 (每使用1 ml TransZol Up至少加75%乙醇1 ml)。7500g、4℃离心5分钟。弃上清,室温晾干沉淀。沉淀溶于50~100 μl RNA溶解液中。 55℃~60℃孵育10分钟,保存样品于-70℃备用。对总RNA进行电泳,紫外分光光度计测试OD260/OD280值。
1.2.3 逆转录过程
建立20 μl的逆转录反应体系,将以下组分加入无核酸酶的微量离心管中:1μl oligo(dT)12~18(500 μg/ml)、500 ng总RNA、1 μl 10 mM dNTP混合物,加入灭菌蒸馏水至12 μl灭菌蒸馏水;混合物在65℃加热5分钟后,迅速置于冰上冷却。短暂离心后,加入以下组分:4 μl 5×第一链合成缓冲液、2 μl 0.1M DTT、1 μl RNaseOUTTM核酸酶抑制剂(40单位/μl);在离心管中轻轻将各种成分混合,并在37℃下孵育2分钟;在室温下加入1 μl(200单位)M-MLV逆转录酶,轻轻地吹打混匀;37℃孵育50分钟;70℃加热15分钟以终止反应;4℃保存用于PCR扩增。
1.2.4 PCR引物设计、合成与纯化
根据GenBank已经公布的大鼠基因序列信息,运用DNAstar进行基因序列的同源性比较,扩增的mRNA引物设计、合成和纯化由生工生物工程 (上海)有限公司完成,合成后引物的采用ULTRAPAGE方法进行纯化。

表1 引物序列及扩增产物大小
1.2.5 PCR过程
取12份等量的cDNA溶液,分为两个6份。第一个6份分别加入6对引物,均配成总体积为20 μl的反应体系,用于常规PCR反应。第二个6份同第一个6份,分别同量加入6对引物,配成总体积为20 μl的反应体系。
每个终体积20μl的反应体系包括:18μl PCRsupperMix、0.5 μl上游扩增引物(10 μM)、0.5 μl下游扩增引物(10 μM)、1 μl cDNA(来自于RT过程反应产物cDNA)。
常规PCR循环条件:变性94℃加热3min,进行94℃ 30 s;55℃ 30 s;72℃ 1 min;36个循环,75℃延伸7 min,然后4℃保存待电泳。
递降PCR循环条件:变性94℃加热3 min,扩增(94℃ 30 s;55℃ 30 s;72℃ 1 min)2个循环,(94℃ 30 s;54℃ 30 s;72℃ 1 min)4个循环,(94℃ 30 s;53℃30 s;72℃ 1 min)10个循环,(94℃ 30 s;52℃ 30 s;72℃ 1 min)20个循环;75℃ 7 min,然后4℃保存待电泳。
RNaseOUTTM核酸酶抑制剂、M-MLV逆转录酶和PCRsupperMix等RT-PCR相关试剂购自invitrogen公司。
1.2.6 电泳、显色与成像
第一个6份在一个胶上电泳,第二个6份在另外一个胶上电泳,每份取10 μl PCR产物在一个泳道上样,采用1.5%琼脂糖电泳20分钟,EB染色,紫外线显色成像。
2 结果
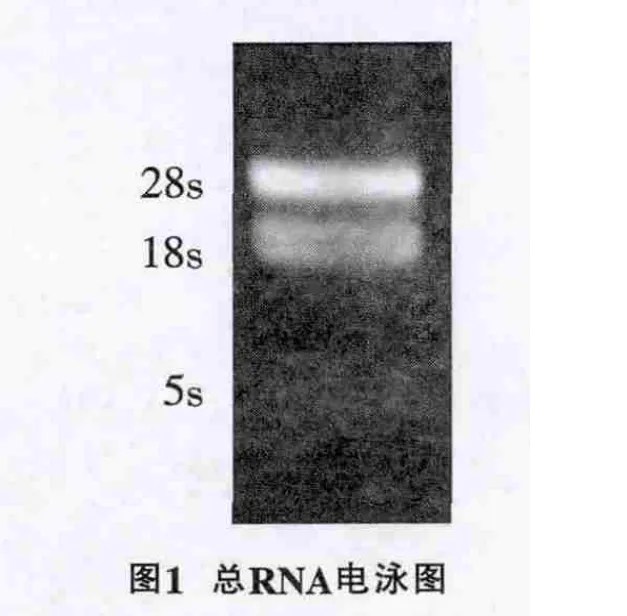
2.1 提取总RNA完整性
RNA完整性鉴定,采用1.2%的琼脂糖凝胶电泳检测其质量,图1显示RNA提取完整,采用紫外分光光度计定量OD260/OD280值为1.86,表明RNA纯度较高。
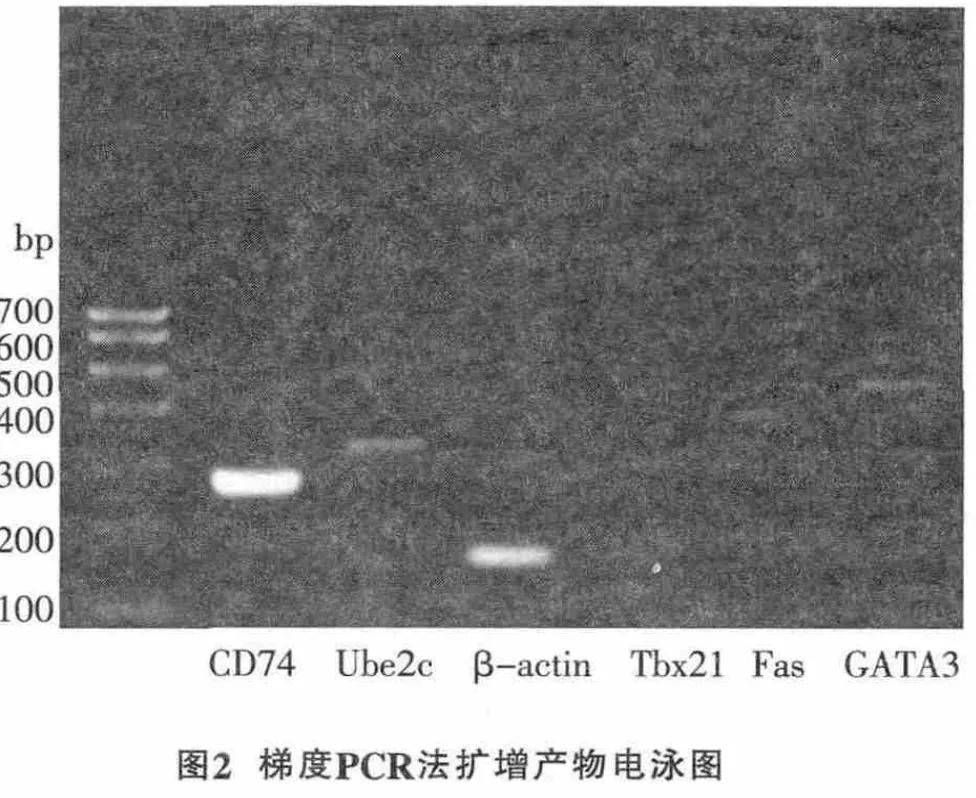
2.2 6个不同目的基因的扩增结果
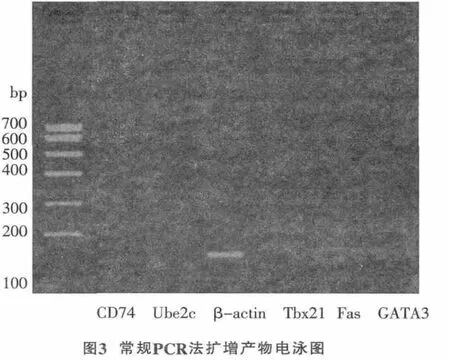
图2为TD-PCR结果,只有Tbx21 mRNA成熟序列逆转录后的cDNA未被扩增出来,其它扩增的产物均对应相应的Marker,与预期条带的位置相同,并且条带显示较好。图3显示,常规PCR采用一个退火温度扩增,只有内参被成功扩增,其他目的基因均未扩增成功。TD-PCR较常规PCR有较大优势。
3 讨论
3.1 扩增的基因功能概述
MHC-II是免疫呈递过程中信号转导所需要的部分,CD74是MHC-II的不变链[5]。 CD74通过与CD44、CXCR4和CXCR2形成复合体实现调控免疫细胞的功能[6,7]。
GATA蛋白家族属于Ⅳ型锌指蛋白,具有高度保守的相同DNA结合功能域,此结构域含有两个相似的Ⅳ型锌指结构 (Cys-X2-Cys-X17-Cys-X2-Cys),其梭基端的锌指结构对结合特异性DNA序列是必需的,而氨基端的锌指结构可与前者相互作用,增加结合的稳定性与特异性。GATA蛋白家族成员较多,功能不尽相同,其中GATA-3蛋白在调控免疫中起到重要作用,也是免疫学研究的热点。GATA-3与TCR的4个亚单位α、β、γ、δ的增强子发生特异性结合,调节TCR基因表达,继而诱导T细胞活化,因此GATA-3被认为是T细胞特异转录因子,对T细胞的发育和激活起重要作用[8]。
Tbx21基因也被称为T-bet,是T-box转录因子家族成员中的重要成员。该基因编码的T-bet蛋白是调节CD4+细胞分化的T细胞特异性转录因子,调控Th1细胞分泌IFN-γ,使Th前体细胞向Th1细胞方向分化,也是CD8+原始T细胞分化为细胞毒性T淋巴细胞(CTL)的关键调节因子,T-bet与机体细胞免疫密切相关[9]。 本次研究中,Tbx21 mRNA未扩增出来,根据实验条件分析,可能相比其他mRNA,Tbx21 mRNA表达丰度较小,经过36个循环的扩增后仍未显示出来,也可能是引物的实际Tm值较低,在温度梯度55℃~52℃的递降过程中,引物与底物特异性结合不好造成的。但具体原因尚需探讨。
Fas是细胞凋亡相关蛋白的膜表面分子,在探讨细胞凋亡过程中起重要作用。
泛素是一个由76个氨基酸残基组成的高度保守的多肽,因其广泛分布于各类细胞中而得名,被泛素标记的蛋白质将被特异性地识别并被迅速降解。细胞中的蛋白质降解是一个被严密调控的复杂过程,此过程在涉及细胞基本进程(如DNA修复、细胞周期调控、细胞凋亡等)、抗原呈递、炎症反应等一系列通路中扮演重要角色[10]。Ube2c基因是编码泛素链接酶E2,在泛素化过程中起重要作用。
3.2 TD-PCR技术
TD-PCR法可以同时扩增多基因,快速了解其mRNA表达。在研究表达丰度、基因多态性分析、质粒重组与构建的检验等方面均可以发挥作用。本研究同时扩增了和运动密切相关的几个基因,这一方法还可以应用到其他更多的基因。
常规PCR一次只能扩增一个目的基因,主要由于常规PCR扩增时退火温度要精确。退火温度过低,一些碱基形成的局部双链不容易解开成单链,难以继续碰撞和正确配对,不易形成以目的基因为模板的双链,在复性过程中降低特异性。如退火温度过高,则引物难以在复性过程中结合到模板上,难以有效扩增目的基因。一般在Tm值允许的范围内,尽量选择较高的温度。较高的温度可以增加引物与模板结合的特异性,但实际摸索中一般从低温开始,先出现目的条带,目的条带出现后再通过提高温度等方法去除非特异条带。
降落PCR(touchdown PCR,TD-PCR)的基本原理是根据引物的Tm值,设置一系列从高至低的退火温度,开始选择的退火温度高于估计的Tm值,随着循环的进行,退火温度逐渐低至Tm值,从而确保第一个引物与模板杂交时间发生在最佳互补的反应物之间,最终低于Tm值[11,12]。 由于TD-PCR能够设置多个退火温度,使同时检测多种目的基因成为可能。TD-PCR设计多循环反应程序,可以使相连的循环的退火温度越来越低,从而达到最佳扩增条件,很好地弥补普通PCR的不足,用于降低或避免由于变性温度和退火温度相距较远的一对引物、短序列引物、复杂的模板DNA、Mg2+浓度不适当等引起的假阳性扩增[13,14]。
TD-PCR在分析、克隆基因上有较大的优势。对于采用常规PCR需要反复寻找退火温度的目的基因的扩增效果和效率更好,较快、较准地获得目的基因的扩增产物,用于比较分析、克隆等研究。TD-PCR的退火温度设定是一个范围,从高于Tm 5℃左右开始到低于Tm 10℃左右,温度跨度较大。在温度设置中,每一个温度设置2个循环周期。为了更好扩增出目的基因,较低温度设置循环3~5个周期,高温一般设置1~2个循环周期。高温设置循环次数少是由于较高的退火温度虽然增加了引物和模板结合特异性,但也有结合不上的风险,因此如在较高温度未结合,在温度降低的一个循环结合的几率就增大,由于退火温度在递降,因此到一定温度后就出现引物与模板特异的结合,温度较低可以保证每个模板链均可以有效形成双链,保证扩增产量。由于PCR过程中的前几个循环对扩增产物的纯度非常重要,因此前几个循环设定较高的退火温度会增加引物与模板结合的特异性,阻止非特异性产物形成[15,16]。
本研究使用TD-PCR方法扩增了多个目的mRNA逆转录后的cDNA。6个引物的CG含量范围在40.90%~54.50%,退火温度变化范围不大,采用递降温度为55°C降落到52°C,结果显示,除了Tbx21 cDNA未扩增出来外,其他均得以特异性扩增。而常规PCR在一个温度下只能特异性扩增内参。
4 总结
TD-PCR方有效扩增mRNA逆转录后的cDNA,不同cDNA引物可能出现不同Tm值,可通过设置递降的退火温度,一次扩增多个cDNA,并具有较强特异性。虽然个别目的基因或cDNA由于引物设计、Tm值等原因不能同时成功扩增,但总体看多数目的基因或cDNA能够同时成功扩增。不仅提高了扩增成功率,而且提高了PCR的效率。在运动人体科学领域的基因和mRNA研究中采用TD-PCR方法可以提高效率。
[1]Weng JL,Young SL,Gordon DM,et al.First report of phlebotomine sand flies (Diptera:Psychodidae) in Kansas and Missouri,and a PCR method to distinguish Lutzomyia shannoni from Lutzomyia vexator.J Med Entomol,2012,49(6):1460-1465.
[2]Mano J,Furui S,Takashima K,et al.Development and validation of event-specific quantitative PCR method for genetically modified maize MIR604.Shokuhin Eiseigaku Zasshi,2012,53(4):166-171.
[3]Chen YC,Higgins MJ,Maas NA,et al.DNA extraction and Escherichia coli quantification of anaerobically digested biosolids using the competitive touchdown PCR method.Water Res,2006,40(16):3037-3044.
[4]Wunderlichová L,Buňková L,Koutn M,etal.Novel touchdown-PCR method for the detection of putrescine producing Gram-negative bacteria in food products.Food Microbiol,2013,34(2):268-276.
[5]Leng L,Metz CN,Fang Y,et al.MIF signal transduction initiated by binding to CD74.J Exp Med,2003,197:1467-1476.
[6]Bernhagen J,Krohn R,Lue H,et al.MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment.Nat Med,2007,13:587-596.
[7]Schwartz V,Lue H,Kraemer S,Korbiel J,et al.,A functional heteromeric MIF receptor formed by CD74 and CXCR4.FEBS lett,2009,583:2749-2757.
[8]Martin P,Diaz2Meco MT,Moscat J.The signaling adapter p62 is an important mediator of T helper 2 cell function and allergic airway inflammation.EMBO J,2006,25(15):3524-3533.
[9]Hohler T,Reuss E,Adams P,et al.A genetic basis for IFN-γ production and T-bet expression in humans.J Immunol,2005,175:5457-5462.
[10]Pickan C M.Back to the future with ubiquitin.Cell,2004,116(2):181-190
[11]Wunderlichová L,Buňková L,Koutn? M,etal.Novel touchdown-PCR method for the detection of putrescine producing Gram-negative bacteria in food products.Food Microbiol,2013,34(2):268-276.
[12]Asarnow D,Warford A,Fernandez L,et al.Validation and internationalregulatory experience fora mycoplasma touchdown PCR assay.Biologicals,2010,38(2):224-231.
[13]HuangXQ,CloutierS.Hemi-nested touchdown PCR combined with primer-template mismatch PCR for rapid isolation and sequencing of low molecular weight glutenin subunit gene family from a hexaploid wheat BAC library.BMC Genet,2007,8(18):1-5.
[14]Luo YC,Du P,Zhao JZ,et al.A multiplex touchdown PCR for detection of Streptococcus pneumoniae,Haemophilus influenzae type b and Mycobacterium tuberculosis complex in sputum samples.Trop Biomed,2012,29(3):422-428.
[15]Zhang C,Liu GB,Tian PG,et al.Touchdown PCR and overlap extension PCR for generating CD133 (+) cancer stem cell-selective adenovirus vector.Nanfang Yike Daxue Xuebao,2011,31(9):1513-1517.
[16]Bunmanop S,Sakuanrungsirikul S,Manakasem Y.White Kwao Krua variety classification by botanical characteristics and ISSR-Touchdown PCR technique.Genetika,2011,47(7):927-936.
