下坡跑对生长期雌性去卵巢小鼠成骨细胞分化和骨形成的影响
2014-05-12陈祥和李世昌孙朋马涛杨念恩
陈祥和 李世昌 孙朋 马涛 杨念恩
1“青少年健康评价与运动干预”教育部重点实验室,华东师范大学体育与健康学院(上海 200241) 2齐鲁师范学院体育学院
成骨细胞(osteoblast,OB)是重要的骨形成细胞,主要由骨髓间充质干细胞 (bone marrow mesenchymal stem cells,BMSCs)分化产生,对骨生长发育、骨代谢平衡和增加骨密度 (bone mineral density,BMD)等有关键作用[1]。 BMSCs经过一系列分化后成为OB,OB分化是骨生长发育和骨形成的前提。研究发现,调控BMSCs向OB分化及OB成骨能力(亦称矿化能力)的因素很多,如雌激素、细胞因子表达等[2]。而力学刺激在调节OB分化及其成骨能力上也有重要作用。但目前有关运动训练对骨BMSCs、OB分化及其成骨能力的作用在停止训练后是否存在一直有争议。本研究中,小鼠从5周龄开始训练到13周龄结束,处于生长发育期(简称生长期)[3],以观察此时运动训练对骨形成和骨量积累的作用。本研究对生长期小鼠进行8周下坡跑训练[4],以去卵巢安静状态下正常喂养6周建立绝经后骨质疏松症模型[5]。利用全骨髓贴壁筛选法对BMSCs进行原代培养并诱导其向OB分化[6]。 检测培养皿中的细胞数量、BMSCs数量、OB矿化能力和BMD,分别从骨细胞和骨量两个方面验证以下两个假设:(1)下坡跑训练对小鼠骨形成有促进作用;(2)生长期下坡跑训练对小鼠骨影响在去卵巢安静状态喂养一段时间后仍然存在。
1 材料与方法
1.1 实验动物
清洁级4周龄C57BL/6雌性小鼠40只,购自上海西普尔-必凯实验动物有限公司,生产许可证号:SCXK(沪)2008-0016,体重(15.08±1.89)g。适应性喂养1周后,随机分为5组:安静组(C组)、运动组(D组)、安静去卵巢组(C+OVX组)、运动去卵巢组(D+OVX组)和安静假手术组(C+SHAM组),每组8只。动物训练和实验指标检测均在华东师范大学 “青少年健康评价与运动干预”教育部重点实验室完成。
1.2 运动方案
C组、C+OVX组和C+SHAM组在笼中正常喂养,不进行任何训练。D组和D+OVX组小鼠进行下坡跑训练,方案:跑台速度0.8 km/h,坡度-9°,每次训练40 min,每周训练5次,共训练8周。
1.3 去卵巢手术
第8周最后一次训练结束24 h后,C+OVX组和D+OVX组行去卵巢手术,腹腔注射1%戊巴比妥钠(0.1 g/kg)麻醉小鼠,剪除脊柱两侧长毛,分别在两侧切开1 cm切口,去除卵巢,利用可吸收羊肠线进行缝合,伤口涂抹红霉素软膏。C+SHAM组行假手术。
1.4 取材
最后一次训练结束24 h后,C组和D组小鼠断颈椎处死,75%酒精灭菌,于无菌操作台取股骨和胫骨(去除软组织)以备检测细胞原代培养后BMSCs增殖和OB成骨能力;取小鼠前肢骨(保留软组织)于75%酒精中保存,以备测BMD。C+OVX组、D+OVX组和C+SHAM组小鼠去卵巢喂养6周后,断颈椎处死,取材步骤同上。
1.5 指标检测
1.5.1 BMSCs原代培养及诱导OB分化
基础培养液:GIBICO培养基一瓶(500 ml装),按10%小牛血清和100倍双抗的比例进行培养基配置,配好后放于4℃冰箱中保存备用。诱导分化培养液:基础培养液中加入100倍β-甘油磷酸钠和1000倍维生素C,即配好OB诱导分化培养液。
最后一次训练结束24 h后,剪除已取C组和D组小鼠股骨和胫骨两侧关节,暴露骨髓腔。用20 ml注射器吸取10 ml α-MEM培养基后配1 ml注射器针头冲洗骨髓腔,将骨髓收集在50 ml离心管中,反复摇动将骨髓制成单细胞悬液。细胞计数后接种于6孔板(分A、B两组)进行BMSCs原代培养,培养后第3天更换培养液,第5天时A组进行结晶紫染色和BMSCs的ALP染色测细胞数量。B组BMSCs第7天进行OB诱导分化,每隔2~3天换液,共诱导14天,对诱导完的OB进行Von Kossa染色。利用Blindness法统计细胞总数和BMSCs数量,利用Image J软件统计矿化结节面积。
去卵巢正常喂养6周后,C+OVX组、D+OVX组和C+SHAM组进行BMSCs原代培养并诱导其向OB分化,步骤同C组和D组。
1.5.2 小鼠前肢骨BMD检测
取保存的小鼠前肢骨,利用Hologic Discovery A骨密度仪扫描小鼠前肢桡骨近端,测试BMD。
1.6 统计学分析
利用SPSS17.0分析数据,利用方差分析的LSD分析组间显著性差异。各组参数由均值和标准差()表示,P<0.05为差异的显著性标准,P<0.01为差异的非常显著性标准。
2 结果
2.1 培养皿中的细胞总数、BMSCs和OB矿化能力
表1显示,与C组相比,D组培养皿细胞数量无显著性差异(P>0.05)。D+OVX组培养皿细胞数量显著多于C+OVX组(P<0.01);与C+SHAM组相比,C+OVX组培养皿细胞数量显著下降 (P<0.01);与C+SHAM组相比,D+OVX组培养皿中细胞数量亦显著下降(P<0.01)。
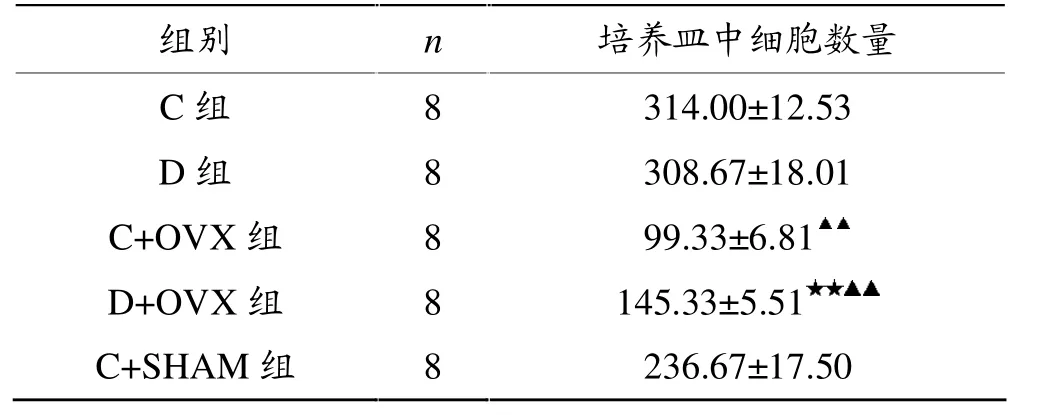
表1 各组培养皿中的细胞总数比较
表2显示,与C组相比,D组BMSCs数量显著增加(P<0.05)。 与C+OVX组相比,D+OVX组BMSCs数量显著增加(P<0.05);与C+SHAM组相比,D+OVX组(P<0.01)和C+OVX组(P<0.01)BMSCs数量均显著下降。
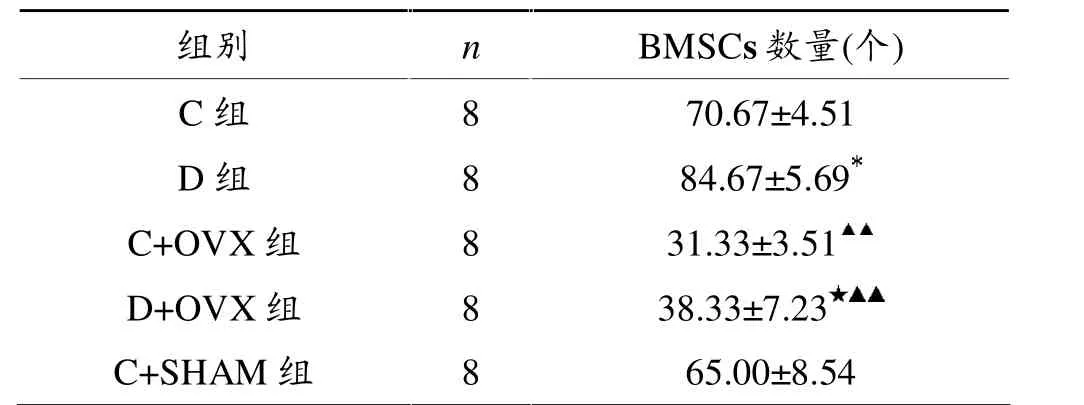
表2 各组小鼠BMSCs数量比较
表3显示,D组矿化结节面积显著大于C组 (P<0.01);D+OVX组矿化结节面积显著大于C+OVX组(P<0.01);与C+SHAM组相比较,C+OVX组(P<0.01)和D+OVX组 (P<0.05)矿化结节面积均显著下降。
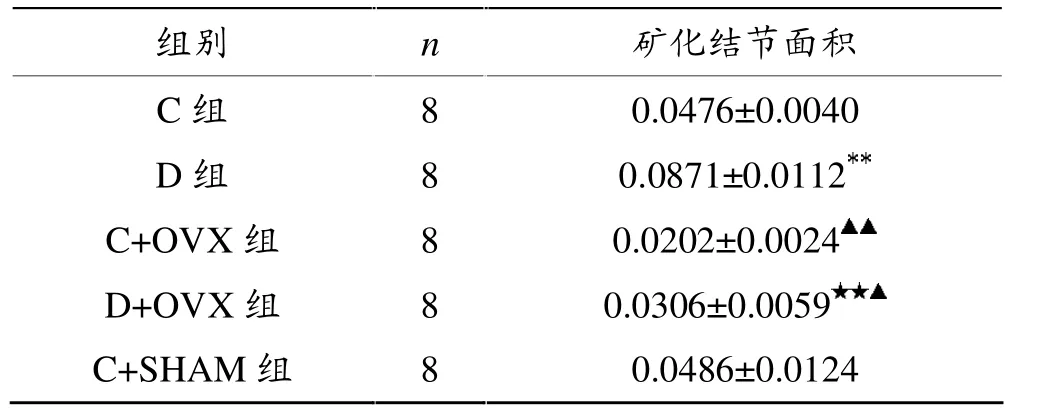
表3 各组小鼠矿化结节面积Von Kossa染色结果比较
2.2 前肢骨BMD
表4显示,与C组相比,D组BMD值明显升高(P<0.05);与C+OVX组相比,D+OVX组BMD值显著升高(P<0.05); 与C+SHAM组相比,C+OVX组BMD值显著下降 (P<0.05); 与C+SHAM组相比,D+OVX组BMD值下降,但无显著性差异(P>0.05)。
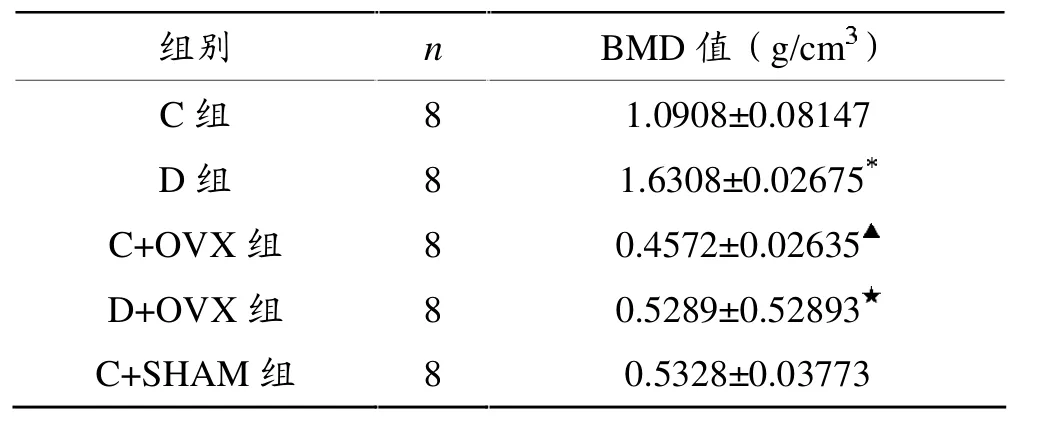
表4 各组小鼠前肢骨BMD值比较
3 讨论
3.1 生长期下坡跑对去卵巢小鼠BMSCs的影响
BMSCs是位于骨髓腔内的具有多向分化潜能的结缔组织前体细胞,因其取材方便,易于体外培养,成为骨组织工程研究的理想种子细胞[7]。不同诱导条件下,BMSCs可分化为OB、软骨细胞、脂肪细胞等[8]。BMSCs增殖分化与力学刺激存在密切关系。Huntsman等[9]研究证实,8周跳跃训练促进小鼠BMSCs增殖并使其数量增多。 Menuki等[10]研究显示,4天攀爬训练后小鼠骨髓腔中CFU-f(即BMSCs)数量变化不明显。本研究中,8周训练结束后,碱性磷酸酶染色结果显示BMSCs数量显著增多,这与Menuki等的研究不一致。其原因可能与运动持续时间长短有关。与4天相比,8周训练时间对小鼠BMSCs增殖形成有效力学刺激。还可能与不同运动方式对骨产生的力学刺激有关。下坡跑训练作用于骨的力学载荷较大,使胞外信号调节激酶(ERK)1/2和蛋白激酶B(AKT)磷酸化,进而调控C-fos基因和蛋白表达,促进BMSCs增殖[11]。而有研究也发现,力学刺激也通过IGF-1和上皮生长因子影响促分裂素原活化蛋白激酶(MAPK)信号通路来促进小鼠BMSCs增殖[12]。
人体研究发现,运动员停训或退役后,运动训练对骨产生的作用降低或完全消失[13]。动物研究发现,运动训练对骨产生的作用在停止训练后消失[14-15]。这提示停止训练后早期运动对骨产生的作用逐渐消失。而有研究却证实,运动训练对骨产生的影响在停止训练后仍然存在[16,17]。 Warden等[18]研究发现,当利用轴向压力加载装置对雌性大鼠骨施加7周载荷后,其作用在停训96周内仍然存在。这表明运动训练对骨产生的作用在停止训练后仍然存在并持续较长一段时间。本研究中,去卵巢静养6周后小鼠BMSCs数量仍较多,说明生长期下坡跑训练对小鼠BMSCs增殖所产生的影响在去卵巢静养6周后仍然存在。但其分子生物学机制仍有待研究。
3.2 生长期下坡跑对去卵巢小鼠OB成骨能力的影响
OB主要由BMSCs分化产生,BMSCs数量增加时,由其分化产生的OB数量也增多,有助于提高OB成骨能力[19]。 运动训练在调控BMSCs向OB分化及OB成骨能力过程中具有重要作用。Menuki等[8]和Mori等[20]在研究4周攀爬训练对雄性小鼠OB影响时,均发现分化产生的OB数量增多且成骨能力增强。本研究中,8周训练结束后D组矿化结节面积明显增大,表明下坡跑训练显著提高OB的成骨能力,与前人研究结果一致。这与BMSCs数量增多和下坡跑训练时地面反作用力对小鼠骨组织产生的有效刺激有关。力学刺激通过PPARγ2促进Runx2表达或降低Runx2结合来提高游离Runx2含量,促进OB分化及其成骨能力[21],还通过Ca2+信号途径、环氧酶-前列腺素E2途径或者蛋白激酶A/蛋白激酶C(PKA/PKC)途径等调控OB分化并提高其成骨能力[22]。
研究发现,运动训练促进去卵巢小鼠OB分化及成熟的相关基因表达[23]。那么生长期下坡跑对小鼠OB矿化能力所造成的影响在去卵巢后是否仍然存在呢?本研究发现,去卵巢6周后小鼠OB矿化能力仍维持在较高水平,说明生长期下坡跑对OB矿化能力所造成的影响在去卵巢静养一段时间后仍然存在。这与Goulet等[24]的研究一致,他们研究发现,早期训练仍可促进去卵巢小鼠TGF-β和Runx2基因表达进而调控OB分化及其成骨能力。这可能与BMSCs数量仍较高有关,当BMSCs数量较多时分化产生的OB也较多,OB成骨能力仍维持在较高水平[19]。本研究中,C+OVX组和D+OVX组OB成骨能力均显著下降。一方面说明本研究去卵巢造模成功,另一方面说明去卵巢后雌激素降低显著降低OB成骨能力。
3.3 生长期下坡跑对去卵巢小鼠BMD的影响
生长期是小鼠骨量增加的敏感期,适宜运动训练对于增加小鼠骨量具有重要作用。Bourrin等[25]对生长期小鼠进行11周跑台训练后发现,下肢胫骨BMD显著增加。Rowas等[26]研究发现,8周游泳训练使雌性C57BL/6小鼠腰椎骨密度显著增加。本研究中,8周下坡跑训练结束后小鼠BMD显著增加,说明下坡跑训练加快生长期小鼠骨形成,增加其桡骨BMD,与前人研究一致。这与小鼠OB成骨能力较高存在关系。 Caruso等[27]研究发现,OB成骨能力较高可加快骨形成使得BMD增加。
雌激素在骨代谢中发挥着重要作用,小鼠去卵巢后雌激素浓度下降易造成骨量下降[23]。本研究中,去卵巢后小鼠前肢骨BMD均显著下降,说明去卵巢后雌激素浓度下降可加速骨吸收,使小鼠前肢骨BMD下降,与Hao等[28]的研究结果一致。本研究中,去卵巢后小鼠BMD仍维持在较高水平,说明下坡跑对小鼠前肢骨BMD产生的影响在去卵巢停训后仍然存在。这可能与去卵巢小鼠BMSCs数量仍较多,OB成骨能力仍然较强有关。Umemura等[29]的研究结果与之相似,他们发现8周跳跃训练对胫骨BMD所造成的影响在24周后还仍然存在。Honda等[30]在其研究中也取得相似结果。
4 总结
下坡跑训练通过促进小鼠骨髓间充质干细胞增殖和提高成骨细胞成骨能力,加快骨形成,增加骨量。生长期下坡跑对小鼠骨髓间充质干细胞增殖、成骨细胞成骨能力和骨密度所造成的影响在去卵巢后仍然存在。
[1]韩金祥.骨分子生物学.北京:科学出版社,2010:54.
[2]Glynn ER,Londono AS,Zinn SA,et al.Culture conditions for equine bone marrow mesenchymal stem cells and expression of key transcription factors during their differentiation into osteoblasts.J Anim Sci Biotechnol,2013,4(1):1186-1191.
[3]Bregman T,Fride E.Behavioral alterations in cystic fibrosis mice are prevented by cannabinoid treatment in infancy.J Basic Clin Physiol Pharmacol,2011,22(2):33-36.
[4]马涛,李世昌,梁晓霞,等.上、下坡跑台运动对去卵巢小鼠骨密度及骨组织形态计量学指标的影响.体育科学,2011,31(1):48-55.
[5]Hagiwara K,Goto T,Araki M,et al.Olive polyphenol hydroxytyrosol prevents bone loss.Eur J Pharmacol,2011,662(1-3):48-55.
[6]Verstappen J,Katsaros C,Torensma R,et al.Bone marrow-derived cells in palatal wound healing.Oral Dis,2010,16(8):788-794.
[7]Shahdadfar A,Fronsdal K,Haug T,et al.In vitro expansion of human mesenchymal stem cells:choice of serum is a determinant of cell proliferation,diffentiation,gene expression,and transcriptome stability.Stem Cells,2005,23(9):1357-1366.
[8]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells.Science,1999,28(4):143-147.
[9]Huntsman HD,Zachwieja N,Zou K,et al.Mesenchymal stem cells contribute to vascular growth in skeletal muscle in response to eccentric exercise.Am J Physiol Heart Circ Physiol,2012,12(1):1-11.
[10]Menuki K,Mori T,Sakai A,et al.Climbing exercise enhances osteoblast differentiation and inhibits adipogenic differentiation with high expression of PTH/PTHrP receptor in bone marrow cells.Bone,2008,43(3):613-620.
[11]Crawford-Young SJ.Effects of microgravity on cell cytoskeleton and embryogenesis.Int J Dev Biol,2006,50(2-3):183-192.
[12]Dai ZQ,Wang R,Ling SK,et al.Simulated microgravity inhibits the proliferation and osteogenesis of rat bone marrow mesenchymal stem cells.Cell Prolif,2007,40 (5):671-684.
[13]Valdimarsson Q,Alborg HG,Duppe H,et al.Reduced training is associated with increased loss of BMD.J Bone Miner Res,2005,20(6):906-912.
[14]Iwamoto J,Yeh JK,Aloia JF.Effect of deconditioning on cortical and cancellous bone growth in the exercise trained young rats.J Bone Miner Res,2000,15(9):1842-1849.
[15]Jarvinen TL,Kannus P,Sievanen H.Estrogen and bone–a reproductive and locomotive perspective.J Bone Miner Res,2003,18(11):1921-1931.
[16]Fujie H,Miyagaki J,Terrier A,et al.Detraining effects on the mechanical properties and morphology of rat tibia.Biomed Mater Eng,2004,14(2):219-233.
[17]Saxon LK,Turner CH.Estrogen receptor beta:the antimechanostat.Bone,2005,36(2):185-192.
[18]Warden SJ,Fuchs RK,Castillo AB,et al.Exercise when young provides lifelong benefits to bone structure and strength.J Bone Miner Res,2007,22(2):251-259.
[19]Gu Q,Cai Y,Huang C,et al.Curcumin increases rat mesenchymal stem cell osteoblast differentiation but inhibits adipocyte differentiation.Pharmacogn Mag,2012,8 (31):202-208.
[20]Mori T,Okimoto N,Sakai A,et al.Climbing exercise increases bone mass and trabecular bone turnover through transient regulation of marrow osteogenic and osteoclastogenic potentials in mice.J Bone Miner Res,2003,18(11):2002-2009.
[21]Platt ID,EI-Sohemy A.Regulation of osteoblast and adipocyte differentiation from human mesenchymal stem cells by conjugated acid.J Nutr Biochem,2009,20(12):956-964.
[22]Zhu T,Dong Y,Sun H.A review on progress of in vitro research of fluid shear stress influence on signaling networks of osteoblasts.Shengwu Yixue Gongchengxue Zazhi,2012,29(6):1207-1211.
[23]Duque G,Huang DC,Dion N,et al.Interferon-γ plays a role in bone formation in vivo and rescues osteoporosis in ovariectomized mice.J Bone Miner Res,2011,26 (7):1472-1483.
[24]Goulet GC,Halonen NR,Koch LG,et al.Osteoblast response to ovariectomy is enhanced in intrinsically high aerobic-capacity rats.Calcif Tissue Int,2011,88(4):325-335.
[25]Bourrin S,Genty C,Palle S,et al.Adverse effects of strenuous exercise:a densitometric and histomorphometric study in the rat.J Appl Physiology,1994,76 (5):1999-2005.
[26]Rowas SA,Haddad R,Gawri R,et al.Effect of in utero exposure to diethylstilbestrol on lumbar and femoral bone,articular cartilage,and the intervertebral disc in male and female adult mice progeny with and without swimming exercise.Arthritis Res Ther,2012,14(1):R17.
[27]Caruso JF,Hamill JL,Hernandez DA,et al.A comparison of isoload and isoinertial leg press training on bone and muscle outcomes.J Strength Cond Res,2005,19(3):592-598.
[28]Hao K,Gong P,Sun SQ,et al.Mechanism-based pharmacokinetic-pharmacodynamic modeling of the estrogen-like effect of ginsenoside Rb1 on neural 5-HT in ovariectomized mice.Eur J Pharm Sci,2011,44 (12):117-126.
[29]Umemura Y,Nagasawa S,Sogo N,et al.Effects of jump training on bone are preserved after detraining,regardless of estrogen secretion state in rats.J Appl Physiol,2008,104(4):1116-1120.
[30]Honda A,Sogo N,Nagasawa S,et al.Bones benefits gained by jump training are preserved after detraining in young and adult rats.J Appl Physiol,2008,105(3):849-853.
