PDTC联合泰素帝对SGC-7901人胃癌细胞抑制效应及其机制
2014-05-10谷晓媛张为强林万隆
谷晓媛,张为强,林万隆
(上海市闸北区市北医院肿瘤专科,上海 200435)
胃癌是威胁人类健康的常见恶性肿瘤之一,患病率和死亡率位居我国城市的第2位,农村的第1位[1]。相关研究表明泰素帝等紫杉类化疗药物有激活核因子-κB(nuclear factor-kappa B,NF-κB)的作用,由于NF-κB具有促进癌细胞生长、抗凋亡等作用,因此其激活在一定程度上拮抗了泰素帝对肿瘤细胞的杀伤效应。二硫代氨基甲酸吡咯烷(pyrrolidine dithiocarbamate,PDTC)是一种巯基化合物,具有抗氧化效应,为NF-κB抑制物。因此推测PDTC可能增加泰素帝的化疗疗效,本实验拟通过观察PDTC合并泰素帝对体外培养的SGC-7901人胃癌细胞的抑制效应,并研究药物作用后NF-κB P65、IκB蛋白及凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)家族包括XIAP及c-IAP2的表达变化,旨在人胃癌细胞系SGC-7901中研究PDTC对于泰素帝化疗疗效的影响,以及研究其可能的作用机理,为临床胃癌提供更为有效的治疗方法。
1 材料与方法
1.1 细胞培养
SGC-7901人胃癌细胞培养于培养液中(RIPM 1640+10%FBS+1%P/S+1%Glutamax),用 Hepes调节pH值为7.2,加双抗(青霉素100 U/ml、链霉素100 μg/ml),置于 5%CO2培养箱 37 ℃ 培养,以0.02%EDTA、0.25% 胰酶消化,每 2~3 d传代1次。
1.2 分组
对照组:加等量Hanks液对照,37℃培养;PDTC组:加PDTC(Sigma公司)至终浓度100 μmol/L,作用24 h;化疗组:泰素帝(法国罗纳普朗克·乐安公司)药物浓度分别为 0.1 μg/ml(D1)、1.0 μg/ml(D2)、5.0 μg/ml(D3)高、中、低三个浓度组,作用 24 h;联合用药组:先加PDTC至终浓度100 μmol/L,作用2 h后再分别加入不同浓度的泰素帝,即0.1 μg/ml(D1P)、1.01 μg/ml(D2P)、5.01 μg/ml(D3P),作用24 h。
1.3 MTT 检测
取生长良好、处于对数增生期的细胞,消化后接种于96孔板,每孔30 000/100 μl,置于CO2培养箱中培养,24 h后随机分组处理,每组设3个平行孔。于处理结束后CO2培养箱中继续培养至24 h,取出细胞进行测定,每孔加入5 mg/ml的MTT 20 μl,置于37℃,5%CO2培养箱中培养4 h,弃去存留的孵育液,于测试前每孔加入DMSO 100 μl,充分溶解结晶物,在酶标仪上于490 nm波长下检测每孔光密度(D490)值。计算抑制率:

1.4 细胞凋亡率的检测
将SGC-7901人胃癌细胞培养24 h后随机分组,分别采用100 μmol/L PDTC、1.0 μg/ml泰素帝及二者联合作用24 h后测定细胞凋亡率。细胞凋亡率采用Annexin V-FITC/PI细胞凋亡检测试剂盒(BD Pharmingen公司)染色,BD FACSCalibur流式细胞仪测定细胞凋亡率,按照试剂盒说明书进行检测。
1.5 实时荧光定量PCR法检测c-IAP2及XIAP基因表达
将SGC-7901人胃癌细胞培养24 h后随机分组,分别采用 100 μmol/L PDTC、1.0 μg/ml泰素帝及二者联合作用24 h后,TRIzol(Invitrogen公司)提取总RNA,根据Fermentas公司的M-MLV操作说明书采用 Oligo(dT)为引物将 RNA反转录成cDNA,cDNA冻存于 -20℃。引物序列见表1。Eppendorf Realplex荧光定量PCR仪,SYBR Green法进行实验,反应条件:95℃ 2 min,95℃变性15 s,59℃退火20 s,72℃延伸20 s,40个循环。用ΔΔCt法进行各基因表达的相对定量。
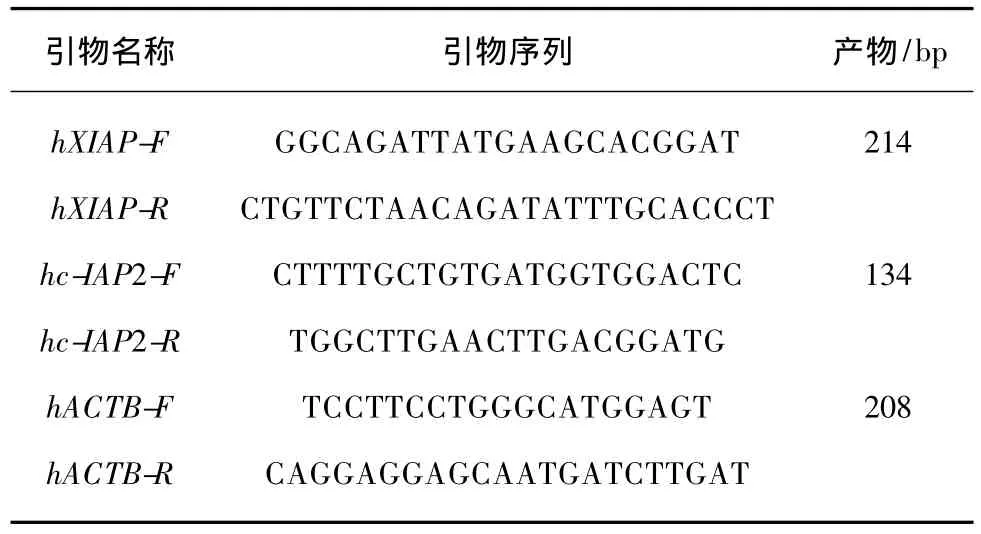
表1 XIAP和c-IAP2基因qPCR检测引物信息Tab.1 Primers of XIAP and c-IAP2 genes
1.6 Western 印迹法检测 NF-κB P65、I-κB 蛋白的表达
将SGC-7901人胃癌细胞培养24 h后随机分组,分别采用 100 μmol/L PDTC、1.0 μg/ml泰素帝及二者联合作用24 h后,采用核质分离试剂盒(碧云天公司,P0028)按照试剂盒操作说明书提取细胞核及细胞质蛋白,采用Lowry法进行蛋白定量,取20 μg样品进行SDS-PAGE电泳、半干转膜(PVDF膜),采用免疫发光法进行蛋白条带显影、拍照、灰度。内参GAPDH蛋白抗体:GAPDH pAb(Bioworld,AP0063),1∶5 000 稀释,蛋白大小:36 000;NF-κB P65 蛋 白 抗 体:NF-κB pAb(cell signal,#3034),1∶1 000 稀释,蛋白大小:65 000;IκB α 蛋白抗体:IκB pAb(cell signal,#9242),1∶1 000 稀释,蛋白大小:35 000。
1.7 统计学处理
采用SPSS 18.0软件进行统计分析。细胞凋亡结果采用卡方检验,其他结果采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 MTT法测定泰素帝合并PDTC对SGC-7901细胞增殖的抑制作用
SGC-7901细胞经不同条件处理后,结果显示各处理组细胞生长均发生了不同程度的抑制现象(P<0.05),随着泰素帝浓度的增加,细胞活力逐渐下降,但各泰素帝组细胞D490值差异无统计学意义(P>0.05);联合用药进一步提高泰素帝对细胞生长的抑制效应,联合用药组较相应浓度泰素帝组差异有统计学意义(P<0.01),见表2。
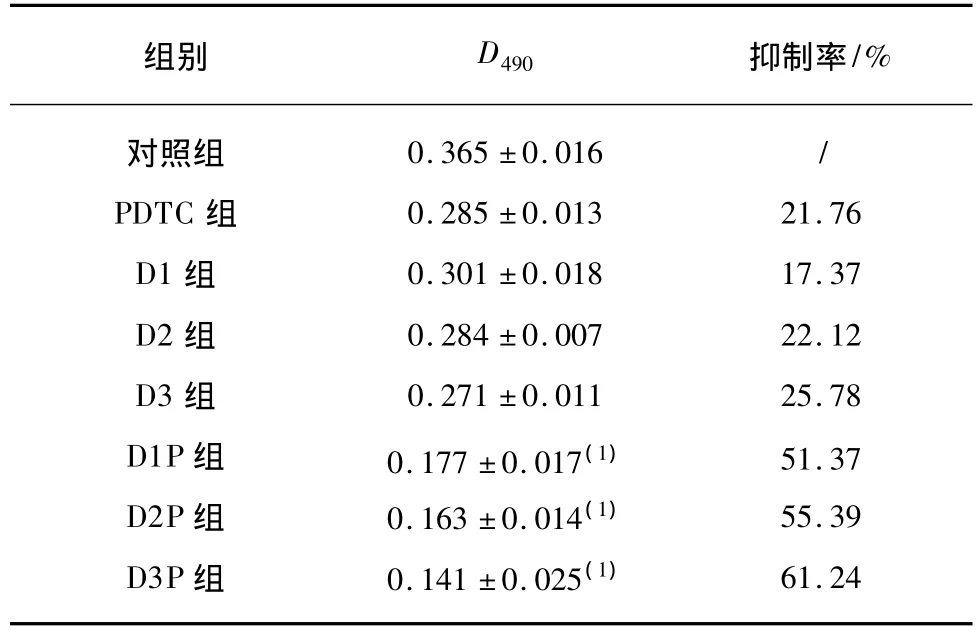
表2 泰素帝合并PDTC对SGC-7901细胞增殖能力的影响Tab.2 Inhibition of SGC-7901 cell proliferation by taxotere combined with PDTC
2.2 流式细胞术检测PDTC及泰帝素作用后SGC-7901人胃癌细胞的凋亡率
100 μmol/L PDTC、1.0 μg/ml泰素帝及二者联合作用24 h,均能导致细胞发生不同程度的凋亡(图1)。空白对照组、联合用药组、泰素帝组、PDTC组的平均凋亡率分别为:9.32% ±1.63%,29.37% ±2.62%,22.40% ±1.41%,20.81% ±0.15%。各药物处理组的凋亡率高于对照组(P<0.01),PDTC处理和泰素帝处理后的凋亡率相差不大都在20%左右(P>0.05),但是两个药物联合作用时,细胞凋亡率明显升高,达到29.37%,与泰素帝及PDTC单药组相比差异有统计学意义(P<0.05),这个结果与前期MTT的结果趋势基本一致。
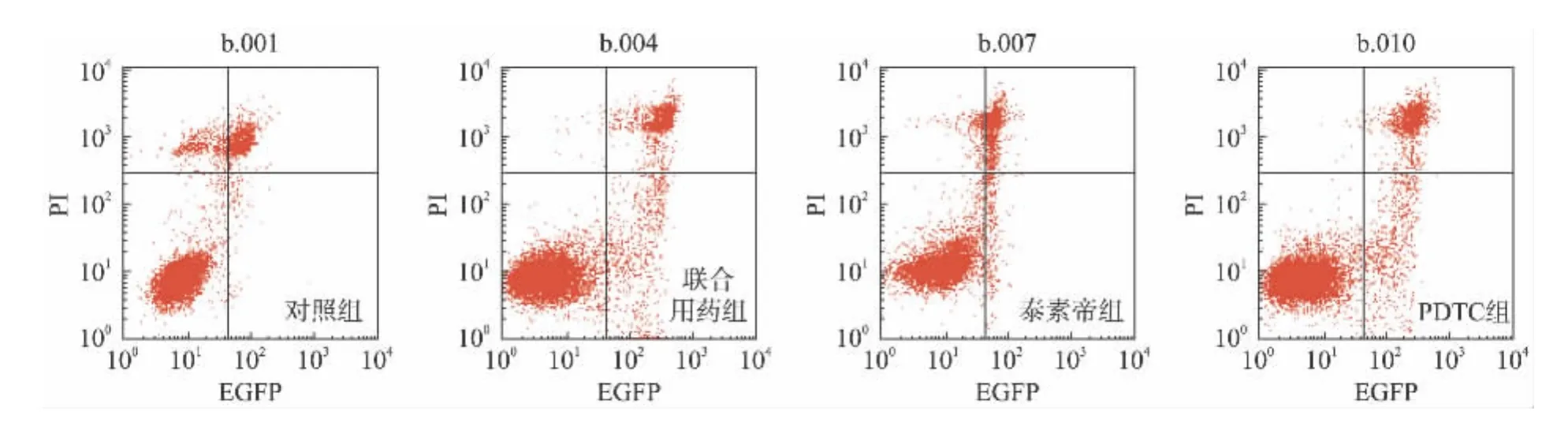
图1 PDTC和泰素帝处理后SGC-7901细胞凋亡检测Fig.1 SGC-7901 cell apoptosis after treated with PDTC and taxotere
2.3 实时荧光定量PCR法检测药物处理后SGC-7901细胞内c-IAP2及XIAP mRNA的表达
SYBR Green法检测XIAPmRNA及c-IAP2 mRNA的扩增曲线见图2,溶解曲线见图3,反应特异性高。基因表达的半定量分析结果见表3、表4。PDTC组XIAPmRNA表达较对照组下降(P=0.05),泰素帝组XIAPmRNA表达较对照组升高(P=0.032),而合并组XIAPmRNA表达较对照组、泰素帝组明显下降(P<0.01),说明联合使用PDTC可抑制泰素帝应用后导致的XIAPmRNA表达升高。PDTC组c-IAP2 mRNA表达较对照组下降(P=0.022),泰素帝组c-IAP2 mRNA表达较对照组升高(P=0.046),合并组c-IAP2 mRNA表达较对照组、泰素帝组明显下降(P<0.01),说明联合使用PDTC同样可抑制泰素帝应用后导致的c-IAP2 mRNA表达升高。
图2 实时荧光定量PCR法检测目的基因扩增曲线Fig.2 Amplification curves of target genes by real-time quantitative PCR detection
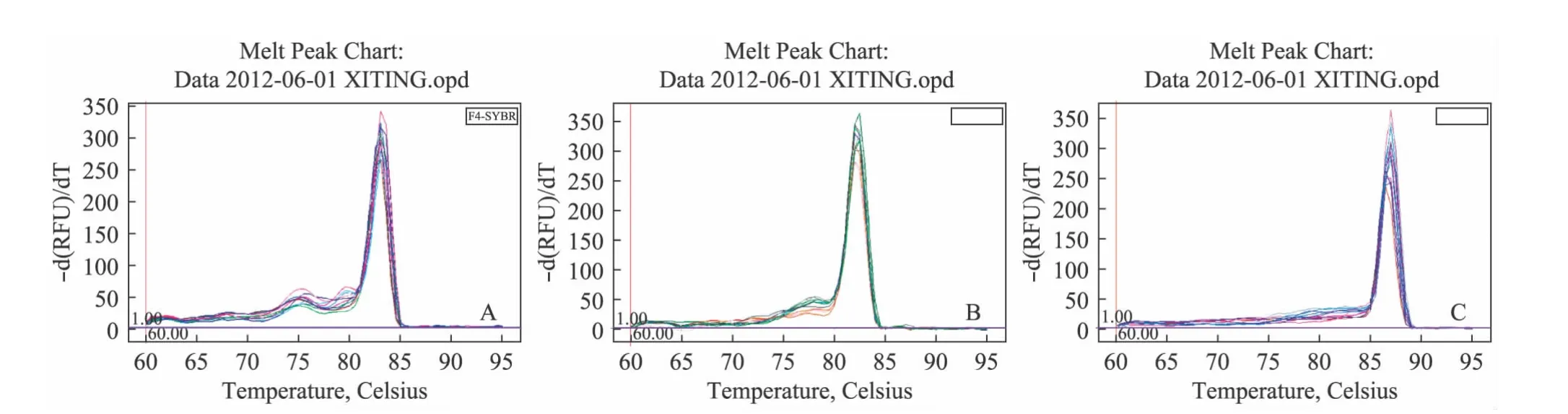
图3 实时荧光定量PCR法检测目的基因溶解曲线Fig.3 Melting curves of target genes by real-time quantitative PCR detection
2.4 Western印迹法检测药物处理后SGC-7901细胞内NF-κB P65及IκB蛋白的表达
采用免疫发光法进行蛋白条带显影,采用灰度分析法进行蛋白条带半定量分析。结果显示泰素帝处理后胞浆NF-κB P65含量增加,但经检验差别无统计学意义(P>0.05),泰素帝作用后胞核 NF-κB P65蛋白含量显著增加(P<0.01);PDTC处理后胞浆及胞核NF-κB P65含量降低(P<0.05),联合作用后胞浆及胞核NF-κB P65蛋白的含量较泰素帝组及对照组明显下降(P<0.01)。各药物作用组IκB含量较对照组均降低(P<0.05),但各药物组间差别无统计学意义(P>0.05)。说明NF-κB抑制剂PDTC可显著抑制NF-κB P65蛋白进入细胞核。
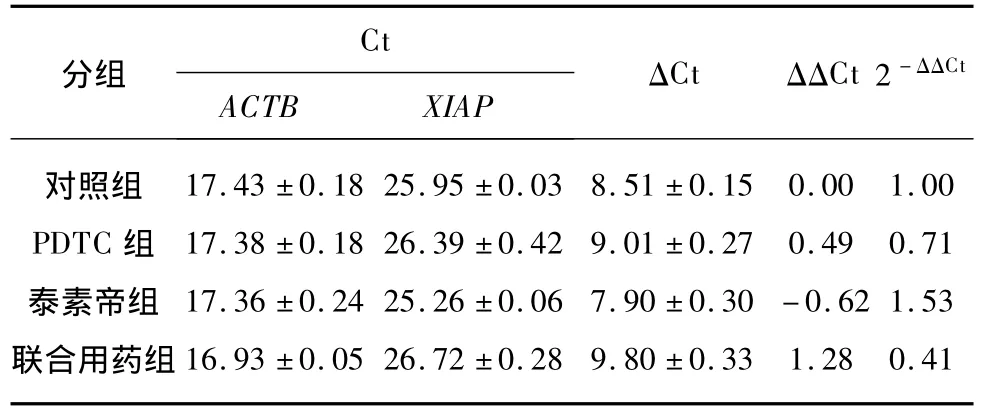
表3 目的基因XIAP表达的半定量分析Tab.3 Semi-quantitative analysis of target gene XIAP expression (x±s)
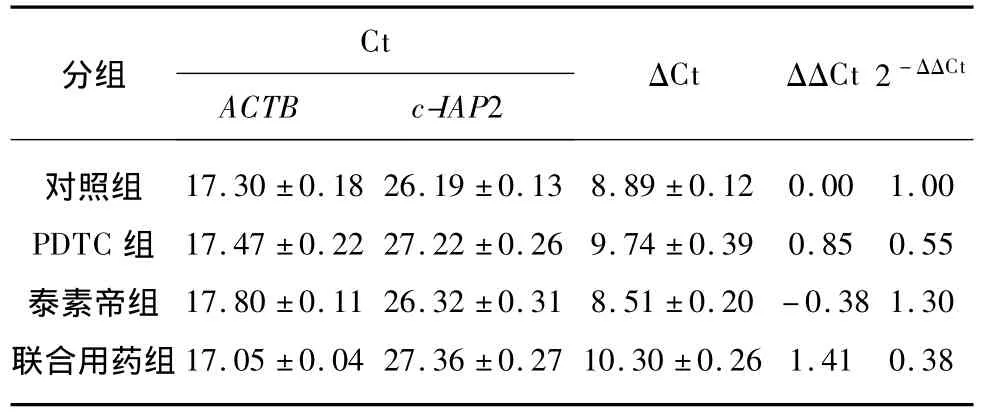
表4 目的基因c-IAP2表达的半定量分析Tab.4 Semi-quantitative analysis of target gene c-IAP2 expression (x±s)
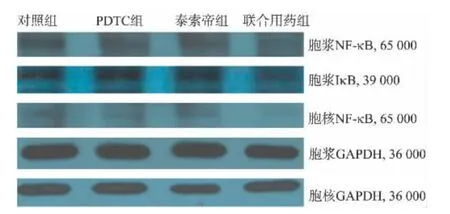
图4 Western印迹法检测药物处理后SGC-7901细胞内NF-κB P65及IκB蛋白的表达Fig.4 Expressions of NF-κB P65 and IκB protein in drug-treated SGC-7901 cells by Western Blot
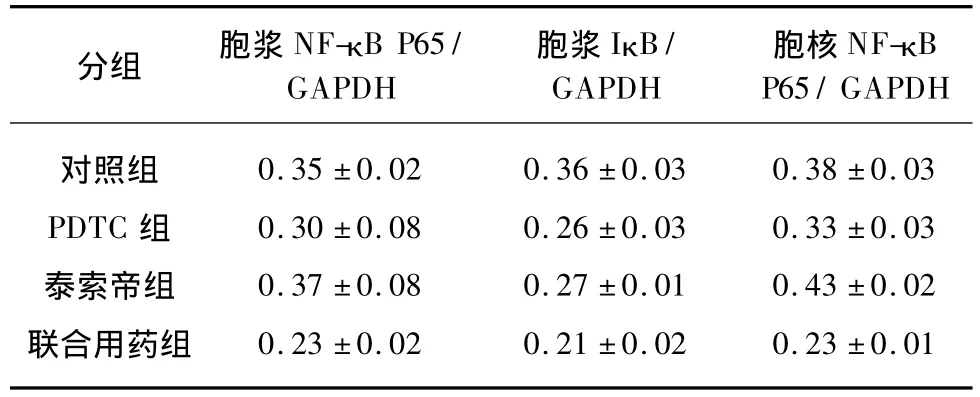
表5 SGC-7901细胞 NF-κB P65及IκB蛋白Western印迹法检测灰度分析结果Tab.5 Grayscale analysis results of NF-κB P65 and I-κB protein in drug-treated SGC-7901 cells by Western blotting
3 讨 论
胃癌对化疗产生耐受被认为是治疗失败的主要原因,其中肿瘤细胞对凋亡的抵抗,被认为是肿瘤对化疗产生耐受的一个极为重要的原因[2-4],并且肿瘤细胞对凋亡的抵抗可能在治疗的过程中获得并得到加强。NF-κB是普遍存在于细胞质中以p50/p65异二聚体为形式的一种核转录因子,与NF-κB 的抑制性蛋白(inhibitor kappa B,IκB)结合而呈非活性状态,可以被多种外来信号如细胞因子(TNFα、IL-1、LIF),应激,物理损伤(紫外线、γ射线),化疗药物(顺铂、阿糖胞苷)等激活[5-6]。激活的NF-κB与IκB解离后转位入核与靶基因启动子/增强子上的κB位点结合,从而调节许多靶基因 (如 cyclinD1,VEGF,bcl-2,IAPs)的 表达[7-10],参与癌细胞的生长、转移、血管生成及凋亡。因此有效地抑制NF-κB的活性可以抑制癌细胞的进展。
PDTC作为NF-κB抑制物,目前认为它主要的抑制机制为:通过降低脂质过氧化物酶活性,抑制IκB的降解,减少NF-κB的核转位;通过与巯基结合,影响 NF-κB的 DNA 结合活性;抑制 IKKα、IKKβ、IKKγ 的表达[11]。
研究表明,NF-κB信号通路在众多肿瘤细胞系内处于持续激活的状态[5-6]。本研究实验表明,NF-κB信号通路在SGC-7901人胃癌细胞系内亦处于持续激活的状态。泰素帝及PDTC单药均可抑制SGC-7901人胃癌细胞系的增殖、促进细胞凋亡,100 μmol/L PDTC作用于SGC-7901细胞24 h后细胞增殖抑制率为21.76%,与赵维波等[12]的研究相近。泰素帝在抑制细胞增殖及促进细胞凋亡的同时,也激活了NF-κB的活性、促进其入核。而合并使用PDTC后,细胞的增殖抑制率及凋亡率均较泰素帝单药组有显著提高,说明PDTC可增强泰素帝的增殖抑制及凋亡诱导作用,抑制泰素帝应用后导致的NF-κB P65蛋白进入细胞核。降低其下游靶基因XIAP及c-IAP2 mRNA表达,研究结果与赵维波等[12]的免疫组织化学染色法结果一致。本研究MTT法结果显示联合用药组的细胞增殖抑制率较相应浓度的泰素帝相比,均有明显的增加,呈现一加一大于二的协同作用。但是细胞凋亡结果却未显示相同的趋势,表现为一加一小于二的现象,可能因为泰素帝作为一种化疗药物,其导致肿瘤细胞死亡的方式是多种多样的,包括直接引起细胞坏死,并非局限于诱导凋亡这种方式。此外,引起细胞凋亡的信号通路除了NF-κB通路外,还有其他很多复杂交叉的信号通路。未来需进一步进行其他信号通路的相关研究以进一步揭示其协同作用机制。
以上结果表明,抗氧化剂PDTC与泰素帝联合运用,具有弥补泰素帝的活化 NF-κB通路这一不足,加强泰素帝对胃癌细胞的杀伤效应。结合目前临床上胃癌化疗中泰素帝的广泛开展,二硫代氨基甲酸盐类NF-κB抑制物可以作为一种协同药物或增敏剂,应用于胃癌的临床实验和临床实践,改善胃癌的治疗效果,具有广泛的临床应用前景。未来需进一步进行动物学、毒理学实验以验证其疗效及安全性。
[1] 代敏,任建松,李霓,等.中国2008年肿瘤发病和死亡情况估计及预测[J].中华流行病学杂志,2012,33(1):57-61.
[2] I Gogvadze V,Orrenius S,Zhivotovsky B.Mitochondria in cancer cells:what is so special about them?[J].Trends Cell Biol,2008,18(4):165-173.
[3] Del Bello B,Toscano M,Moretti D,et al.Cisplatininduced apoptosis inhibits autophagy,which acts as a pro-survival mechanism in human melanoma cells[J].PLoS One,2013,8(2):e57236.
[4] Johnstone RW,Ruefi A,Lowe SW,et al.Apoptosis:a link between cancer genetics and chemotherapy [J].Cell,2002,108:153-164.
[5] Liu YC,Chiang IT,Hsu FT,et al.Using NF-κB as a molecular target for theranostics in radiation oncology research[J].Expert Rev Mol Diagn,2012,12(2):139-146.
[6] Carbone C,Melisi D.NF-κB as a target for pancreatic cancer therapy [J].Expert Opin Ther Targets,2012,16(Suppl 2):S1-10.
[7] Shakibaei M, MobasheriA, LuedersC, etal.Curcumin Enhances the Effect of Chemotherapy against Colorectal Cancer Cells by Inhibition of NF-κB and Src Protein Kinase Signaling Pathways[J].PLoS One,2013,8(2):e57218.
[8] Song L,Xiong H,Li J,et al.Sphingosine kinase-1 enhances resistance to apoptosis through activation of PI3K/Akt/NF-κB pathway in human non-small cell lung cancer[J].Clin Cancer Res,2011,17(7):1839-1849.
[9] Catz SD,Johnson JL.Transcriptional regulation of bcl-2 by nuclear factor kappa B and its significance in prostate cancer[J].Oncogene,2001,20(50):7342-7351.
[10] Yadav VR,Prasad S,Sung B,et al.The role of chalcones in suppression of NF-κB-mediated inflammation and cancer[J].Int Immunopharmacol,2011,11(3):295-309.
[11] Nakashima J,Horiguchi Y,Ohno Y,et al.NF-kappaB inhibitor[J].Nihon Rinsho,2011,69(Suppl 5):160-164.
[12] 赵维波,师水生,王丽鑫.NF-κB抑制剂吡咯烷二硫代氨基甲酸盐提高胃癌细胞对多西他赛化疗的敏感性[J].中国医疗前沿,2011,6(23):26-27.
