C型凝集素受体Dectin-2和Dectin-3的单克隆抗体制备
2014-05-10关建洪朱乐乐贾鑫明
关建洪,朱乐乐,林 欣,贾鑫明
(同济大学医学院免疫学教研室,上海 200092)
C型凝集素受体(C-type lectin receptor,CLR)是一类模式识别受体(pattern recognition receptor,PRR),可以识别病原体细胞壁上的糖成分,在抗真菌免疫中发挥重要作用。Dectin-2(dendritic cellassociated C-type lectin-2)和Dectin-3(dendritic cellassociated C-type lectin-3)属于CLR中的Dectin-2家族,参与机体抗真菌固有免疫应答[1]。dectin-2和dectin-3基因位于人12号染色体和小鼠6号染色体NK基因复合体(natural killer-gene complex,NKC)的端粒区[2],其基因结构在人和小鼠中高度保守,氨基酸同源性分别为 73.9%与 67.3%。Dectin-2和Dectin-3在树突状细胞和巨噬细胞等固有免疫细胞上广泛表达,其结构包括胞质区、跨膜区和胞外区,胞外区具有一个碳水化合物识别域(carbohydrate-recognization domain,CRD),可结合糖结构。Dectin-2和Dectin-3胞内既不含有ITIM基序也不含有ITAM基序,但在识别白色念珠菌菌丝态表面分子α-mannans后可通过FcRγ激活Syk,诱导CARD9/Bcl10/MALT1形成复合体,进而激活NF-κB,表达 TNF-α、IL-1β 和 IL-6等促炎细胞因子,启动机体的抗真菌感染固有免疫应答,并介导适应性免疫应答[3-8]。本研究通过克隆dectin-2和dectin-3胞外区基因并进行原核表达,以纯化的蛋白为抗原免疫小鼠,筛选获得特异性分泌Dectin-2和Dectin-3单克隆抗体的单克隆杂交瘤细胞,并初步鉴定其生物学活性,为进一步研究Dectin-2和Dectin-3的生物学功能研究提供有效的工具。
1 材料与方法
1.1 材料
质粒 pET28a(+)、pRV3-Dectin-2、pRV3-Dectin-3及菌株E.coliDH5α与BL21(DE3)由本实验室保存;RT-PCR反应试剂盒、高保真DNA聚合酶购自美国TaKaRa公司;限制性内切酶BamHⅠ、XholⅠ和T4 DNA连接酶购自美国Thermo公司;质粒提取试剂盒购自美国Axygen公司;PCR产物纯化试剂盒、Cy3标志的山羊抗鼠IgG购自美国Life Technologies公司;Ni-NTA His Bind琼脂糖树脂购自德国Novagen公司;anti-His抗体购自美国AbMART公司;HRP标志的山羊抗鼠IgG购自北京鼎国昌盛生物技术公司。
1.2 方法
1.2.1 pET28a(+)-Dectin-2 与 pET28a(+)-Dectin-3重组表达质粒的构建与鉴定 以人外周血单核细胞(peripheral blood mononuclear cell,PBMC)cDNA为模板,分别扩增dectin-2与dectin-3基因的胞外区DNA序列。上、下游引物见表1。上、下游引物的5'端分别引入BamHⅠ和XholⅠ酶切位点。扩增条件为:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 1 min,30个循环;72℃ 7 min;4℃保存。用BamHⅠ和XholⅠ分别双酶切上述PCR产物和pET28a(+)原核表达载体;T4 DNA连接酶连接后将连接产物转入E.coliDH5α中培养,挑取单克隆进行酶切鉴定及测序。

表1 引物列表Tab.1 Primer list
1.2.2 Dectin-2和Dectin-3胞外区蛋白的原核表达与纯化 将构建好的重组质粒pET28a(+)-Dectin-2和pET28a(+)-Dectin-3分别转化至E.coliBL21(DE3)中,经0.02 mol/L IPTG 25℃诱导表达10 h后,收集细菌,用PBS洗涤1次,再重悬于PBS中,超声波裂解,10 000 r/min,离心半径98 mm,离心30 min,分别取少量上清液和沉淀进行SDS-PAGE电泳考马斯亮蓝染色,结果显示大部分蛋白存在于沉淀中。取沉淀,按照Ni-NTA His Bind琼脂糖树脂试剂盒提供的方法,柱层析纯化蛋白。考马斯亮蓝染色检测目的蛋白的纯度;以anti-His鼠源单克隆抗体为一抗,Western印迹法检测目的蛋白的表达与抗原性。
1.2.3 Dectin-2和Dectin-3胞外区蛋白单克隆抗体的制备 将纯化好的Dectin-2和Dectin-3胞外区蛋白分别与等体积弗氏完全佐剂(CFA)混匀并充分乳化后,将该乳剂在Balb/c小鼠(4只)双肩周围进行皮下注射和后腿进行肌肉注射,每个区域大约用1/8的免疫原,接着将1/2的免疫原进行腹腔注射。首次免疫抗原剂量为100 μg;首次免疫后第2周进行第2次加强免疫,免疫抗原剂量为50 μg;首次免疫后第3周第3次免疫,改用不完全弗氏佐剂(IFA),免疫抗原剂量为50 μg;首次免疫后第4周进行第4次免疫,不使用佐剂,直接用溶于PBS中的50 μg抗原免疫小鼠;第4次免疫后1周,眼眶取血,分离血清,用ELISA和Western印迹法检测血清抗体生物学活性。用PEG方法将小鼠脾细胞和骨髓瘤细胞F0进行融合。用Dectin-2和Dectin-3胞外区蛋白分别对融合的杂交瘤克隆进行筛选,检测它们的特异性和敏感性。ELISA阳性的克隆再用Western印迹法检测,筛选出来的克隆再做2次亚克隆。筛选得到阳性单克隆杂交瘤细胞腹腔注射接种至F1小鼠中(4×106/只),10~14 d后取腹水,纯化,得到单克隆抗体。
1.2.4 血清抗体滴度的测定 采用ELISA法,以纯化的Dectin-2和Dectin-3胞外区蛋白(100 ng/孔)作为包被抗原,一抗为鼠抗血清(1∶500~1∶256 000),同时用免疫前血清做阴性对照,二抗为HRP标记的羊抗鼠IgG,TMB显色,在450 nm处测定吸光度值(D450)。
1.2.5 FACS分析检测Dectin-2与Dectin-3抗体特异性 用慢病毒方法分别将pRV3-Dectin-2和pRV3-Dectin-3转染至RAW 细胞中,使其分别稳定表达人Dectin-2和Dectin-3。以纯化的Dectin-2和Dectin-3单克隆抗体为一抗,Cy3标记的羊抗鼠IgG为二抗,分别对稳定表达人Dectin-2和Dectin-3的RAW细胞进行间接免疫荧光染色,以正常小鼠IgG为阴性对照,用流式细胞仪进行分析、检测Dectin--2和Dectin-3单克隆抗体的特异性。
1.2.6 Western印迹法检测 Dectin-2与 Dectin-3抗体交叉反应性 提取稳定表达人Dectin-2和Dectin-3的RAW细胞及野生型小鼠骨髓来源的巨噬细胞(bone marrow-derived macrophage,BMDM)的总蛋白,Western印迹法检测Dectin-2与Dectin-3抗体的交叉反应性。
1.2.7 Dectin-2与 Dectin-3抗体功能实验检测
将稳定表达人Dectin-2、Dectin-3的RAW 细胞和野生型小鼠BMDM分别用IgG及Dectin-2、Dectin-3单克隆抗体封闭1 h后,加入菌丝态白色念珠菌刺激1 h,提取核蛋白,考察NF-κB(p65亚基)的激活情况以此检测抗体是否具有封闭性功能。
2 结 果
2.1 重组质粒 pET28a(+)-Dectin-2与 pET28a(+)-Dectin-3的构建与鉴定
以人外周血单核细胞(peripheral blood mononuclear cell,PBMC)cDNA为模板,分别扩增dectin-2和dectin-3基因的胞外区DNA序列,产物片段约为500 bp,见图1A。将产物片段经BamHⅠ与XholⅠ双酶切后克隆至pET28a(+)质粒中。酶切鉴定,测序结果与Genebank报告的基因序列完全相符,见图1B,表明将dectin-2与dectin-3基因的胞外区分别成功克隆到pET28a(+)质粒中。
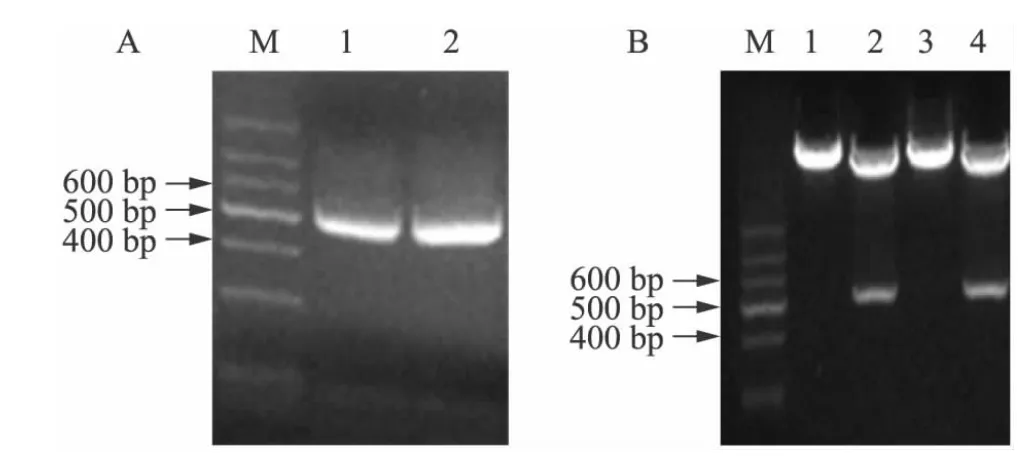
图1 人dectin-2和dectin-3基因胞外区的扩增克隆与重组质粒pET28a(+)-Dectin-2、pET28a(+)-Dectin-3的酶切鉴定Fig.1 Cloning of human dectin-2 and dectin-3 extracellular region and restriction enzyme analysis of the recombinant plasmids pET28a(+)-Dectin-2 and pET28a(+)-Dectin-3
2.2 Dectin-2和Dectin-3胞外区的原核表达、纯化与鉴定
用0.02 mol/L IPTG分别对转化pET28a(+)-Dectin-2和pET28a(+)-Dectin-3质粒的E.coliBL21(DE3)25℃诱导表达10 h后,收集细菌,用PBS洗涤 1次,再重悬于 PBS,超声波裂解,10 000 r/min,离心半径98 mm,离心30 min,弃去上清液,取沉淀,按照Ni-NTA His.Bind琼脂糖树脂试剂盒提供的方法,柱层析纯化蛋白。考马斯亮蓝染色检测目的蛋白的纯度,得到高纯度的目的蛋白,见图2A;Western印迹法检测结果表明目的蛋白表达正确,见图2B。

图2 SDS-PAGE电泳分析纯化的Dectin-2和Dectin-3胞外区蛋白Fig.2 SDS-PAGE analysis of the purified Dectin-2 and Dectin-3 extracellular region proteins
2.3 Dectin-2和Dectin-3血清抗体活性的测定
ELISA法测定鼠血清抗体效价,Dectin-2与Dectin-3血清抗体阴性对照D450值依次为0.058 5和0.055 8,血清抗体稀释度2 倍递减,当Dectin-2与Dectin-3血清抗体稀释度分别达到1∶256 000时检测结果仍为阳性(图3A),表明Dectin-2与Dectin-3血清抗体都具有很高的效价。Western印迹法检测血清抗体结合活性发现,Dectin-2与Dectin-3血清抗体能分别特异结合Dectin-2与Dectin-3胞外区的原核表达蛋白(图 3B)。

图3 Dectin-2与Dectin-3血清抗体活性的测定Fig.3 Identification of the Dectin-2 and Dectin-3 antibodies activity
2.4 Dectin-2与Dectin-3单克隆抗体特异性与识别鼠Dectin-2与Dectin-3的检测
融合杂交瘤细胞后,分别获得8株Dectin-2和12株Dectin-3的阳性杂交瘤细胞;进一步克隆化筛选(ELISA检测,D450>1.00)获得7株Dectin-2和8株Dectin-3的单克隆细胞株,并且其分泌的抗体能够特异结合Dectin-2和Dectin-3胞外区的原核表达蛋白(图4A、4B)。利用单克隆细胞株制备小鼠腹水,纯化获得Dectin-2和Dectin-3的单克隆抗体。随机挑取纯化的Dectin-2和Dectin-3的单克隆抗体各1株。FACS检测显示,Dectin-2单克隆抗体D2-7只能识别稳定转染pRV3-Dectin-2的RAW细胞上表达的人 Dectin-2分子,并不识别稳定转染pRV3-Dectin-3的RAW细胞上表达的人Dectin-3分子;而Dectin-3单克隆抗体D3-2也只识别人Dectin-3分子,并不识别人 Dectin-2分子,说明制备的Dectin-2和Dectin-3单克隆抗体具有高度的特异性。经BLAST比对发现,Dectin-2和Dectin-3基因结构在人和小鼠中高度保守,其胞外区氨基酸同源性分别高达74.1%和65.4%(图4C、4D)。以单克隆抗体D2-7或D3-2为一抗,Western印迹法检测显示,单克隆抗体D2-7和D3-2能够分别特异结合RAW中表达的人Dectin-2和Dectin-3蛋白及小鼠BMDM 中的Dectin-2和Dectin-3蛋白(图4E、4F),说明制备的Dectin-2和Dectin-3单克隆抗体也具有很强的识别鼠Dectin-2与Dectin-3的能力,而这正是由于dectin-2和dectin-3基因结构在人和小鼠中高度保守性。
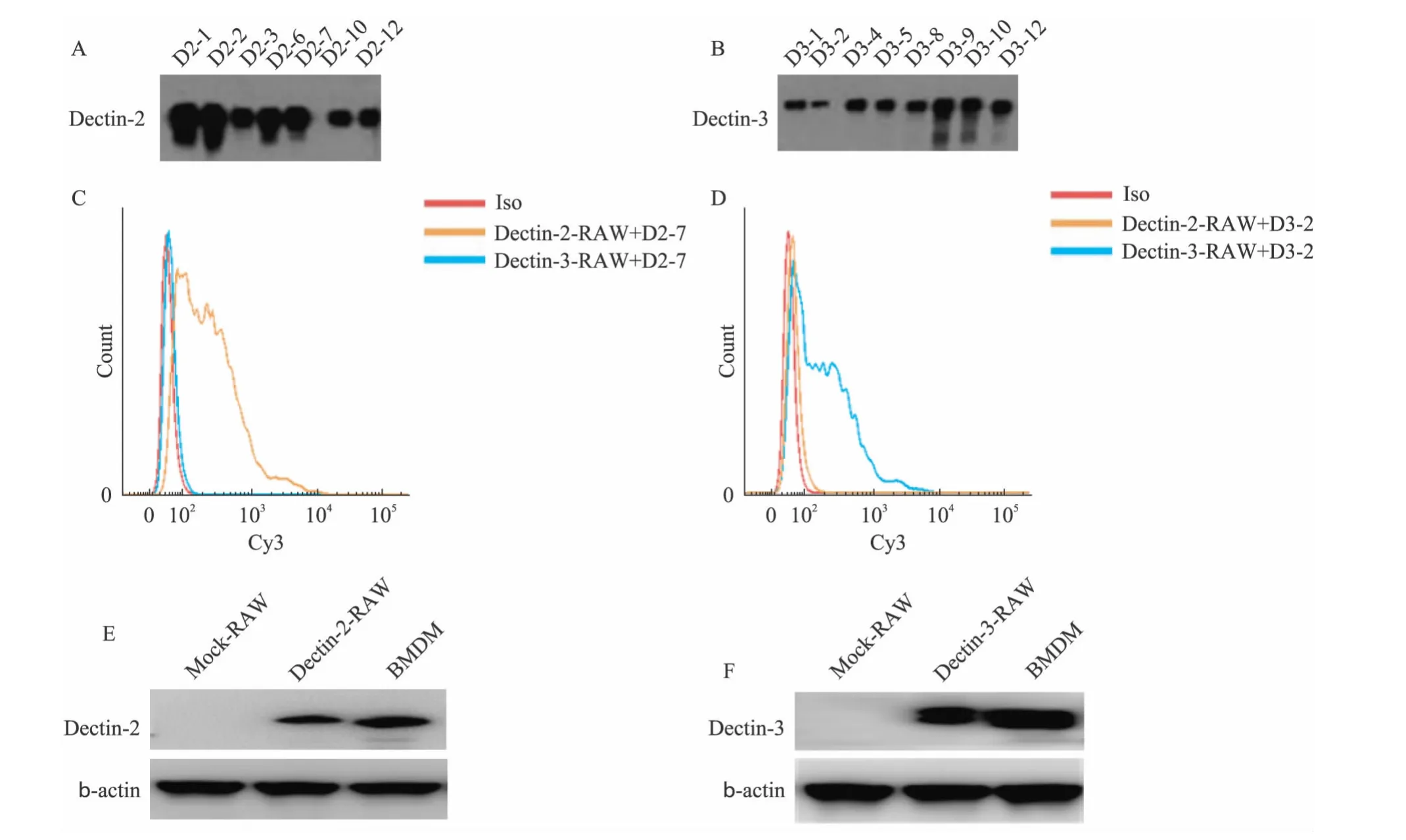
图4 Dectin-2和Dectin-3单克隆抗体特异性与交叉反应性的测定Fig.4 Identification of the specificity and cross-reactivity of Dectin-2 and Dectin-3 mAbs
2.5 抗体功能实验
研究[5-8]表明,Dectin-2与 Dectin-3都能识别白色念珠菌菌丝态,并激活NF-κB。用白色念珠菌菌丝态(MOI=0.1)分别刺激稳定表达人Dectin-2和Dectin-3的RAW 细胞时,都可激活 NF-κB(p65亚基),而利用Dectin-2与Dectin-3单克隆抗体分别预处理RAW时发现:Dectin-2单克隆抗体D2-7和D2-10能够阻断Dectin-2受体介导白念珠菌菌丝态刺激引起的NF-κB激活,说明D2-7和D2-10具有封闭性作用,但D2-12并无封闭性作用而具有激活性作用(图5A);Dectin-3单克隆抗体D3-1和D3-2能够阻断Dectin-3受体介导白念珠菌菌丝态刺激引起的NF-κB激活,说明D3-1与D3-2都具有封闭性作用,但D3-2的封闭性作用更强(图5B)。
用白色念珠菌菌丝态刺激野生型小鼠BMDM细胞时,随着MOI的增高,NF-κB的激活程度也不断增强,见图5C。20 μg/ml的单克隆抗体D2-7与D3-2均能完全阻断MOI=0.1时刺激所引起的NF-κB激活;20 μg/ml的单克隆抗体D2-7也可完全阻断MOI=0.5时刺激所引起的 NF-κB激活(图5C);而20 μg/ml的单克隆抗体D3-2并不能阻断MOI=0.5时刺激所引起的NF-κB激活,需D3-2的浓度增大到60 μg/ml才能完全阻断(图5D)。这说明单克隆抗体D3-2的封闭性作用具有剂量依赖性,也说明单克隆抗体D2-7与D3-2的亲和力不同,即D2-7对Dectin-2的亲和力远高于D3-2对Dectin-3的亲和力。
利用正常小鼠IgG作为对照,进一步验证单克隆抗体D2-7和D3-2的封闭性作用,结果表明,单克隆抗体D2-7和D3-2的封闭性作用具有高度特异性(图5E),而并不是非特异性结合,这一结果与图4C、4D的结果相一致。
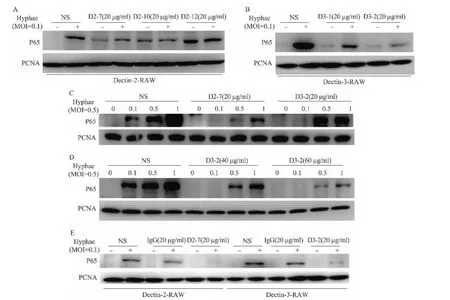
图5 Dectin-2与Dectin-3单克隆抗体的功能检测Fig.5 Identification of the function of monoclonal antibodies against Dectin-2 and Dectin-3
3 讨 论
Dectin-2和Dectin-3是介导机体抗真菌感染固有免疫应答的主要受体,在巨噬细胞和树突状细胞等固有免疫细胞上高度表达。研究[5-10]表明,Dectin-2和Dectin-3可以形成异源二聚体,共同识别白色念珠菌菌丝态,并通过募集FcRγ激活Syk-CARD9-NF-κB通路,启动固有免疫应答效应,发挥抗白色念珠菌感染作用。Dectin-2分子可能与多种自身免疫性疾病相关,包括系统性红斑狼疮、风湿性关节炎和Ⅰ型糖尿病等[3,11];同时,分布于表皮组织的Dectin-2在调节紫外线诱导的免疫抑制中也发挥着重要作用[12]。因此,Dectin-2分子作为一个多功能的受体,在机体的免疫调节和稳态维持两方面发挥着极其重要的作用[3]。而Dectin-3在机体免疫调节与稳态维持中的作用尚有待进一步研究。
抗体是研究分子结构和功能过程中一种非常重要的工具[13],为此本研究制备了Dectin-2和Dectin-3的单克隆抗体。本实验克隆了人 Dectin-2和Dectin-3的胞外区片段,构建了pET28a(+)-Dectin-2与pET28a(+)-Dectin-3原核表达质粒。这两种原核表达质粒在E.coliBL21(DE3)中均可高效表达重组蛋白。利用纯化的目的蛋白免疫Balb/c小鼠制备特异性单克隆抗体,经 ELISA、FACS和Western印迹法检测,制备的单克隆抗体具有较高的效价和高度特异性。同时,制备的 Dectin-2和Dectin-3单克隆抗体具有交叉反应性,能够分别特异结合人和鼠的Dectin-2与Dectin-3蛋白。此外,本实验还成功筛选出了Dectin-2和Dectin-3的封闭性单克隆抗体。Dectin-2和Dectin-3蛋白及其单克隆抗体的成功制备,特别是封闭性单克隆抗体的成功制备,为进一步研究Dectin-2与Dectin-3的生物学功能及进一步寻找针对Dectin-2与Dectin-3信号通路的相关疾病的治疗药物奠定了实验基础。对于Dectin-2等C型凝集素受体的进一步深入研究将有利于我们对机体的免疫调节和稳态维持有更为深入的认识,从而对真菌感染和自身免疫性疾病的治疗、疫苗的研制以及新药的研发等起着指导作用。
[1] Vautier S,Sousa Mda G,Brown GD.C-type lectins,fungi and Th17 responses[J].Cytokine Growth Factor Rev,2010,21(6):405-412.
[2] Yokoyama WM,Plougastel BF.Immune functions encoded by the natural killer gene complex[J].Nat Rev Immunol,2003,3(4):304-316.
[3] Graham LM,Brown GD.The Dectin-2 family of C-type lectins in immunity and homeostasis[J].Cytokine,2009,48(1-2):148-155.
[4] Kerscher B,Willment JA,Brown GD.The Dectin-2 family of C-type lectin-like receptors:an update[J].Int Immunol,2013,25(5):271-277.
[5] Sato K,Yang XL,Yudate T,et al.Dectin-2 is a pattern recognition receptor for fungi that couples with the Fc receptor gamma chain to induce innate immune responses[J].J Biol Chem,2006,281(50):38854-38866.
[6] Robinson MJ,Osorio F,Rosas M,et al.Dectin-2 is a Syk-coupled pattern recognition receptor crucial for Th17 responses to fungal infection[J].J Exp Med,2009,206(9):2037-2051.
[7] Saijo S, IkedaS, YamabeK, etal. Dectin-2 recognition of alpha-mannans and induction of Th17 cell differentiation is essential for host defense against Candida albicans[J].Immunity,2010,32(5):681-691.
[8] Zhu LL,Zhao XQ,Jiang C,et al.C-type lectin receptors Dectin-3 and Dectin-2 form a heterodimeric pattern-recognition receptor for host defense against fungal infection[J].Immunity,2013,39(2):324-334.
[9] Bi L,Gojestani S,Wu W,et al.CARD9 mediates dectin-2-induced IkappaBalpha kinase ubiquitination leading to activation of NF-kappaB in response to stimulation by the hyphal form of Candida albicans[J].J Biol Chem,2010,285(34):25969-25977.
[10] Kiefer F,Brumell J,Al-Alawi N,et al.The Syk protein tyrosine kinase is essentialforFcgamma receptor signaling in macrophages and neutrophils[J].Mol Cell Biol,1998,18(7):4209-4220.
[11] Wandstrat A,Wakeland E.The genetics of complex autoimmune diseases:non-MHC susceptibility genes[J].Nat Immunol,2001,2(9):802-809.
[12] Aragane Y,Maeda A,Schwarz A,et al.Involvement of dectin-2 in ultraviolet radiation-induced tolerance[J].J Immunol,2003,171(7):3801-3807.
[13] 卢峪霞,黄志刚,陈锡梅,等.Argonaute系列蛋白多克隆抗体制备和鉴定及组织定位[J].同济大学学报:医学版,2009,30(1):23-31.
