IL-33转基因小鼠骨髓造血干/祖细胞向髓系细胞分化的能力增强
2014-05-10石桂英杨亚军张连峰
白 琳,石桂英,高 珊,杨亚军,高 昆,张连峰
(中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
IL-33转基因小鼠骨髓造血干/祖细胞向髓系细胞分化的能力增强
白 琳,石桂英,高 珊,杨亚军,高 昆,张连峰
(中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
目的 利用IL-33转基因小鼠研究IL-33对造血干/祖细胞的增殖和分化影响。方法 利用流式细胞仪分析IL-33转基因小鼠及同窝野生对照小鼠的外周血、脾脏、骨髓细胞的免疫表型及造血干细胞分化不同阶段细胞的数量变化;利用体外成克隆实验和细胞周期分析研究IL-33对于造血干细胞增殖能力的影响。结果与野生型小鼠相比,IL-33转基因小鼠B细胞和T细胞在外周血中都明显降低,粒细胞在外周血和骨髓中都有明显增加;IL-33转基因小鼠的骨髓造血干细胞和多能祖细胞数量减少,共同淋系祖细胞数量减少,共同髓系祖细胞和粒单系祖细胞数量增加;IL-33转基因小鼠的造血干细胞处于S-G2-M的细胞增多;体外单克隆实验发现IL-33转基因小鼠造血干细胞形成的集落数增加。结论 IL-33转基因小鼠造血干细胞增殖能力增强,更易向髓系细胞分化。
IL-33;流式细胞术;骨髓造血干细胞;髓系细胞
白细胞介素33(Interleukin 33,IL-33)是IL-1类细胞因子家族的成员,通过与其受体ST2结合诱导Th2型细胞因子的产生。IL-33主要表达于Th2辅助性淋巴细胞、肥大细胞等细胞表面。IL-33既可以作为可溶性细胞因子调节Th2细胞免疫刺激肥大细胞产生前炎性因子,又可以作为核基因调控基因转录[1]。在临床上IL-33和ST2与自身免疫病、变态反应性疾病、心血管疾病和神经退行性疾病等的发生发展有关。
IL-33的受体ST2在造血干细胞和祖细胞不同的亚群中表达,包括了造血干细胞、共同髓系祖细胞、共同淋系祖细胞、粒单系祖细胞和巨核单系祖细胞。在肠中CD34+Scal-1+细胞可以由IL-2和IL-33刺激产生的IL-5和IL-9诱导细胞分化为巨噬细胞[2]。IL-33与其他炎症一样可以诱导髓系细胞在外周血中过度堆积[3]。但是IL-33是否直接调节造血干/祖细胞还没有明确的研究。本研究利用IL-33转基因小鼠研究其对造血干细胞增殖和分化的作用。
1 材料和方法
1.1 动物与设备
IL-33转基因小鼠由本所构建[4-5]并繁育,遗传背景为C57BL/6J小鼠【SCXK(京)2009-007】。实验中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准(GC-08-2018)。
主要实验设备为美国 BD公司 Aria流式细胞仪。
1.2 流式分析
外周血细胞取自小鼠眼眶,裂解红细胞后,获得外周血细胞悬液。小鼠脱颈椎处死后,取脾脏、胸腺、后肢骨,置于冰上预冷的PBS中。脾脏和胸腺用磨砂玻片研磨成细胞悬液;后肢骨用5mL注射器将骨髓细胞冲出,并吹打成细胞悬液。将细胞悬液计数,取106细胞标记荧光抗体。
骨髓造血干细胞的分析中用如下抗体进行标记:CD34-FITC、Flt3-PE、CD16/32-Pcrcp-cy5.5、Sca1-PE-Cy7、cKit-APC、Ter-119-Biotin、Gr-1-Biotin、Mac-1-Biotin、B220-Biotin、IL-7R-Biotin、CD4-Biotin、CD8-Biotin、Biotin-APC-Cy7。脾脏、胸腺及外周血细胞标记抗体:CD4-FITC、CD8-Pcrcpcy5.5、B220-PE-Cy7、CD11B-APC-Cy7。上述抗体加入细胞悬液,冰上避光,30 min;加1 mL染色缓冲液,离心,2600 r/min,5 min,弃上清,加200μL染色缓冲液重悬细胞,用50μm尼龙滤膜过滤,冰上避光。使用美国BD公司Aria流式细胞仪检测。
1.3 体外克隆形成实验
细胞染色后,流式细胞仪分选长期造血干细胞(Lin-c-Kit+Sca1+CD34-Flt3-)到U型底96孔板中进行单个干细胞的培养,14 d后记录克隆的数目和大小,判断长期造血干细胞增殖能力。
1.4 细胞周期分析
分离小鼠骨髓细胞,进行造血干细胞染色Sca1-PE-Cy7、cKit-APC、Biotin-APC-Cy7。利用BD固定破膜液处理细胞后,加入Ki67-FITC和7-AAD进行染色,使用美国BD公司Aria流式细胞仪检测。
1.5 统计分析方法
数据分析采用SPSS13.0软件包进行统计分析,各组数据均采用x±s表示。组间资料分析采用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 IL-33对免疫细胞的影响
为了了解IL-33对于免疫细胞的影响,我们选取了2月龄的IL-33转基因小鼠和同窝野生型对照小鼠各5只,进行三次实验。分别取小鼠的外周血、骨髓、脾脏和胸腺组织的细胞通过流式细胞仪检测其免疫细胞的比例。结果显示与对照相比,在外周血中IL-33转基因小鼠的B细胞(B220+)(图1A)和T细胞(CD3+)(图1B)比例明显降低,粒细胞(CD11b+)比例增加(图1C);骨髓中粒细胞比例明显增加(图1C)。骨髓、脾脏和胸腺中的B细胞和T细胞没有明显变化(图1A和B)。结果表明,IL-33过表达对于小鼠免疫系统有着重要影响,特别是髓系细胞变化明显。
2.2 IL-33对造血干细胞的影响
IL-33的靶细胞包括了造血干细胞在内的大多数的免疫细胞[6],为了研究IL-33过表达对于造血干细胞的影响,我们分析了造血干细胞的数量。骨髓造血干细胞表面标记为:LSK(Lin-c-Kit+Sca-1+),长期造血干细胞表面标记为:LT-HSC(Lin-c-Kit+Sca-1+CD34-Flt3-),短期造血干细胞表面标记为:ST-HSC(Lin-c-Kit+Sca-1+CD34+Flt3-),多能干细胞表面标记为:MPP(Lin-c-Kit+Sca-1+CD34+Flt3+)[7]。与野生型小鼠相比,IL-33转基因小鼠的造血干细胞数量明显降低,其中多能干细胞的数量降低的最为明显,长期造血干细胞和短期造血干细胞的数量没有明显变化。因此,IL-33过表达降低了多能干细胞的数量。

图1 IL-33过表达对免疫细胞的影响Note:A:percent of B cell in peripheral blood(PB),bone marrow(BM)and spleen;B:percent of T cell in the PB,spleen and thymus;C:percent of M cell in the PB and BM.Fig.1 IL-33 over-expression influence the cells of peripheral blood,bonemarrow,spleen and thymus
2.3 IL-33对造血祖细胞的影响
造血干细胞有不同层级的分化,多能祖细胞可以继续分化为共同淋系祖细胞(common lymphoid progenitor,CLP,Lin-c-kitlowSca-1lowCD127+)[8](图 3A)和共同髓系祖细胞(common myeloid progenitor,CMP,Lin-c-Kit+Sca-1-CD34+CD16/CD32-)。共同淋系祖细胞进而分化为B细胞、T细胞和NK细胞。共同髓系祖细胞进而分化为粒单系祖细胞(granulocyte-macrophage progenitor,GMP,Lin-c-Kit+Sca-1-CD34+CD16/CD32+)和巨核单系祖细胞(megakaryocyte-erythroid progenitor,MEP,Lin-c-Kit+Sca-1-CD34-CD16/CD32-)[9](图3B)。GMP最终分化为粒细胞和巨噬细胞,MEP最终分化为血小板和红细胞。我们依据不同的标记物检测了IL-33对于造血祖细胞的作用,发现IL-33转基因小鼠的共同淋系祖细胞数量降低,与外周血中B细胞和T细胞比例降低一致。而共同髓系祖细胞和粒单系祖细胞数量增加,与粒细胞比例增加一致。因此,IL-33过表达可能促进了髓系细胞的分化。
2.4 IL-33对造血干细胞成克隆能力的影响
为了了解IL-33对造血干细胞增殖能力的作用,我们分选了长期造血干细胞,接种于96孔板中的甲基纤维素培养基中,14 d后显微镜下观察计算克隆数量和大小。结果显示,IL-33转基因小鼠来源的造血干细胞产生更多的中克隆和小克隆(图4),说明IL-33部分程度上促进了造血干细胞的增殖能力。
2.5 IL-33促进造血干细胞的细胞周期
我们利用细胞增殖的标记物Ki-67和DNA染料7-AAD来鉴定造血干细胞的细胞周期,结果显示,IL-33转基因小鼠的造血干细胞处于G0期(Ki-67-7-AAD-)细胞减少,处于细胞周期G1和S-G2-M的细胞增多(图5)。结果说明,IL-33使得造血干细胞进入了细胞周期。
3 讨论
IL-33属于IL-1家族成员,在多种免疫过程中发挥重要作用。近来很多实验表明造血干细胞可以参与免疫调节,因此IL-33在调节造血干细胞中可能发挥着重要作用。本研究利用IL-33转基因小鼠发现,IL-33诱导造血干细胞进入细胞周期,促进造血干细胞的增殖,并且更多造血干细胞分化为髓系细胞。IL-33对造血祖细胞的调节作用更加明显。
IL-33与其他免疫因子相似,会通过促进造血生长因子的产生诱导髓系细胞在外周血中聚集和激活[10-11]。我们的研究也发现在外周血和骨髓中,IL-33转基因小鼠的粒细胞都是明显增加的。而其共同髓系祖细胞和粒单系祖细胞也是明显增加的。同时我们通过单克隆实验也发现,IL-33转基因来源的造血干细胞形成了更多的粒细胞和巨噬细胞的克隆。因此,IL-33的增加可能直接或间接地促进了造血祖细胞向髓系细胞的分化。
IL-33通过其受体ST-2激活相关的信号传导蛋白,将活化的信号传递到胞内,激活 NF-ΚB和MAPK等信号途径,在细胞分化、细胞凋亡、应激反应以及多种人类疾病的发生和发展中起着重要作用[12]。因此,IL-33调节造血干细胞的信号通路及关键的分子仍然需要进一步的研究。
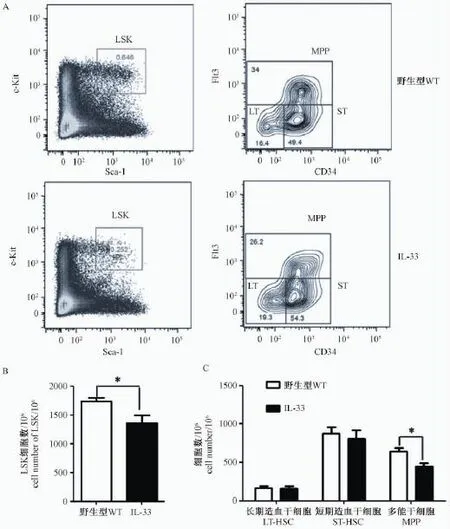
图2 IL-33过表达对造血干细胞的影响Note:A:Representative staining profiles for the HSCs and progenitor populations in BM.B and C:cell number of LSK and LT-HSC,ST-HSC,MPP.Fig.2 IL-33 over-expression influence the number of HSCs

图3 IL-33过表达对造血祖细胞的影响Note:A:Representative staining profiles for the CLP in BM.B:Representative staining profiles for the CMP in BM.C:cell number of CLP.D:cell number of CMP.Fig.3 IL-33 over-expression influence the number of HPCs

图4 IL-33促进了造血干细胞成克隆能力

图5 IL-33影响骨髓造血干细胞的细胞周期
[1]Ali S,Mohs A,Thomas M,etal.The dual function cytokine IL-33 interacts with the transcription factor NF-kappaB to dampen NF-kappaB-stimulated gene transcription[J].Immunol,2011,187(4):1609-1616.
[2]Hepworth MR,Danilowicz-Luebert E,Rausch S,et al.Mast cells orchestrate type 2 immunity to helminths through regulation of tissue-derived cytokines[J].Proc Natl Acad Sci U S A,2012,109(17):6644-6649.
[3]Takizawa H,Boettcher S,Manz MG..Demand-adapted regulation of early hematopoiesis in infection and inflammation[J].Blood,2012,119(13):2991-3002.
[4]Zhiguang X,Wei C,Steven R,et al.Over-expression of IL-33 leads to spontaneous pulmonary inflammation in m IL-33 transgenic mice[J].Immunol Lett,2010,131(2):159-165.
[5]Gao K,Li X,Zhang L,et al.Transgenic expression of IL-33 activates CD8(+)T cells and NK cells and inhibits tumor growth and metastasis in mice[J].Cancer Lett,2013,335 (2):463-471.
[6]Le H,Kim W,Kim J,et al.Interleukin-33:a mediator of inflammation targeting hematopoietic stem and progenitor cells and their progenies[J].Front Immunol,2013,4:104.
[7]Bai L,Shi G,Zhang X,et al.Transgenic expression of BRCA1 disturbs hematopoietic stem and progenitor cells quiescence and function[J].Exp Cell Res,2013,319(17):2739-2746.
[8]Kondo M,Weissman IL,Akashi K.Identification of clonogenic common lymphoid progenitors in mouse bonemarrow[J].Cell,1997,91(5):661-672.
[9]Akashi K,Traver D,Miyamoto T,et al.A clonogenic common myeloid progenitor that gives rise to all myeloid lineages[J].Nature,2000,404(6774):193-197.
[10]Schneider E,Petit-Bertron AF,Bricard R,etal.IL-33 activates unprimed murine basophils directly in vitro and induces their in vivo expansion indirectly by promoting hematopoietic growth factor production[J].J Immunol,2009,183(6):3591-3597.
[11]Schmitz J,Owyang A,Oldham E,et al.IL-33,an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J].Immunity,2005,23(5):479-490.
[12]Chackerian AA,Oldham ER,Murphy EE,et al.IL-1 receptor accessory protein and ST2 comprise the IL-33 receptor complex[J].J Immunol,2007,179(4):2551-2555.
IL-33 transgenic m ice increase them yeloid differentiation in hematopoietic stem cells
BAILin,SHIGui-ying,GAO Shan,YANG Ya-jun,GAO Kun,ZHANG Lian-feng
(Key Laboratory of Human Diseases Comparative Medicine,Ministry of Health;Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences(CAMS)&Comparative Medicine Centre,Peking Union Medical College(PUMC),Beijing 100021,China)
Objective To study the influence of IL-33 on the Hematopoietic stem cells and progenitor cells.M ethods Cells from the peripheral blood,spleen,thymus and bonemarrow were stained with indicated antibodies and analyzed by flow cytometry.The LT-HSCs were sorted and culture using in vitro clonogenic assay.Results The percentage of B cells and T cellswas decreased and the percentage ofM cellswas increased in the peripheral blood from IL-33 transgenicmice.Compared with thewildtypemice,the number of HSCs,MPPs and CLPwas decreased;meanwhile the number of CMP and GMP was increased in the bone marrow from IL-33 transgenic mice.An in vitro clonogenic assay showed that LT-HSCs increased the ability to self-renew from IL-33 transgenic mice.And the percentage of S-G2-M stage hematopoietic stem cellwas increased from IL-33 transgenicmice.Conclusion IL-33 increase themyeloid differentiationin hematopoietic stem cells.
IL-33;Flow cytometry;Hematopoietic stem cell;Myeloid
R-332
A
1671-7856(2014)03-0039-06
10.3969.j.issn.1671.7856.2014.003.009
国家自然科学基金青年科学基金项目(81200256);高等学校博士学科点专项科研基金新教师类资助课题(20121106120034)。
白琳(1984-),女,助理研究员,博士。研究方向:干细胞与衰老。E-mail:bailin49@163.com。
张连峰,E-mail:Zhanglf@cnilas.org。
2014-01-07
研究报告
