四川蒙顶地区老鹰茶香气成分分析和体外功能性效果研究
2014-05-10赵欣李贵节
赵欣,李贵节
(重庆第二师范学院 生物与化学工程系,重庆400067)
老鹰茶是一种樟科木姜子属植物,学名毛豹皮樟的嫩茎叶进行简单的工艺处理制成的一种茶叶。老鹰茶原产于贵州的大娄山,现在在我国南方几个省份也有分布,包括重庆和四川[1-3]。老鹰茶是我国南方少数民族长久以来使用的一种植物代用茶,但是现在在一些大城市也被作为一种凉茶饮用,重庆、成都的老鹰茶相当于北京的大碗茶,是大众化的茶品[4]。老鹰茶具强烈的樟科植物芳香味,性甘凉,有消暑解渴和消食去胀的功效,是一种天然的野生清凉解热饮料[5]。传统饮茶方式是用热水冲泡茶叶,在冲泡过程中大量的挥发性成分散失,泡茶过程中闻到的香气就是这些挥发性物质产生的。近年来关于茶叶香气成分的研究已经陆续展开,对绿茶、红茶和茉莉花茶成分的研究已经取得了进展,西湖龙井含有30余个组分;红茶经过了发酵含有更多的组分,有接近 50个组分;茉莉花茶相对成分较为简单,含有不足10种的组分[6-8],但是这些研究都局限于其组成,对这些香气成分的功能性作用的研究还未见有深入研究。其他的一些茶品香气物质的研究也急待研究,其中老鹰茶香气成分的作用还未见有研究,本研究对四川出产老鹰茶的香气成分进行了分析并对其功能性效果进行了研究。
1 材料与方法
1.1 材料与仪器
老鹰茶 市售四川蒙露茶业公司出品野生老鹰茶;无水乙醚(色谱纯)、癸酸乙酯(色谱纯)、无水硫酸钠(分析纯)上海士瑞化工实业有限公司; NaH2PO4.2H2O、FeCl3、三氯乙酸 广州化学试剂厂;2-硫代巴比妥酸 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH)、抗坏血酸、D- Biotin、L- histidine·HCl (monohydrate)、D- glucose- 6- phosphate、NADP 美国Sigma公司;DMSO 日本纯正化学株式会社;RPMI 1640 培养液、FBS、trypsin、EDTA、100unit/mL Penicillin- Streptomycin 美国 Gibco公司;N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine,MNNG)美国Aldrich公司;TA100营养缺陷型鼠伤寒沙氏菌 美国Sigma公司;AGS 胃癌细胞株、HT-29 结肠癌细胞株 韩国细胞株银行。
LS-B75L型高压蒸气灭菌锅 江阴滨江医疗设备有限公司;WPL-30型恒温培养箱 江东精密仪器有限公司;SDE装置 天长市华玻实验仪器厂;UV-1750型紫外分光光度计 日本岛津公司;Agilent 7890/5975 GC-MS(配置电子轰击源) 美国安捷伦公司;VS-15CFN型冷冻离心机 韩国Vision科学株式会社;MC096型二氧化碳培养箱 日本三洋电机株式会社;Elx800型酶标仪 美国 Bio Tekinstruments公司。
1.2 实验方法
1.2.1 老鹰茶香气物质的提取 取打碎的老鹰茶叶样品50g于SDE装置的2L圆底烧瓶中,加入煮沸的蒸馏水1L,同时加入10-4g/mL浓度的癸酸乙酯0.5mL以及少许玻璃珠,用50mL重蒸乙醚萃取。对电热套加热,微沸下提取20min。乙醚萃取液中加入无水硫酸钠除去水分。4℃静置24h后用N2浓缩提取至0.2mL,重复过程5次,将5次收集到的提取液合并,冷冻干燥后溶入DMSO备用[9]。
1.2.2 气质联用(GC-MS)测定老鹰茶的成分和含量 GC分析条件:HP-5 MS柱,30m×0.25 mm×0.25µm;进样口温度250℃;载气为高纯氦气(He),恒流模式,流速为1.0mL/min;初始温度50℃,保留1min,10℃/min升至220℃,保持1min,5℃/min,升至280℃,保持4min,50℃/min,升至300℃,保持 2min。进样量:1.0mL;进样方式:不分流。EI-MS分析条件:离子源温度:280℃;电离能量:70ev;溶剂延迟时间:4min;电子轰击电离源(EI)。得到的质谱数据对照标准谱库对老鹰茶香气成分进行确认。并且通过各香气组分的峰面积占总峰面积的比值来表示各组分的相对含量。
1.2.3 羟基自由基清除能力测定 将6mol/L浓度的deoxyribos溶液0.2mL,pH7.4的磷酸钠缓冲溶液0.2mL,400mmol/L浓度的FeCl3溶液0.2mL,400mmol/L浓度的FeSO4-EDTA溶液0.2mL,3mol/L浓度的H2O2溶液0.2mL,400mmol/L浓度的抗坏血酸溶液0.2mL和0.2mL老鹰茶香气物质溶液混合,在37℃水浴中放置60min,再加入1mL的三氯乙酸,1mL的2-硫代巴比妥酸,混合溶液在90℃水浴中煮沸20~25min后在532nm处测定吸光度,计算清除自由基能力[10]。
1.2.4 DPPH自由基清除能力测定 将100µL不同浓度老鹰茶香气物质和60µL的0.15mmol/L的DPPH自由基试剂混匀后加入96孔板中室温下避光放置30min,再在540nm波长下测定光度值。测得的OD数值按公式计算:清除DPPH自由基能力(%)=[(对照值-对照空白值)-(样品值-样品空白值)]×100/( 对照值-对照空白值)[11],对照组为没有加入样品孔,空白组为加入样品但没有加入DPPH自由基试剂孔。
1.2.5 Ames抗突变实验 老鹰茶香气物质提取物设两个实验剂量组(1.25、2.5mg/皿)、自发回变组和对照组,每组设3个平行皿。灭菌的试管中加入磷酸盐缓冲液、浓度为 1~2×109个/mL的培养 12h后的菌株0.1mL、样品物质提取物溶液50µL和致突变物(MNNG)50µL。轻微震荡后37℃下放置30min后加入顶层培养基2mL混合,再倒在底层培养基上,37℃培养48h后进行平板计数计算结果。抑制率(%)=[(对照组菌落数-样品处理组菌落数)/(对照组菌落数-自发回变组菌落数)]×100[5]。
1.2.6 MMT法测定老鹰茶香气物质提取物的体外癌细胞增值抑制效果 将 AGS胃癌细胞和 HT- 29结肠癌细胞复苏后接种在含10%灭活小牛血清的RPMI1640培养液中,将癌细胞放置在5%的CO2的培养箱中在37℃下培养,每周更换培养液2~3次并进行传代培养一次。按每孔200µL将含癌细胞培养液接种于96孔培养板,培养液的癌细胞浓度为1×104个/mL。然后将96孔培养板放入培养箱中继续培养24h。吸出96孔板中各孔的培养液,加入含老鹰茶香气物质提取物的培养液200µL。再经过48h培养后,再次吸出各孔内上清液,各孔再加入200µL浓度5mg/mL的MTT试剂后继续培养4h后吸出各孔内的上清液,在每孔中加入200µL的DMSO后避光振荡30min,用酶标仪在540nm波长下测定各孔OD值,按公式:抑制率(%)=[(空白孔OD值-样品孔OD值)/空白孔OD值]×100计算细胞增殖抑制率[12]。
1.3 数据统计
2 结果与分析
2.1 老鹰茶香气成分的分析
由图1和2可以看出,通过GC-MS分析,老鹰茶香气物质中主要含有7H-二苯并[b,g]咔唑(5.600min),癸烷(6.082min),1H-吲哚(9.123min),丙烯酮(11.454min),4-氨基苯乙烯酸(12.906min),苯并[b]硒酚-2-腈(13.510min),2-甲基氨甲基-1,3-二氧戊环(15.726min),(E)-2-氟-3-(4-N,N-二甲端芳氨基)-丙烯酸(16.987min),2-甲基-6-叔辛基酚(17.713min),棕榈酸(18.400min),盐酸吖啶橙(18.645min),2-甲胺甲基-1,3-二氧戊环(18.897min)和2-氨基丁烷(19.829min)。所鉴定出的化合物的含量分别是11.743%、9.856%、2.393%、2.505%、2.853%、2.980%、2.698%、2.428%、1.272%、2.465%、1.981%、0.590%和1.488%。
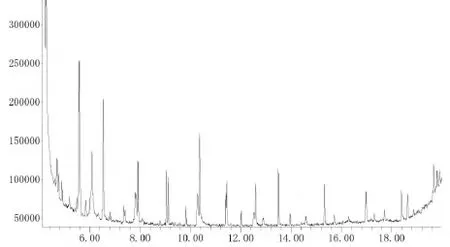
图1 老鹰茶香气物质的色谱图Fig.1 Chromatogram for aroma components of Hawk tea

图2 老鹰茶香气物质的质谱图Fig.2 Mass chromatogram for aroma components of Hawk tea
2.2 老鹰茶香气成分的抗氧化效果
通过测定老鹰茶挥发性物质提取物的羟基自由基和DPPH自由基清除能力可以判断老鹰茶香气物质的抗氧化效果。通过图3和图4可以看出,0.5、1.0、2.0mg/mL三个浓度下,随着浓度的升高,老鹰茶挥发性物质提取物的羟基自由基和DPPH自由基清除能力均得到提高。香气成分中含有的1-吲哚、丙烯酮已经被证明与其他化合物发生反应后能生成具有抗氧化和抗癌效果的有效物质[13-14],香气成分包含的二氧戊环也是合成许多抗氧化物质的重要基团[15],这些成分在一定条件下都能起到有效的抗氧化效果。同时,棕榈酸作为一种功能性成分已经被证明具有抗氧化效果[16],这些物质的存在使得老鹰茶香气成分具有抗氧化效果。

图3 老鹰茶香气物质的羟基自由基清除效果Fig. 3 Effects of aroma components of Hawk tea in hydroxyl radical (OH)radical scavenging activity

图4 老鹰茶香气物质的DPPH自由基清除效果Fig. 4 Effects of aroma components of Hawk tea in DPPH radical scavenging activity
2.3 老鹰茶香气成分的抗突变效果
MNNG作为一种在环境中广泛存在的化学诱变剂和致癌剂,其引起的突变与肿瘤尤其是胃癌的发生密切相关,通过体外抗突变实验可以从一定程度检验老鹰茶的抗突变性和抗癌效果[17-18]。Ames等建立的MNNG诱导TA100鼠伤寒沙门杆菌回复突变试验作为最典型的突变实验被广泛应用于检验茶叶抗突变效果[19-20]。老鹰茶香气成分提取物对MNNG诱导的TA100菌具有一定的抑制作用。由表1可知,提取物浓度为1.25和2.5mg/皿时抑制率分别为39.6%和63.3%,样品对MNNG 致突变物的抗突变试验结果表明老鹰茶香气成分具有对MNNG诱导TA100菌的体外抗突变作用。

表1 老鹰茶香气成分在致突变物N-甲基-N'-硝基-N-亚硝基胍(MNNG,0.4μg/皿)诱导TAIO0菌株下抗突变效果Table 1 Inhibitory effects of aroma components of Hawk tea against MNNG·induced mutation (0.4μg/disc)of nutrient deficiency strain TA100 of Salmonella typhimurium
2.4 老鹰茶香气成分的癌细胞体外增殖抑制效果
观察体外癌细胞增值的变化情况可以从一定程度上判断食品的抗癌功能性[21]。茶叶对人体最直接的作用部位包括胃和肠道,所以本研究选择癌细胞中的一种胃癌细胞和一种结肠癌细胞进行实验。由表2可知,老鹰茶香气成分提取物对体外生长的AGS 胃癌细胞和HT-29 结肠癌细胞进行处理,观察其体外增殖抑制效果。用MTT法观察不同浓度提取物处理癌细胞后的OD值读数可以看到各组细胞的OD值均发生明显变化,高浓度提取物处理癌细胞后,AGS和HT-29细胞的OD值均低于低浓度处理时,通过计算可得出高浓度样品处理时具有更高的体外癌细胞生长抑制率,可见老鹰茶香气成分具有一定的体外抗癌效果。癸烷为基团的一些化合物也具有抑制癌细胞生长的作用[22],有研究也表明包含丙烯酮基团的一些物质也具有抗氧化效果[23],可见老鹰茶中所包含的这些物质也是合成其他一些功能性成分的重要部分,这些香气成分在例如发酵的进一步的深加工中可能转化为一些其他的功能性成分,提高老鹰茶的品质。

表2 老鹰茶香气成分对AGS和HT- 29癌细胞的体外增值抑制效果Table 2 Growth inhibitory effect of aroma components of Hawk tea on AGS and HT-29 cancer cells
3 结 论
从实验结果可以看出,老鹰茶香气物质中主要含有 13种成分, 分别是 7H-二苯并[b,g]咔唑,癸烷,1H-吲哚,丙烯酮,4-氨基苯乙烯酸,苯并[b]硒酚-2-腈,2-甲基氨甲基-1,3-二氧戊环,(E)-2-氟-3-(4-N,N-二甲端芳氨基)-丙烯酸,2-甲基-6-叔辛基酚,棕榈酸,盐酸吖啶橙,2-甲胺甲基-1,3-二氧戊环和2-氨基丁烷。同时通过体外实验证明老鹰茶香气物质具有体外抗氧化、抗突变和抗癌效果。香气成分中的物质使得老鹰茶的香气也产生功能性作用,可以看出改进饮茶方式或加强工业茶饮料的制作工艺,保留老鹰茶的香气成分,可以进一步加强老鹰茶的使用价值。
[1]李俊. 老鹰茶中黄酮成分抗炎免疫作用的研究[J]. 中国药理通讯,2005 (3): 8-8.
[2]计红芳,南海娟,张令文,等. 老鹰茶总黄酮的提取工艺及抗氧化活性研究[J]. 中国食品添加剂,2011 (2): 121-125.
[3]卢晓黎,雷鸣,周建华,等. 四川石棉老鹰茶资源现状及开发[J]. 食品科学,2001, 22(11): 102-104.
[4]沈君子,叶明,舒阿庆,等. 老鹰茶(Litsea coreana Levl.var.lanuginosa)多酚类化合物的提取纯化及EGCG含量测定[J]. 浙江大学学报:农业与生命科学版,2010, 36(3): 329-334.
[5]赵欣,邵林楠,郑妍菲. 老鹰茶的抗突变和体外抗癌效果[J]. 食品工程,2008 (4): 29-31.
[6]代毅,须海荣. 采用SPME-GC/MS联用技术对龙井茶香气成分的测定分析[J]. 茶叶,2008, 34(2): 85-88.
[7]苗爱清,李家贤,何玉媚. 印度阿萨姆亲缘杂交种“秀红”红茶香气化学组成研究[J]. 广东茶叶,1998 (2): 12-16.
[8]陆宁,宛晓春,潘冬. 茉莉花茶香气成分与品质之间关系的初步研究[J]. 食品科学,2004, 25(6): 93-97.
[9]张莹,钟应富,袁林颖,等. 永川秀芽茶特征香气成分研究[J]. 西南农业学报,2012, 26(6): 2046-2049.
[10]Kang HS, Chung HY, Jung, JH, et al. Antioxidant effect of Salvia miltiorrhiza[J]. Archives of Pharmacal Research, 1997, 20(5):496-500.
[11]Banerijee A, Dasgupta N, Bratati D. In vitro study of antioxidant activity of Syzygium cumini fruit[J]. Food Chemistry, 2005, 90(4):727-733.
[12]Zhao X, Kim SH, Qi YC, et a1. Effects of different kinds of salt in comutagenicity and growth of cancer cells[J]. Journal of the Korean Society of Food Science and Nutrition, 2012, 41(1): 26-32.
[13]董肖椿,闻韧,郑剑斌. 1-吲哚基取代β-咔啉生物碱及其衍生物的合成和初步抗肿瘤活性[J]. 药学学报,2004, 39(4): 259-262.
[14]关丽萍,尹秀梅,全红梅,等. 羟基查尔酮类衍生物的合成[J]. 有机化学,2004, 24(10): 1274-1277.
[15]李卫林,罗秋燕,闫福林. 硅胶键合N-丙基氨基磺酸催化合成8-芳基-7,8-二氢-[1,3]二氧杂环戊烯并[4,5-g]苯并吡喃-6-酮类化合物[J]. 有机化学,2011, 31(8): 1282-1285.
[16]李林强,李建科. 华山松籽油的成分分析及其抗氧化的研究[J]. 西北植物学报,2003, 23(10): 1788-1791.
[17]余应年,孙雪敏,冯朝晖,等. 细胞信号转导、基因表达、DNA复制保真度与哺乳细胞非定标性突变--致癌物诱发基因突变分子机制研究[J]. 中国病理生理杂志,2000, 16(10): 1028-1029.
[18]邓大君,朱少侠,陈强,等. MNNG 诱发新生大鼠腺胃癌模型的建立及其在胃癌发病机制研究上的应用[J]. 中华病理学杂志,1994, 23(5): 293-295.
[19]Khan JA, Jalal JA, Ioanndes C, et a1. Assessment of the antimutagenic effect of Doash tea extract fractions[J]. Toxicology and Industrial Health, 2012, 28(10): 867-875.
[20]Bhattacharya U, Mukhopadhyay S, Giri AK. Comparative antimutagenic and anticancer activity of three fractions of black tea polyphenols thearubigins[J]. Nutrition and Cancer, 2011, 63(7): 1122-1132.
[20]王刚,赵欣. 两种白茶的抗突变和体外抗癌效果[J]. 食品科学,2009, 30(11): 243-245.
[21]熊小琴,沈久明,梁峰. 1-对甲苯磺酰基-3-羟基-1,5,8-三氮杂环癸烷的合成及抗肿瘤活性的初步研究[J]. 化学研究与应用,2011,23(4): 466-469.
[22]洪裕闵. 雷丸抗氧化、荧光成分及挥发性成分之研究[D]. 台中:东海大学,2001.
