高温和pH对笃斯越橘花色苷抗氧化活性的影响
2014-05-10郑影栾德士郑洪亮腾飞王萍
郑影,栾德士,郑洪亮,腾飞,王萍*
(东北林业大学林学院,黑龙江哈尔滨150040)
笃斯越橘(学名:Vaccinium uliginosum)也被称为野生蓝莓,为杜鹃花科(Ericaceae)越橘属(Vaccinium.spp)植物,为少见的真正蓝色食物之一[1]。蓝莓果是一种浆果,近似圆形,酸甜度适宜,是老少皆宜的水果。蓝莓果实中含有大量的营养物质,如蛋白质、维生素A等,更重要的是富含叶酸、花色苷、类黄酮等化合物,不仅具有良好的营养保健功能,还具有防止脑神经老化、强心、抗癌软化血管、增强人机体免疫力等作用[2,3]。
花色苷是一种天然水溶性色素,极其不稳定,易受到pH、温度、光照、金属离子及添加剂等因素的影响发生降解反应[4,5]。随着人们对食品营养要求的日益增强,蓝莓鲜果及其加工品越来越受到人们的欢迎,其产品要经过高温杀菌来保证产品质量,延长保质期,可是这一操作对其中含有的花色苷物质具有很大影响,使花色苷单体发生聚合,产生褐变,造成其质量变差[6]。本课题通过采用不同的pH值下对笃斯越橘花色苷精制物进行121℃高温处理,一方面,测定处理后的花色苷残留率及其中含有的4种存在形式花色苷含量,另一方面,采用两个指标测定处理液的抗氧化活性,通过分析其含量及抗氧化活性的变化,为蓝莓花色苷工业化高温处理及产品pH确定提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
蓝莓冻果 大兴安岭生产;无水乙醇 天津市天力试剂有限公司;浓盐酸、氯化钠、氯化钾、醋酸钠、乙醛、亚硫酸均为分析纯 购自天津市东丽区天大化学试剂厂;DPPH· 购自美国Sigma公司;ABTS·+购自上海源叶生物科技有限公司。
SYQ-DSX-280B高温杀菌锅 上海申安医疗器械厂;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;722型分光光度计 上海第三分析仪器厂;PHS-3C雷磁精密pH计 上海精密仪器有限公司;RT-6000酶标分析仪 雷杜设备仪器有限公司。
1.2 实验方法
1.2.1 笃斯越橘花色苷粗提物的制备
笃斯越橘冻果在室温下进行解冻,破碎,以60%乙醇为提取液,料液比为1:5,37℃水浴中提取1h,抽滤,真空浓缩。共提取三次,直至无颜色为止[7]。
1.2.2 笃斯越橘花色苷精制物制备
X-5大孔树脂用乙醇浸泡24h,采用湿法上柱,活化备用。花色苷粗提物以一定流速通过层析柱,平衡吸附4h。用三倍柱体积的蒸馏水洗涤杂质,用pH2.0的70%乙醇洗脱液进行洗脱,洗脱液在40℃条件下减压浓缩[8]。
1.2.3 笃斯越橘花色苷含量及残留率的测定
采用pH示差法测定笃斯越橘花色苷含量[9,10]。不同pH溶液配制方法如下:
pH 1.0:0.2mol/L KCl:0.2mol/L HC1= 25:67, V /V
pH 4.5:0.2mol/L NaAc·3H2O:0.2mol/L HAc = 1:1, V/V
用移液管吸取2mL样品液,分别用pH1.0和pH4.5的缓冲液稀释至一定倍数混匀。以2mL溶剂代替样品作空白组,分别在5l0nm和700nm处测定吸光值。
总花色苷的含量(以矢车菊色素-3-葡萄糖苷计)按下式计算:
A = [ (A510nm-A700nm)pH1.0- (A510nm-A700nm)pH4.5]
ACY(mg/mL)=(A ×Mw×DF)/(26900 ×L)
其中:Mw —矢车菊色素-3-葡萄糖苷的摩尔分子质量(449.2);
DF —稀释倍数;
26900 —矢车菊色素-3-葡萄糖苷的摩尔消光系数;
L —光程,1cm。
花色苷残留率的计算公式如下:
花色苷残留率(%)=[处理液中花色苷含量/处理前花色苷含量]×100
1.2.4 温度为121℃、pH1-12对笃斯越橘花色苷精制物处理
pH2-12:采用B-R缓冲溶液(0.04mol/L的磷酸,0.04mol/L的乙酸,0.04mol/L的硼酸配制成的三酸混合液与0.2mol/L的NaOH溶液混合),用pH计调至所需pH。
pH1:采用0.2mol/L KCl与0.2mol/L HC1以25:67(V/V)比例混合。
取适量的笃斯越橘花色苷精制物,用配制好的pH1-12的B-R缓冲液将其在25mL容量瓶中定容,使定容后的溶液花色苷浓度为0.1mg/mL,将容量瓶在121℃的高温杀菌锅中加热6、8、10 min,取出后立即用流动自来水迅速冷却,即得pH1-12的被处理液,做3组平行试验。
1.2.5 花色苷处理液中4种存在形式花色苷含量测定
各花色苷含量测定用SO2和乙醛对花色苷存在形式的色度的影响。实验中,40μL 10%乙醛加入到2mL的样品中,之后静止45min,另2 mL样品中加入160μL 5% (w/v)SO2,在520 nm下测定吸光值。最后测定未加乙醛或是SO2的样品在520 nm下的吸光值[11]。计算公式如下:
1.2.6 笃斯越橘花色苷处理液抗氧化活性测定
1.2.6.1 笃斯越橘花色苷处理液对DPPH·的清除能力的测定
试剂的配制:1×10-4mol/L DPPH·溶液:准确称取6mg DPPH·用95%的甲醇定容于100mL容量瓶中。
分别取浓度为1、2、6、12、16、20、25、30μg/mL的笃斯越橘花色苷处理液50 μL及250μL 2×l0-4mo1/L的DPPH溶液加入96孔板的同一孔中,避光放置30min,以各自的处理液作参比,分别测定517nm处的吸光度A1。同时测定50μL不同浓度提取液与250μL 95%甲醇混合30min后517nm处的吸光度A2,再测定250μL DPPH溶液与50μL 95%甲醇混合液517nm处的吸光度A3。根据公式计算其清除率[12,13]:
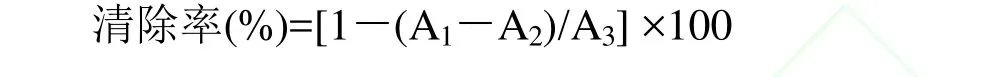
其中:A1----加测定溶液后DPPH·的吸光度;
A2----测定溶液在测定波长下的吸光度;
A3----未加测定溶液时DPPH·的吸光度。
1.2.6.2 笃斯越橘花色苷粗提物对ABTS·+清除能力的测定
配制ABTS·+工作液:准确称取0.0384gABTS·+试剂,定容至10mL;准确称取0.0134g过硫酸钾试剂,定容至10mL。将以上两试剂以1:1的比例混合,避光12h即得工作液(该工作液使用期限为3-4d[14]。
取适量ABTS·+工作液,以 PBS (100mmol/L,pH7.4)溶液将其稀释,使稀释液在414nm波长下吸光度为0.70±0.02。在96孔板的孔中依次加入50μL浓度为0.2、0.5、0.8、1.0、1.6、2.0、2.5μg/mL的花色苷处理液,然后加入300μL稀释好的ABTS·+工作液,同时在另一组加入不同浓度样液的孔中加入300μL B-R缓冲液,避光反应6min,于414nm波长下测吸光值[15]。
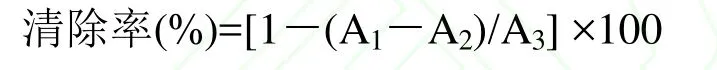
其中:A1----加测定溶液后ABTS·+的吸光度;
A2----测定溶液在测定波长下的吸光度;
A3----未加测定溶液时ABTS·+的吸光度。
1.2.7 统计分析
采用Excel2003进行绘图,通过OriginPro 8.5.1进行数据处理IC50值计算,并进行相关结果比较分析。
2 结果与分析
2.1 笃斯越橘花色苷处理液花色苷残留率
采用pH示差法测定不同pH值、121℃处理蓝莓花色苷不同时间后花色苷残留率,结果如图1所示:
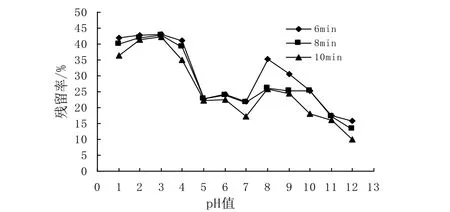
图1 不同pH值下蓝莓花色苷处理液花色苷残留率Fig. 1 Residual rate of anthocyanins in blueberry treatment solution with different pH
在 pH1.0-4.0时,蓝莓花色苷虽降解了很多,但残留率大约在 40.00%左右,花色苷在pH1.0-4.0的稳定性几乎一样,pH值变化对其影响不显著。pH5.0时花色苷较pH4.0时显著下降,pH5.0-7.0内花色苷的降解又趋于平缓,且这一范围内花色苷残留率很低,说明花色苷在酸性偏接近中性时,稳定性接近,但很不稳定。在pH值为8.0时花色苷残留率又有所升高,分析原因为在pH值8.0时有新的花色苷生成。pH8.0-12.0范围内,花色苷残留率几乎呈线性下降,花色苷极其不稳定,在pH12.0时,121℃处理蓝莓花色苷10min后花色苷残留率仅为10.01%。
121℃处理蓝莓花色苷时,处理时间对花色苷残留率有很大影响。结果表明,处理时间越长,花色苷残留率越低。同一pH值下,花色苷残留率6min> 8min> 10min。
2.2 蓝莓花色苷处理液4种存在形式花色苷含量
采用1.2.5中的方法对蓝莓花色苷处理液中4种存在形式花色苷含量进行测定。结果如图2:
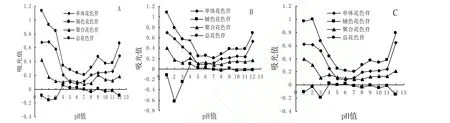
图2 121℃加热不同时间后处理液中4种存在形式花色苷含量Fig. 2 The contents of four forms of anthocyanins existing in solutions after heating at 121℃ for different time
不同 pH值下单体花色苷(MA)、辅色花色苷(SCA)、聚合花色苷(PA)和总花色苷(TA)含量变化大体都呈下降趋势。TA在pH1.0-2.0时变化缓慢,在pH2.0-5.0时呈直线下降,说明花色苷在酸性条件下,随着pH值的变大,花色苷稳定性下降显著。pH5.0-8.0内,含量变化不明显。pH11.0-12.0内TA又有所上升,原因可能为在碱性条件下花色苷颜色深,已成深褐色,使测定结果产生很大误差。
MA含量的变化趋势与TA含量的基本一致,分析原因为其含量在TA含量中占了最大的比率,在pH5.0-7.0时,MA与PA含量接近相同,原因可能为微酸性条件下有利于花色苷的聚合。PA在pH1.0-3.0时含量最高,在pH4.0-12.0时含量变化平缓,得知在酸性条件下PA含量较高,但在微酸性及碱性条件下PA含量较低,且溶液酸碱性对其影响很小。SCA在pH4.0-5.0时有微量的存在,在其它 pH值下几乎不存在,原因可能为提取原料为蓝莓冻果,且经过了大孔树脂纯化处理,其中所含有的金属离子、糖、有机酸等大分子很少,对其辅色作用的促进很弱。
2.3 蓝莓花色苷处理液体外抗氧化实验结果
2.3.1 蓝莓花色苷处理液对DPPH·的清除能力的测定结果
2.3.1.1 不同pH对高温处理的蓝莓花色苷处理液的DPPH·清除能力的影响
不同pH条件下,处理液的DPPH·清除能力的结果如图3所示:
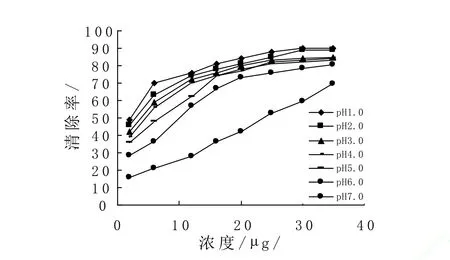
图3 不同pH、浓度的蓝莓花色苷处理液的DPPH·的清除率Fig. 3 The clearance rate of DPPH· of blueberry in different pH and concentration
经121℃处理6min后,处理液对DPPH·清除能力随花色苷浓度的升高而增强。pH1-6时,清除率在花色苷浓度为25µg/mL时趋于平缓,pH7.0时,清除率直线上升,曲线无平缓趋势。pH1.0-4.0时,花色苷对DPPH·的清除率在同一浓度时非常接近,pH7.0、同一花色苷浓度下,花色苷对DPPH·的清除率比在pH1.0-6.0时低很多。
2.3.1.2 pH对不同加热时间的蓝莓花色苷精制物处理液的DPPH·的清除的IC50值比较
将蓝莓花色苷精制物用pH1.0-7.0缓冲液稀释定容后,分别经121℃加热6、8、10min,测定处理液对DPPH·的清除能力,将其对DPPH·清除率的IC50值作比较,结果如图4所示:
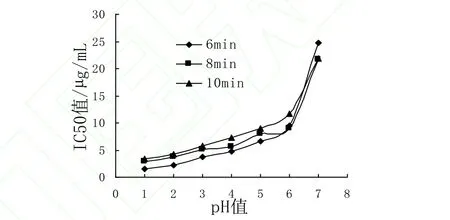
图4 不同加热时间、pH下蓝莓花色苷处理液DPPH·清除率的IC50值Fig. 4 The values of IC50 of blueberry in different heating time and pH
随pH值升高,花色苷处理液对DPPH·清除能力逐渐降低,水溶液接近中性时,清除能力下降的最快。pH1.0-3.0时,121℃加热处理6min下的处理液对DPPH·清除能力最强,而加热处理8、10min下处理液对DPPH·清除能力较接近,说明在强酸性条件下,121℃加热处理时间超过6min后,加热时间对其对DPPH·清除能力影响较小,pH值对其影响占主导作用。pH4.0-6.0时,处理液对DPPH·清除能力随着加热时间增加而降低,其IC50值6min<8min<10min,说明在此pH区间内,加热时间、pH值对其对DPPH·清除能力产生影响。处理液对DPPH·清除能力在121℃加热处理 6min、pH1.0时达到最强,花色苷浓度为 35µg/mL时达到 90%,IC50值为1.496µg/mL。
2.3.2 蓝莓花色苷处理液对ABTS·+的清除能力的测定结果
2.3.2.1 不同pH对高温处理的蓝莓花色苷处理液的ABTS·+清除能力的影响
不同pH条件下,处理液的ABTS·+清除能力的结果如图5所示:
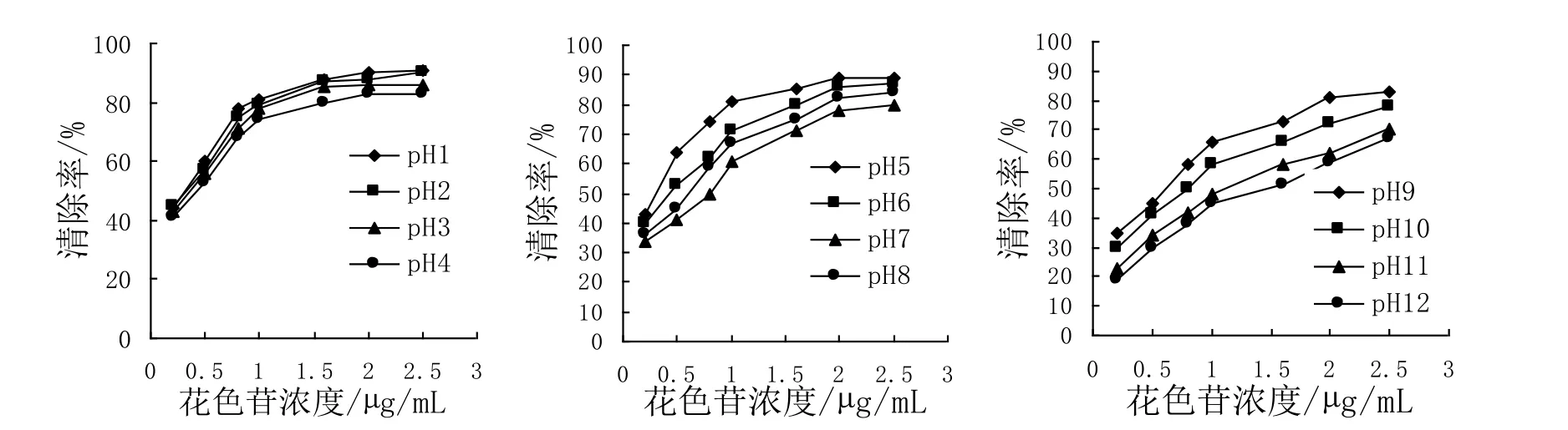
图5 不同pH、浓度的蓝莓花色苷处理液的ABTS·+的清除率Fig. 5 The clearance rate of ABTS·+ of blueberry in different pH and concentration
pH1.0-4.0下,处理液对 ABTS·+清除能力在同一花色苷浓度下很接近,分析原因为强酸性条件下,pH值变化对其影响较小。酸性及中性条件下,花色苷浓度达到一定浓度后,其对ABTS·+清除率曲线趋于平缓;在碱性条件下,蓝莓花色苷精制物对ABTS·+清除率随着花色苷浓度的升高而增大,曲线无平缓趋势。
2.3.2.2 pH对不同加热时间的蓝莓花色苷精制物处理液的ABTS·+的清除的IC50值比较
蓝莓花色苷精制物用pH1.0-12.0缓冲液稀释定容后,分别经121℃处理6、8、10min,测定处理液对ABTS·+清除能力。将其对ABTS·+清除率的IC50值作比较,结果如图6所示:
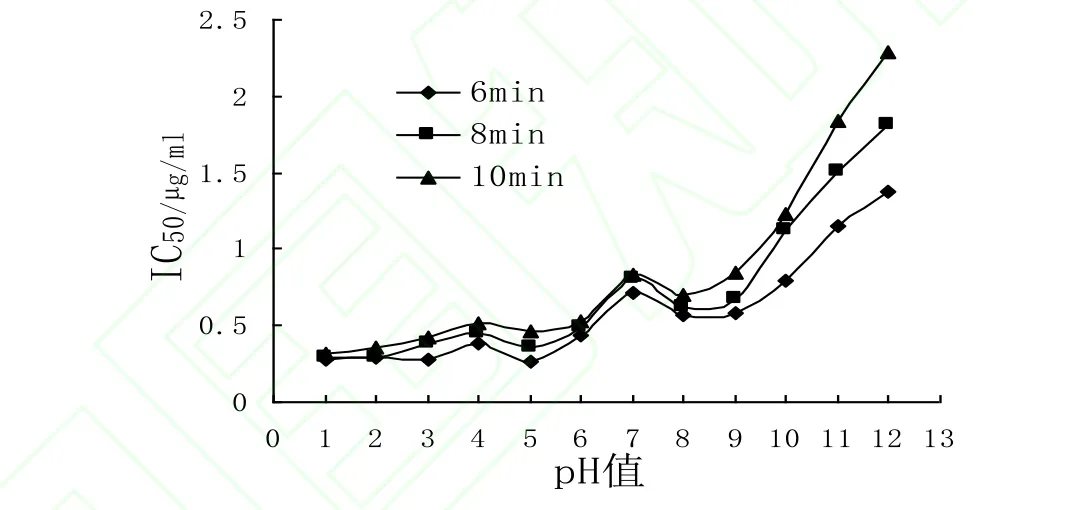
图6 不同加热时间、pH下蓝莓花色苷处理液ABTS·+清除率的IC50值Fig. 6 The values of IC50 of blueberry in different heating time and pH
pH1.0-4.0时加热时间对处理液的ABTS·+清除能力影响很小,尤其是在pH1.0时最为明显;pH5.0时,加热时间对处理液的ABTS·+清除能力影响较明显,清除能力为6min>8min>10min;碱性条件下,加热时间对处理液的ABTS·+清除能力影响明显,且pH值越大,影响越显著。
3 结论
高温处理及 pH值对笃斯越橘花色苷精制物影响很大,随着加热时间延长,其受到破坏程度变大。在强酸性下花色苷稳定性强,pH2.0时,121℃加热6、8、10min时花色苷残留率下降率依次为2.01%、1.31%,加热6min时的花色苷残留率是8、10min时的1.02、1.03倍,碱性条件下的残留率直线下降;花色苷处理液中单体花色苷含量最高,变化趋势与总花色苷近似,酸性条件下的PA含量较高,微酸性及碱性条件下的PA含量较低,辅色花色苷仅在pH4.0-5.0时有微量的存在,在其它 pH值下几乎不存在;加热处理使花色苷的抗氧化活性大大降低,且随着pH值的增大而降低的更明显。故工业生产中应尽量使花色苷溶液在pH2.0左右强酸性范围内,若为保证产品质量防止产品在销售放置过程中因存在杂菌而出现质量问题,可以适当增加高温杀菌时间。
[1]胡雅馨,李京,惠伯棣.蓝莓果实中主要营养及花青素成分的研究[J].食品科学,2007,(10):600-603.
[2]马艳萍.蓝莓的生物学特性、栽培技术与营养保健功能[J].中国水土保持,2006,2:47-49.
[3]李亚东,吴林.蓝莓果实中营养成分分析[J].北方园艺,1996,3:22-23.
[4]李颖畅,孟宪军,周艳等.金属离子和食品添加剂对蓝莓花色苷稳定性的影响[J].食品科学,2009,30(9):80-84.
[5]Bordignon-Luiz, Gauche, Gris, et al. Colour stability of anthocyanins from Isabel grapes (Vitis labrusca L.)in model systems[J].Food science and technology,2007,40:594-599.
[6]刘妍妍.红甘蓝花色苷的提取纯化、稳定性及抗氧化活性研究[D].哈尔滨:东北农业大学,2009.
[7]刘红锦,刘小莉,周剑忠.蓝莓中花色苷提取及其抗氧化活性研究[J].江苏农业学报,2009,25(6):1347-1350.
[8]孟宪军,李颖畅,宣景宏,等. AB-8大孔树脂对蓝莓花色苷的动态吸附与解吸特性研究[J].食品工业科技,2007,28(12):94-97.
[9]李颖畅,孟宪军,张琦,等.蓝莓果主要物质含量及处理方式对其花色苷的影响[J].食品工业科技,2008,29(5):163-165.
[10]孙婧超,刘玉田,赵玉平,等.pH 示差法测定蓝莓酒中花色苷条件的优化[J].中国酿造,2011,(11):171-174.
[11]Margaret Cliff, Marjoire King, Jimmy Schlosser. Anthocyanin, phenolic composition, colour measurement and sensory analysis of BC commercial red wines[J].Food Research International,2007,40:92-100.
[12]杨玲.蓝靛果提取物抗氧化及抗癌作用的研究[D].哈尔滨:东北林业大学,2009.
[13]包怡红,李文星,齐君君等.提取条件对蓝靛果花色苷抗氧化活性的影响[J].食品科学,2010(22):20-24.
[14]李颖畅.蓝莓花色苷提取纯化及生理功能的研究[D].沈阳:沈阳农业大学,2008.
[15]蒋增良,毛建卫,黄俊,等.蓝莓酵素在天然发酵过程中抗氧化性能的变化[J].食品工业科技,201 2(2):194-197.
