叠鞘石斛中联苄类化合物的体外抗氧化活性研究
2014-05-10贾芳夏厚林宁梓君黄萍黄小燕唐建军张廷模
贾芳,夏厚林*,宁梓君,黄萍,黄小燕,唐建军,张廷模
(1. 成都中医药大学药学院,中药材标准化教育部重点实验室,四川 成都 611137)
活性氧,作为正常代谢的中间体,它们包括超氧阴离子(O2-)、羟自由基(·OH)、过氧化氢(H2O2)和脂质自由基(LO·,LOO·,LOOH)。人体中过盛的活性氧将导致细胞膜脂过氧化,损伤DNA和蛋白质,并引发一系列的病理现象[1]。现已知人体与活性氧有关的疾病有60多种。活性氧失调是很多疾病的共同指标,石斛作为传统珍贵中药,在临床上被广泛用于治疗与人体内活性氧代谢失调有关的慢性萎缩性胃炎、糖尿病、皮肤老化和冠心病等疾病[2]。目前,随着大规模的采集,再加资源的更生速度慢,现行药典收载石斛品种的资源已相当匮乏,而叠鞘石斛作为四川道地药材,上世纪七十年代后期又曾大力发展,蕴藏量较大[3],且已为2010版《四川省中药材标准》收载。有研究已显示[4-5],叠鞘石斛具有增强机体免疫力、抗肿瘤、促进胃酸分泌、抗血小板凝集、降血脂、抗氧化、抗衰老等药理作用,而这些疾病的产生很大程度上与体内活性氧的代谢失调有关。为此,本实验首次较系统的研究了叠鞘石斛中联苄类化合物抗氧化活性。
1 材料与方法
1.1 材料与仪器
叠鞘石斛 由四川万安石斛产业开发有限公司提供,经成都中医药大学药用植物教研室卢先明教授鉴定为兰科石斛属植物叠鞘石斛的干燥茎。药材60℃烘干,粉碎过50目筛,备用。
大孔树脂HPD-300 天津海光化工有限公司;1,1-苯基苦基苯肼基自由基(DPPH) 美国Sigma 公司;2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH) 美国Sigma公司;Trolox美国Sigma公司;Flourescein sodium salt(荧光素钠) 美国Sigma公司;Vitamin C 中国医药集团上海化学试剂公司。
BSA124 S型电子分析天平 赛多利斯科学仪器(北京)有限公司;PHB-8型pH计 上海隆拓仪器设备有限公司;VARIOSKAN FLASH 2.4.3全波长多功能酶标仪 Thermo公司。
1.2 实验方法
1.2.1 叠鞘石斛中联苄类化合物制备与纯化 称取适量叠鞘石斛药材粉末,按1:12的比例加入70%乙醇溶液,水浴中回流提取3次,每次120min,抽滤,合并滤液,浓缩至无醇味,加水稀释调整为每毫升含生药1.0g,置于4℃保存备用。取适当体积药液,用水稀释为0.4g生药/mL,经HPD-300型大孔树脂柱除去杂质,吸附饱和后,用5BV蒸馏水洗涤,进一步除杂,用70%乙醇洗脱,洗脱流速为1.0mL/min。收集洗脱液,挥干溶剂后用甲醇定容,参照贾芳等[10]的方法进行测定,得到含有联苄类化合物39.75mg/mL的药液,密封4℃保存备用。
1.2.2 自由基溶液的制备
1.2.2.1 ORAC法反应试剂的制备 精密称取 0.0024g荧光素钠置于 100mL棕色瓶中用75mmol/L 的磷酸钾缓冲液(75mmol/L 的 KH2PO4、75mmol/L 的 K2HPO4)配制成 63µmol/L的溶液,置于 4℃避光保存;AAPH于实验前精密称取 0.4883g置于 100mL容量瓶中用75mmol/L 的磷酸钾缓冲液配制成18.3mmol/L 的溶液;Trolox用75mmol/L 的磷酸钾缓冲液配制为 10µmol/L的原液,测试前用该缓冲液稀释成所需浓度。精密称取 0.1761g VC用75mmol/L 的磷酸钾缓冲液定容至10mL,临用前用缓冲液稀释成所需浓度。
1.2.2.2 DPPH·自由基溶液的制备 精密称取10.01mg的DPPH,置于10mL棕色容量瓶中,用无水乙醇溶解,定容至刻度摇匀。置4℃避光保存。测试前用无水乙醇稀释为1×10-4mol·L-1;精密称取10.03mg VC置于10mL容量瓶中,用无水乙醇溶解,定容至刻度摇匀,临用前稀释成所需浓度。
1.2.2.3 超氧阴离子自由基(O2-·)溶液的制备 精密称取0.0568g邻苯三酚置于50mL容量瓶中,用蒸馏水溶解定容至刻度,制成9mmol/L 的溶液。
1.2.2.4 羟自由基(·OH)溶液的制备 精密称取0.0058g硫酸亚铁置于50mL容量瓶中,用蒸馏水溶解定容至刻度,制成0.75mmol/L 的溶液;精密称取0.0076g邻二氮菲置于50mL容量瓶中,用蒸馏水溶解定容至刻度,制成0.75mmol/L 的溶液。
1.2.3 叠鞘石斛中联苄类化合物抗氧化活性测定方法
1.2.3.1 对AAPH·的清除作用 本实验采用的ORAC法测定,参照张雪[6]的方法。
ORAC法需要设两种对照,即没有添加 AAPH自由基的荧光素钠荧光自然衰减对照(-AAPH)和没有抗氧化剂存在时的自由基作对照(+AAPH)。
1.2.3.2 对DPPH·的清除作用 将不同浓度的供试品溶液100µL和1×10-4mol/L DPPH自由基溶液100µL 加入96孔板中,选择常用抗氧化剂VC作为阳性对照,配制不同浓度,做相同试验;同时以不加DPPH自由基(以100µL无水乙醇代替DPPH自由基)的供试品溶液各浓度作为对照以消除供试品本身颜色对测试结果的干扰,并设DPPH自由基阴性对照(以100µL无水乙醇代替供试品),每组平行设四个复孔。将96孔板放入酶标仪中,振荡1min,并于此条件下保存(室温,避光),30min后在517nm波长处测定其吸光度值A。按如下公式计算自由基清除率:

式中,A0为DPPH阴性对照组的吸光度;A1为样品组的吸光度;A2为样品溶液加无水乙醇对照组的吸光度。

1.2.3.4 对羟自由基(·OH)的清除作用 取30µL 0.75mmol/L的邻二氮菲溶液加入96孔板中,加入60µL pH=7.4的PBS溶液,加入30µL蒸馏水,充分混匀后,加入30µL 0.75mmol/L的硫酸亚铁溶液,混匀后,再加入30µL 1%的H2O2混匀。37℃水浴60min后,在536nm处测定其吸光度(A损);以30µL蒸馏水代替H2O2重复上述操作,测定吸光度(A未损);以30µL供试品溶液代替30µL蒸馏水重复上述操作,测定吸光度(A供);只加PBS溶液和供试品溶液,其他试剂以蒸馏水代替补足,重复上述操作,测定吸光度(A参);只加PBS溶液,其他试剂以蒸馏水代替补足重复上述操作,测定吸光度(A空)。每组平行设四个复孔。按如下公式计算自由基清除率:
·OH 清除率(%)=[( A供- A参- A损- A空)/( A未损- A损)]×100%
2 结果与分析
2.1 对AAPH·的清除作用 联苄类化合物和VC不同浓度的荧光衰退曲线,如图1、2所示。根据荧光衰退曲线下面积计算方法[7],可以计算出不同浓度的联苄类化合物和 VC的荧光衰退曲线下面积(net AUC),如表1所示。通过分析,随着浓度的变化,net AUC与浓度之间有良好的线性关系,如图3、4所示。同时联苄类化合物的ORAC值为0.33mg/L,VC的ORAC值为0.21mg/L,即联苄类化合物清除AAPH·的能力强于VC。

图1 联苄类化合物不同浓度荧光衰退曲线Fig.1 The FL fluorescent decay curve with different concentration of bibenzyl compounds
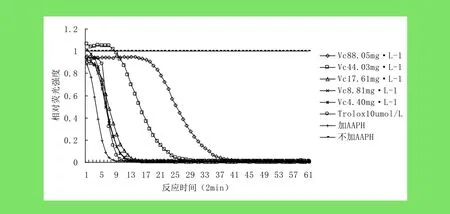
图2 VC不同浓度荧光衰退曲线Fig.2 The FL fluorescent decay curve with different concentration of Vitamin C
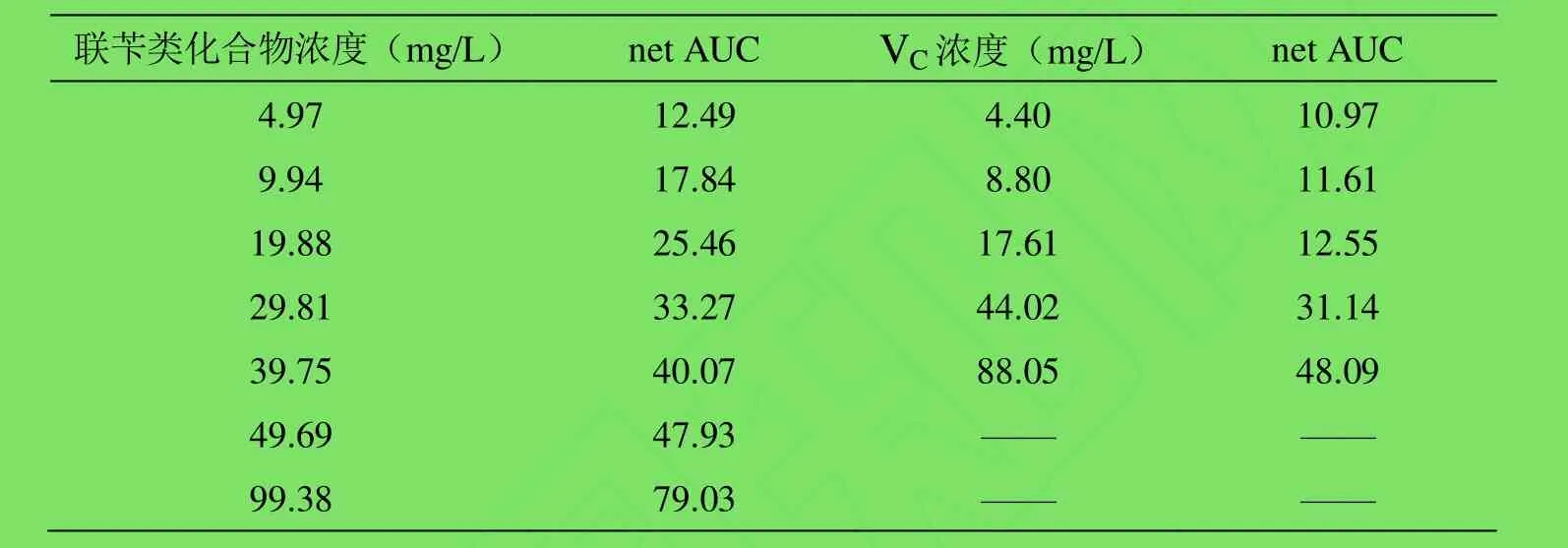
表1 联苄类化合物的荧光衰退曲线下面积(net AUC)Table 1 The net area under the FL fluorescent decay curve (net AUC)of bibenzyl compounds

图3 不同浓度联苄类化合物与net AUC的线性关系Fig.3 The linear relationship between net AUC and bibenzyl compounds concentration

图4 不同浓度VC与net AUC的线性关系Fig.4 The linear relationship between net AUC and Vitamin C concentration
2.2 对 DPPH·的清除作用 联苄类化合物和 VC对DPPH·的清除作用如表2,从表中可以看出,两者清除 DPPH·的能力随着浓度增大而增大,联苄类化合物有较强的清除能力,但弱于VC。
表2 联苄类化合物对DPPH·的清除作用(%,±s,n=4)Table 2 Scavenging activity of bibenzyl compounds against DPPH· (%,±s,n=4)
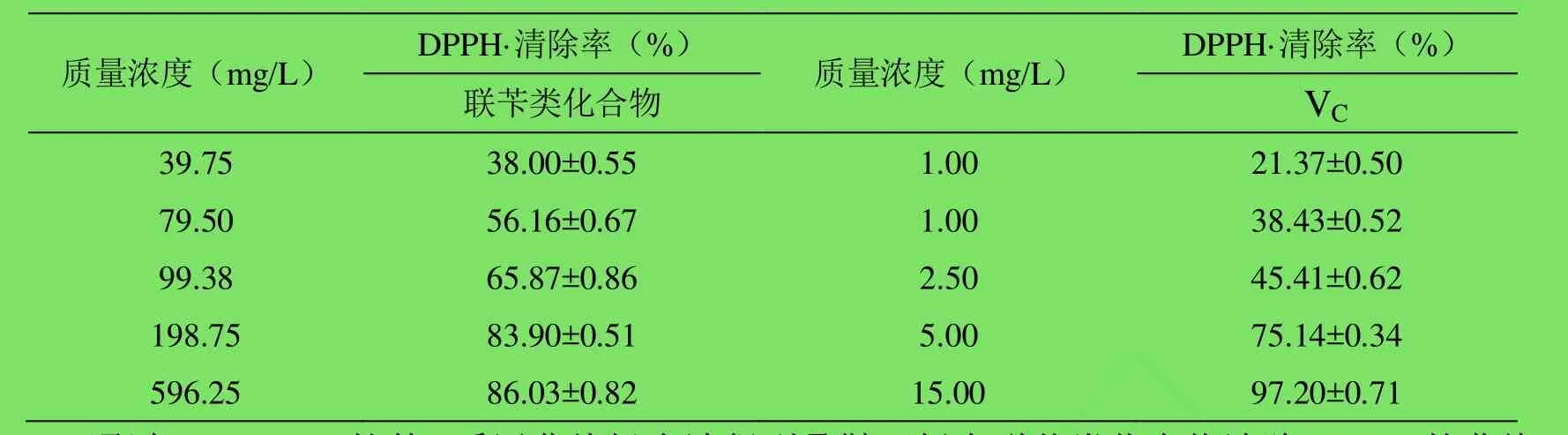
表2 联苄类化合物对DPPH·的清除作用(%,±s,n=4)Table 2 Scavenging activity of bibenzyl compounds against DPPH· (%,±s,n=4)
质量浓度(mg/L) DPPH·清除率(%) 质量浓度(mg/L) DPPH·清除率(%)联苄类化合物 VC 39.75 38.00±0.55 1.00 21.37±0.50 79.50 56.16±0.67 1.00 38.43±0.52 99.38 65.87±0.86 2.50 45.41±0.62 198.75 83.90±0.51 5.00 75.14±0.34 596.25 86.03±0.82 15.00 97.20±0.71
通过SPSS 17.0软件,采用曲线拟合法得到叠鞘石斛中联苄类化合物清除DPPH·的曲线回归方程为:y=12.415+0.751x-0.002x²+2.410×10-6x³,R²=1.000,F=455358.35,p≤0.001,半数清除率(EC50)为 62.89mg/L ;VC清除 DPPH·的曲线回归方程为:y=4.720+17.743x-0.772x²,R²=1.000,F=3992.46,p≤0.001,半数清除率(EC50)为 3.44mg/L。联苄类化合物的 EC50约为VC的18倍。
2.3 对超氧阴离子自由基(O2-·)的清除作用 联苄类化合物和VC对O2-·的清除作用如表3。在实验浓度范围内,两者对O2-·的清除作用呈明显的量效关系,随着质量浓度的增大,清除作用不断增大。
表3 联苄类化合物对O2-·的清除作用(%,±s,n=4)Table 3 Scavenging activity of bibenzyl compounds against· (%,±s,n=4)
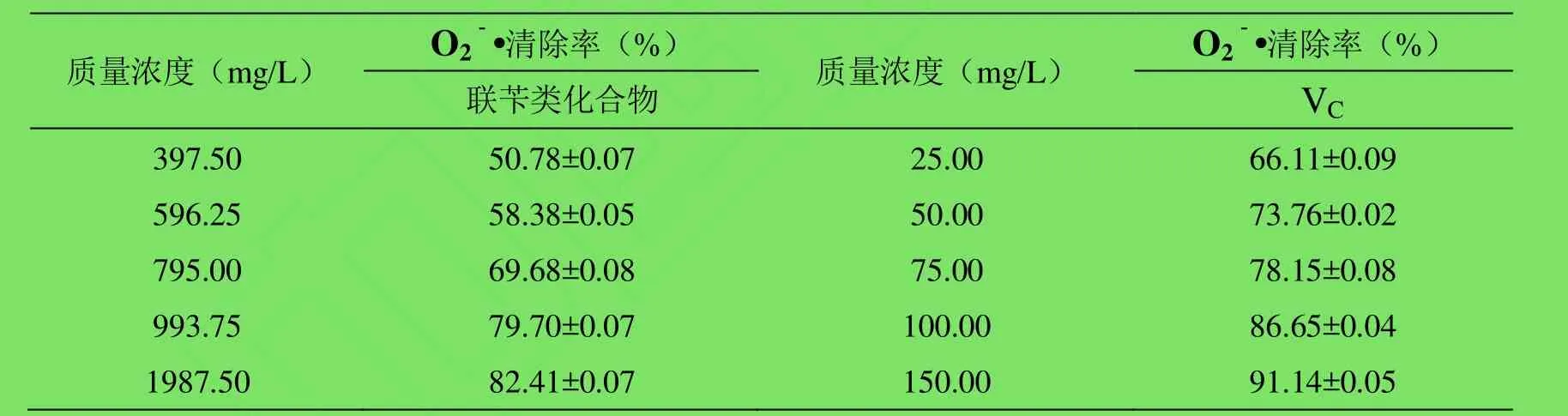
表3 联苄类化合物对O2-·的清除作用(%,±s,n=4)Table 3 Scavenging activity of bibenzyl compounds against· (%,±s,n=4)
质量浓度(mg/L) O2-·清除率(%) 质量浓度(mg/L) O2-·清除率(%)联苄类化合物 VC 397.50 50.78±0.07 25.00 66.11±0.09 596.25 58.38±0.05 50.00 73.76±0.02 795.00 69.68±0.08 75.00 78.15±0.08 993.75 79.70±0.07 100.00 86.65±0.04 1987.50 82.41±0.07 150.00 91.14±0.05
通过SPSS 17.0软件,采用曲线拟合法得到叠鞘石斛中联苄类化合物清除·的曲线回归方程为:y=25.429+61.598x-8.326x3,R²=0.989,F =93.57,p≤0.05,半数清除率(EC50)为 408.10mg/L ;VC清除·的曲线回归方程为:y=62.170+0.111x-0.003x² ,R²=0.99,F=33.00,p≤0.05,半数清除率(EC50)为 14.04mg/L。联苄类化合物的 EC50约为 VC的 29倍。
2.4 对羟自由基(·OH)的抑制作用 联苄类化合物和VC对·OH的抑制结果见表4。在所选浓度范围内,一定浓度的联苄类化合物高于对照VC抑制·OH的能力,VC的抑制率很小,在一定浓度范围内抑制率几乎没有变化。但是总体来看,叠鞘石斛中联苄类化合物抑制·OH释放的能力还是较VC弱。
表4 叠鞘石斛中联苄类化合物对·OH的抑制作用(±s,n=4)%Table4 Inhibiting activity of bibenzyl compounds against ·OH(±s,n=4)%
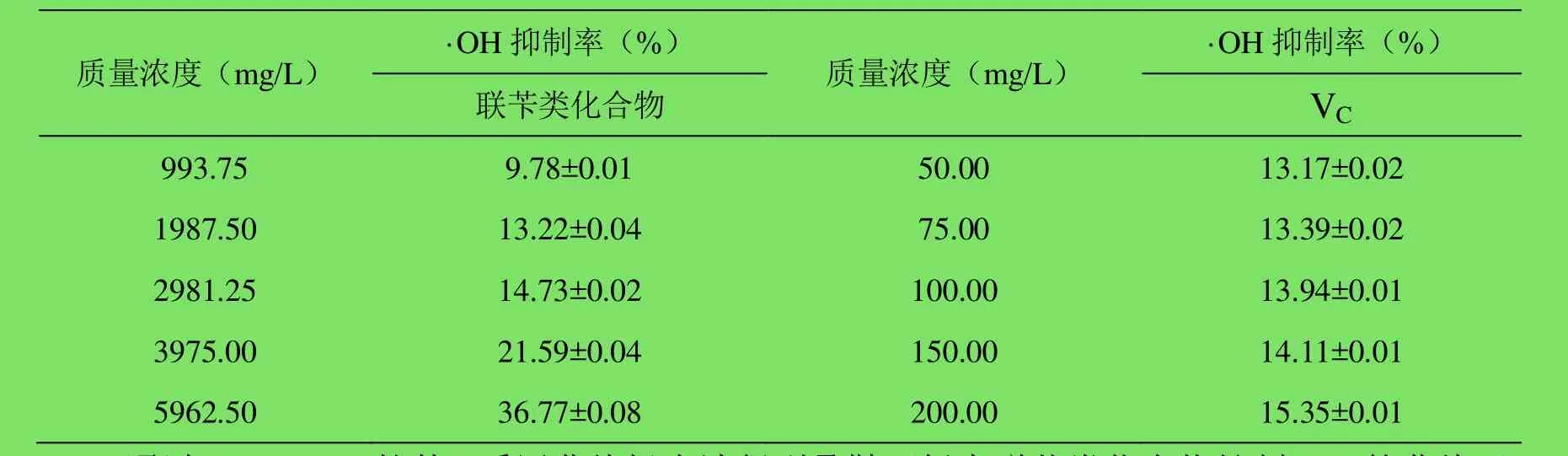
表4 叠鞘石斛中联苄类化合物对·OH的抑制作用(±s,n=4)%Table4 Inhibiting activity of bibenzyl compounds against ·OH(±s,n=4)%
质量浓度(mg/L) ·OH抑制率(%) 质量浓度(mg/L) ·OH抑制率(%)联苄类化合物VC 993.75 9.78±0.01 50.00 13.17±0.02 1987.50 13.22±0.04 75.00 13.39±0.02 2981.25 14.73±0.02 100.00 13.94±0.01 3975.00 21.59±0.04 150.00 14.11±0.01 5962.50 36.77±0.08 200.00 15.35±0.01
通过SPSS 17.0软件,采用曲线拟合法得到叠鞘石斛中联苄类化合物抑制·OH的曲线回归方程为:y=9.731+8.332×10-7x²,R²=0.994,F =173.142,p≤0.05,半数清除率(EC50)为7.86mg/mL ;VC抑制·OH 的曲线回归方程为:y=11.084x+1.488×10-6x3,R²=0.980,F=16.736,p≥0.1,半数清除率(EC50)为 1.89mg/mL。联苄类化合物的 EC50约为 VC的 4倍。
3 结论与讨论
DPPH在溶液中生成一个稳定的含氮自由基,且该溶液呈典型的紫色,在紫外-可见光区517 nm波长处具有较强的吸收。当DPPH溶液中加入抗氧化剂时,由于其自由基清除作用使溶液紫色消退,导致吸光强度随抗氧化剂量的增加而减弱,通过加入抗氧化剂前后,吸光度的变化来计算自由基的清除作用[8]。本试验研究了不同浓度联苄类化合物对DPPH·的清除作用,在 39.75~596.25mg/L浓度范围内,随着联苄类化合物浓度的增加清除作用增加明显,当联苄类化合物浓度增至198.75mg/L以上时,其对DPPH·的清除作用强于VC。
ORAC法的基本原理与 DPPH·清除法类似。通过试验发现,随着供试品含量的增大,荧光衰退曲线下面积在增大,且与浓度呈现良好的线性关系,同时表现出比 VC更强的AAPH·清除能力。
邻苯三酚在碱性条件下发生自氧化反应[9],产生稳定浓度的超氧阴离子自由基(O2-·)与中间物,中间物又与超氧阴离子自由基(O2-·)反应,得到一种带有颜色的中间产物,该产物在紫外有吸收,引起某一波长处吸光值的变化,来反应抗氧化剂的清除能力的大小。本试验结果在 397.5~1987.5mg/L浓度范围内,随着联苄类化合物含量的增大,清除超氧阴离子自由基(O2-·)的能力在增强,与该方法原理相符,但相较于VC叠鞘石斛中联苄类化合物清除作用较弱。
Fenton反应体系的基本原理与ORAC法的相当,即抗氧化剂与邻二氮菲竞争与羟自由基(·OH)结合,由于抗氧化剂的存在而抑制了羟自由基(·OH)对邻二氮菲红色配合物的氧化。本试验结果在993.75~5962.5mg/mL浓度范围内,随着联苄类化合物含量的增大,抑制羟自由基(·OH)的能力在增强。但从半数清除率(EC50)比较抑制作用弱于VC。
可见,联苄类化合物具有较强的AAPH自由基清除能力,还具有清除DPPH自由基和超氧阴离子自由基和抑制羟自由基的能力。且在各试验浓度范围内,联苄类化合物的浓度和自由基清除率呈现良好的剂量依赖关系。联苄类化合物对各自由基的半数清除率(EC50)不同,可能与联苄类化合物中具体的单体物质对不同自由基作用的不同而导致,而该联苄类化合物中个单体化合物的含量可能又存在差异。
综上可知,叠鞘石斛中联苄类化合物具有很好的抗氧化活性,可以作为天然抗氧化剂清除体内正常代谢产生的羟自由基、超氧阴离子等活性氧自由基,避免自由基失衡诱发各种疾病,为叠鞘石斛联苄类化合物的开发利用提供理论依据。
[1]Xue Zhang, Jie-Kun Xu, Wang-Nai Li, et al. Bioactive Bibenzyl Derivatives and Fluorenones from Dendrobium nobile[J]. Journal of Natural Products. 2007.70(1):24-28.
[2]李 琳,赵谋明. 几种中药浸提物的抗氧化活性研究[J]. 食品科技. 2004(11):89-92.
[3]李江陵,肖小河.四川石斛属药用植物资源调查[J].中国中药杂志,1995,20(1):7-9.
[4]罗傲雪,宋关斌,淳泽,et al. 迭鞘石斛抗肿瘤作用研究[J]. 应用与环境生物学报,2007,13(2):184-187.
[5]施 红,黄 玲.石斛抗衰老作用的实验研究[J]. 中华老年医学杂志,1994,13(2):104.
[6]张 雪,续洁琨,王乃利,等. 金钗石斛中联苄类和酚酸类成分的抗氧化活性研究[J]. 中国药学杂志,2008,11(43):829-832.
[7]续洁琨,姚新生,栗原博.抗氧化能力指数(ORAC)测定原理及应用[J].中国药理学通报,2006,22(8):1015-1021.
[8]李铉军,崔胜云. 抗坏血酸清除DPPH自由基的作用机理[J]. 食品科学,2011,1(32):87-90.
[9]郭雪峰,岳永德,汤 峰,等.用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(8):1823-1826.
[10]贾芳,夏厚林,黄萍,等. 紫外可见分光光度法测定叠鞘石斛中联苄类化合物的含量[C]. 2013年全国博士生学术论坛论文集,2013:238-241.
