保留时间两点校正反相高效液相色谱法测定持久性有机污染物的正辛醇-水分配系数
2014-05-08乔俊琴练鸿振
梁 超, 乔俊琴,2, 葛 欣*, 练鸿振,2*
(1.南京大学化学化工学院,江苏南京210093;2.南京大学现代分析中心,江苏南京210093)
正辛醇-水分配系数(Kow)作为持久性有机污染物(POPs)的一个重要物理化学常数,一般用来表征POPs在环境介质中从水相至有机相或者生物膜的迁移、转化、吸附等过程的倾向。在研究POPs的生物富集过程时,Kow还与POPs的生物累积性以及毒性等相关,因此,Kow数据是研究POPs的环境行为和毒性的一个非常重要的评价指标,特别是在定量结构-活性关系(QSAR)的研究中具有重要作用[1-4]。
多环芳烃(PAHs)、多氯二苯并二恶英(PCDDs)和多氯二苯并呋喃(PCDFs)是3类典型的POPs化合物。作为最传统的POPs,PAHs广泛存在于人类生活的自然环境如大气、水体、土壤、作物和食品中,其中的多种化合物已被证明具有致癌毒性,特别是相对分子质量较高的多环芳烃(如苯并[a]芘),一直是国内外广泛关注的热点[5-8]。PCDDs和PCDFs是两类在化学及毒理学性质方面相似的化合物,统称为二恶英,PCDD/Fs在环境样品中含量低,且1-8氯代的异构体共有210个,包括75种PCDDs和135种PCDFs,其中部分异构体具有强烈的毒性,因而也引起了国际社会的广泛关注[9-11]。PCDD/Fs并非人为制造,而是一些工业化产品生产过程中的副产物,主要涉及垃圾焚烧、造纸工业、含氯化学品生产及金属冶炼过程[9]。十溴二苯乙烷(DBDPE)作为已被欧美地区禁用或限用的阻燃剂十溴联苯醚(BDE209)的替代品,在我国已被广泛应用在电子电器、电线、纺织等的纤维和聚酯材料中,由于其性质与BDE209相近,它的潜在危害正逐渐受到环境科学界的高度重视[12-14]。
然而,迄今为止,POPs的Kow实验值鲜有报道,而以计算值居多。由于这些POPs的结构复杂,致使不同的计算方法给出的结果往往大相径庭;而在为数不多的实验测得的Kow数据中,即使对于同一个化合物,不同实验室报道的数据之间偏差也较大。产生这种偏差的主要原因可能是它们的高疏水性使得摇瓶法(SFM)[15]或慢搅法(SSM)[16]不再适合测定其Kow。由于操作的简便性和结果的可靠性,反相高效液相色谱法(RP-HPLC)已成为测定高疏水性POPs类化合物Kow值的主要推荐方法[17],该方法是基于溶质的logKow与其在纯水相洗脱条件下的保留因子对数值logkw的线性关系[18],但对于疏水性较强(logKow>6)的POPs,由于其在色谱体系中保留过强,实验周期较长,导致硅胶固定相老化而产生保留时间tR漂移,这使得kw外推误差变大,从而影响了这类POPs的Kow测量的准确性;其次,对于疏水性较强的POPs,其在低有机调节剂比例的流动相下的tR太长而难以测量,而通过完全在高有机调节剂比例下的保留因子外推得到的kw又不够准确。鉴于准确可靠的Kow数据在典型POPs的环境行为和生物毒理研究中的重要地位,我们利用改进的RP-HPLC方法测定了13种 PAHs、10种 PCDDs、4种PCDFs以及DBDPE和五溴苯等共计29种化合物的Kow值,希望能够为典型POPs的相关研究提供准确可靠的物理化学参数。
1 理论部分
1.1 R P-HPLC法测定logKow值的基本思路
对于不解离化合物,它的logKow与其在RPHPLC体系中100%水相条件下的保留因子logkw线性相关[18]如下:
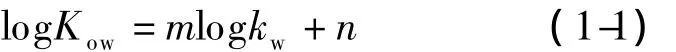
其中,m和n为拟合系数。此方程称为Collander方程,是RP-HPLC法测定化合物疏水常数Kow的基础。
由于100%水相对色谱柱要求较高,且其对疏水性物质的洗脱能力较弱,使得这些化合物在色谱柱上的保留时间tR太长,所以在实际研究中,logkw一般很少从实验获得,而是通过外推得到,依据如下。
液相色谱二元流动相组成与保留值之间关系的通式为[19]:
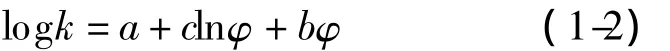
其中,k为色谱保留因子,φ为流动相中有机调节剂的比例,a、b、c为常数。
在RP-HPLC中,clnφ可以忽略,从而得到Snyder-Soczewinski方程[20]:

方程(1-3)中,参数a反映了RP-HPLC中溶质与固定相的疏水作用,当φ=0时,有a=logk,logk代表了溶质在固定相上的疏水性;参数b反映了溶质在流动相中的作用能,还被称为作用指数,用于表征流动相中的洗脱剂强度,对于特定的溶质-洗脱剂而言是一个常数。
1.2 保留时间双点校正法的引入
针对经典RP-HPLC在测定高疏水性化合物Kow时面临的保留时间准确性这一瓶颈问题,本研究小组在前人工作的基础上提出了一种新的保留时间校正方法,即保留时间双点校正法(DP-RTC),通过将实验中某一天(通常为新色谱柱使用的第一天)所使用的色谱柱作为“标准柱”,将以后每天实验得到的tR均校正为相应的在“标准柱”上得到的保留时间,校正过的保留时间反映了化合物在色谱体系中真实的保留行为。采用这种校正方法及RPHPLC,我们准确测定了5种迄今尚无SFM/SSM 数据的滴滴涕(双对氯苯基三氯乙烷,dichlorodiphenyltrichloroethane,DDT)类化合物的 logKow值[21]。本文中,我们进一步利用RP-HPLC结合DP-RTC的方法测定了前述29种化合物的logKow值。
2 实验部分
2.1 药品与试剂
甲醇(HPLC级)购自Honeywell公司(Honeywell Burdick&Jackson,Muskegon,MI,USA);水为娃哈哈纯净水(杭州娃哈哈集团)。本实验所用的样品、能得到的样品的SFM/SSM Kow数据及相应的正辛醇-水分配系数软件计算值(ClogP)见表1,这些样品分别购自阿拉丁试剂(上海)、国药集团化学试剂有限公司(上海)、AccuStandard(New Haven,USA)、Alfa Aesar(Ward Hill,USA)、Dr.Ehrenstorfer(Augsburg,Germany)以及 TCI(Tokyo,Japan),所有物质的纯度均大于98%(质量分数)。实验中,将这些物质分为3组:模型化合物组(Training set)、验证化合物组(Validation set)以及待测化合物组(Determination set)。用甲醇配制各样品的储备液,储存于4℃冰箱中待用。
2.2 仪器与设备
Waters Alliance 2695高效液相色谱仪,配有真空脱气机、数码四元泵、120位自动进样器及996紫外-可见二极管阵列(PDA)检测器(Waters,Milford,MA,USA)。
2.3 色谱条件
Venusil XBP(L)C8色谱柱(150 mm×2.1 mm,5 μm,15 nm)(天津博纳艾杰尔科技有限公司),柱温恒定在30℃。流动相为甲醇-水,流速为0.2 mL/min。实验中各样品的进样浓度均为50 mg/L,进样量为2 μL。在每个化合物的最佳吸收波长处检测。数据的采集和处理均在Waters Empower色谱管理系统中进行。所有样品的tR均为至少3次独立进样的平均值。
2.4 实验方法
所有样品均使用甲醇-水二元流动相体系进行等度洗脱,根据样品疏水性的差异,每个样品至少选择4个不同的甲醇比例(0.9~0.5,每间隔0.05取一个比例),分别得到相应的tR。以联苯和六甲基苯作为“锚点化合物”,所有tR通过DP-RTC法校正至相当于在“标准柱”上得到的保留时间。保留因子k计算公式为:k=(tR-t0)/t0,其中t0是死时间,本实验的t0由溶解在甲醇中的NaNO3在“标准柱”上测得。DP-RTC法的描述详见文献[21]。通过Snyder-Soczewinski方程(1-3)得到每一个溶质外推至100%水相中的保留因子的对数值logkw(见表1)。根据Collander方程(1-1),这些中性化合物的logkw与它们通过SFM/SSM得到的准确可靠的logKow值之间有着良好的线性关系。因此,在本实验中,由37种模型化合物得到的logKow-logkw的定量结构-色谱保留关系(QSRR)模型就可用来确定待测化合物的疏水常数Kow。此线性模型的可靠性通过正交检验(cross-validation)中的留一法(leaveone-out,LOO)进行验证。为了评价QSRR模型的实际预测能力,我们又对该模型进行了外部验证(external validation)。外部验证选取4种验证化合物(联苯、芴、PCDD 1和PCDF 114),分别比较了它们由本实验方法测得的和文献报道中SFM/SSM测定的logKow数据之间的一致性。
对拟合模型的统计分析由SPSS V16.0.0(SPSS,Chicago,Illinois,USA)和 MATLAB software V7.10.0(R2010.a)(the MathWorks,Natick,MA,USA)完成。

表1 实验中选用的化合物的logKow、ClogP和logkw值Table 1 logKow,ClogP and logkwof investigated compounds
3 结果与讨论
3.1 logKow-logkw模型的建立及验证
本实验由含有37种化合物的模型化合物组拟合,得到logKow与logkw之间的QSRR线性模型,其方程如下:

其中,相关系数(R2)=0.985,交叉验证相关系数)=0.983,标准偏差(SD)=0.16,F=2 290.56(见图1)。由LOO正交检验和图1可知,logKow-logkw模型的统计结果相关度非常高,此线性拟合的内部验证结果令人满意。再以4个结构类似的化合物作为模型的外部验证化合物,其外部验证结果也令人满意。

图1 37种模型化合物的logKow-logkw线性模型Fig.1 Linear correlation between logKowand logkwof 37 model compounds
通过对比本文DP-RTC-RP-HPLC法测得的logKow值与SFM/SSM 法测定的logKow值,发现二者之间的偏差很小(≤0.1 log unit)(见表2),此结果表明,在对本实验的目标 POPs(PAHs、PCDD/Fs、DBDPE)的 logKow值测定中,DP-RTC-RP-HPLC法与经典的SFM/SSM法的准确性相当。
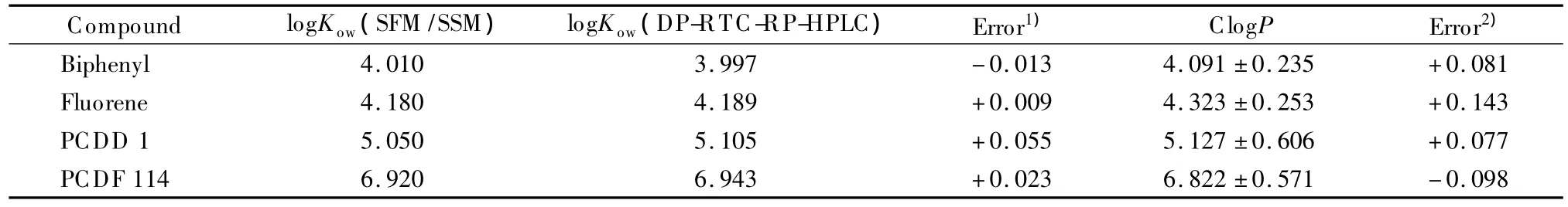
表2 对logKow-logkw线性模型的外部验证Table 2 External validation for logKow-logkwlinear model
3.2 PAHs、PCDD/Fs、DBDPE 等 化 合 物 的logKow的测定
如前所述,本实验已经得到了logKow-logkw的QSRR模型,并且验证了此模型适合于预测PAHs、PCDD/Fs及DBDPE等POPs的logKow值。因此利用此线性模型测定了表1中列出的待测POPs化合物的logKow值,并将测定结果与ClogP值进行比较(见表3)。由表1和表3可见:对于高疏水性化合物(logKow>5),ClogP值普遍小于相应的 SFM/SSM或RP-HPLC法测量的实验值;而对疏水性稍低的化合物(logKow<5),其ClogP值却又略大于其相应实验值。同时,从表3中,我们可以看到,对不含氯或溴原子的PAHs类化合物来说,其ClogP值与我们RP-HPLC法测得的实验值比较接近,但是对于coronene和truxene来说,因二者结构相对复杂,其软件计算值显示出较大的偏差;而对于含氯或溴的POPs,如PCDD/Fs类的化合物,其软件计算值本身就有较大的误差(>±0.6),且含氯或溴原子越多,其与实验值的偏差越大。软件计算法和RPHPLC法得到的logKow数据的不一致,反映了多种复杂因素对软件计算法具有共同影响,因此,使用商业软件法计算得到高疏水性化合物的logKow值时需十分谨慎。
3.3 POPs同系化合物Kow值测定的新策略
在环境化学研究中,许多POPs的同系物种类非常繁多,这使得采用SFM/SMM实验方法测定它们的Kow值时间冗长,费时费力。而在经典的RPHPLC法中,对于每一个待测同系物,为了获得准确的外推logkw值,需要在等度洗脱条件下测定至少4个不同的有机调节剂比例φ下的logk,以保证Snyder-Soczewinski线性方程拟合的可靠性。但由于大多数POPs的疏水性很强,使得在水相比例较高的流动相条件下,这些物质很难被洗脱,在这种情况下想要得到它们的tR值是相当困难甚至是不可能的,而通过完全在高有机调节剂比例下的保留因子外推得到的kw因不能覆盖全流动相比例范围,准确性较差,这个矛盾在经典RP-HPLC法中难以调和。本研究小组曾提出了一种新的基于实验的计算logkw的方法,此方法通过建立同系物logkw与logk之间简单的线性关系,只需要测定化合物在某一个φ下的一个k值即可得到该物质的logkw,从而大大简化了RP-HPLC法测定同系化合物Kow的过程[40]。基于logkw与logk之间的这种线性关系,我们用RPHPLC法测定了无SFM/SSM数据报道的7种多氯联苯(PCB)、6种多溴联苯(PBB)和8种多溴联苯醚(PBDE)的logKow值。以PCB为例,分别采用C8和C18的色谱固定相,测得的logKow数据具有很好的一致性。由于本篇工作中化合物种类较多,涉及PAHs、PCDDs、PCDFs和 DBDPE 4 类结构不同的POPs,故没有引入该方法。
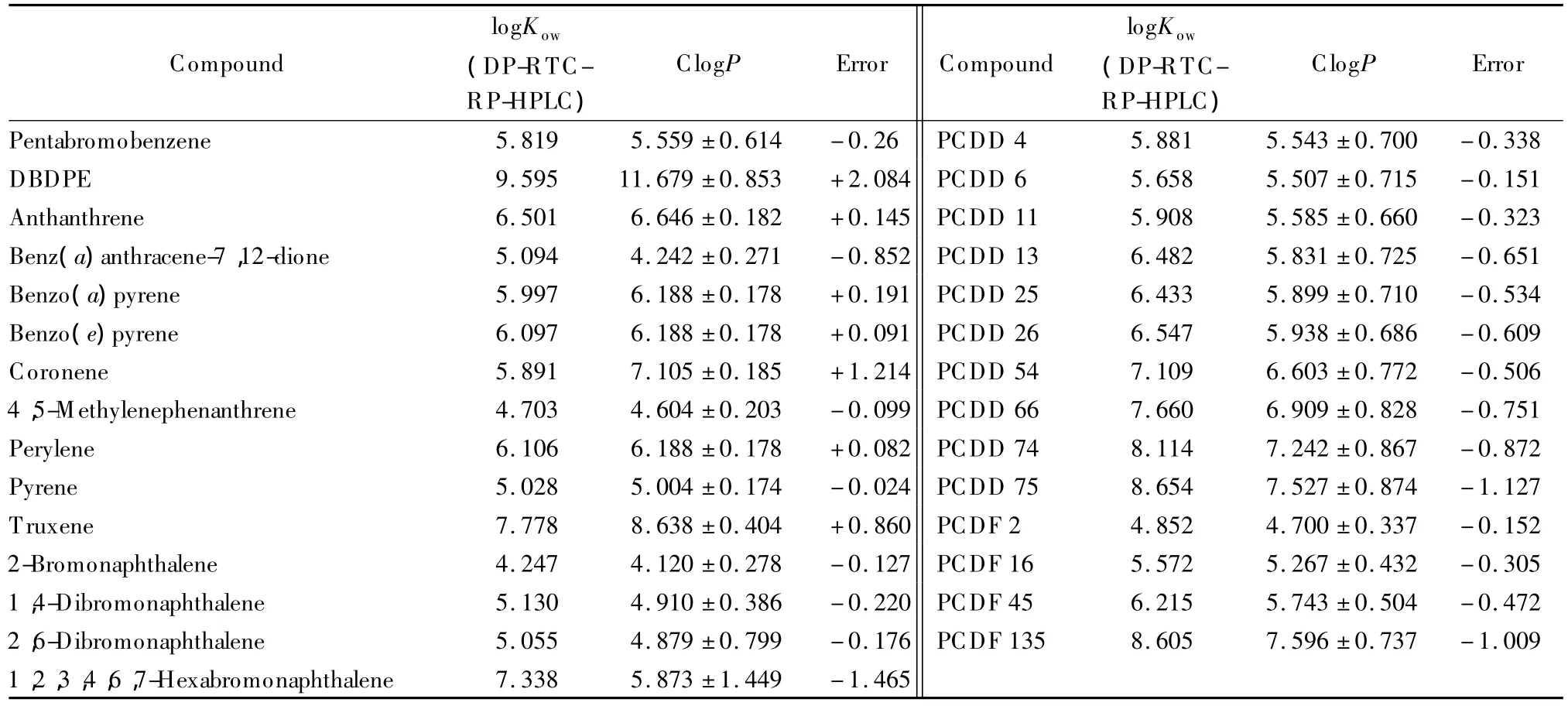
表3 29种化合物的logKow的测定Table 3 Determination of logKowfor the 29 compounds
3.4 极性污染物Kow值的测定思路
本工作所建立的方法和模型针对疏水性较大的中性化合物,对于中性的污染物适用。但污染物分子种类很多,除中性分子外还有很多会发生解离的极性化合物,如抗生素分子,在用RP-HPLC法研究易解离化合物的Kow值时,需要采用修正的模型,即用表观正辛醇-水分配系数(Kow″)来替代Kow。本研究小组在这方面也曾做过系统的研究,专门针对酸性[41-45]、碱性[46,47]以及两性化合物[48]等极性分子的Kow测定及保留行为进行研究。在近期的工作中,我们还利用中性化合物为模型化合物测定了弱解离酸性药物马兜铃酸的Kow值[44],对极性污染物的Kow值的测定具有借鉴价值。
4 结论
本文采取对保留时间准确定量的DP-RTCRP-HPLC方法,选择了37种模型化合物,拟合得到了可靠的logKow-logkwQSRR模型,并利用此模型测定了29种POPs类化合物的logKow值,这些POPs的logKow实验数据尚未见报道。虽然RP-HPLC是目前经济合作与发展组织(OECD)推荐的测定化合物疏水常数的一种可靠性较高、普遍使用的方法,但是其在测定POPs疏水常数时,依然存在着在整个测定过程中主要由固定相老化引起的化合物tR偏移的问题,即使在完全相同的色谱洗脱条件下,这种偏移也无法避免。对于依赖准确tR值构建模型的RP-HPLC法来说,这种偏移毫无疑问会导致化合物Kow值测定不准,我们推荐在实验中采用DPRTC法来校正tR,且在测定较高疏水性化合物时,选用疏水性较低的C8短柱在水相比例较高的流动相条件下进行实验,以此增加Snyder-Soczewinski方程外推得到logkw的准确性,从而得到更加准确可靠的logKow数据。
[1] Palczewska A,Neagu D,Ridley M.J Cheminf,2013,5:16
[2] Pham-The H,Gonzalez-Alvarez I,Bermejo M,et al.Mol Inf,2013,32:459
[3] Yadav M,Joshi S,Nayarisseri A,et al.Interdiscip Sci Comput Life Sci,2013,5:150
[4] Sidir Y G,Sidir I.J Mol Struc,2013,1045:131
[5] Lammel G,Heil A,Stemmler I,et al.Environ Sci Technol,2013,47(20):11616
[6] Pincemaille J,Schummer C,Heinen E,et al.Food Chem,2014,145:807
[7] Wu M H,Li G,Xu G,et al.Environmental Chemistry(吴明红,李刚,徐刚,等.环境化学),2012,31(11):1750
[8] Zhu B Q,Chen H,Li S Q.Chinese Journal of Chromatography(祝本琼,陈浩,李胜清.色谱),2012,30(2):201
[9] Esposito M,Serpe F P,Diletti G,et al.Chemosphere,2014,94:62
[10] Lambert M K,Friedman C,Luey P,et al.Environ Sci Technol,2011,45(10):4331
[11] Hu X B,Xu Z C,Peng X C,et al.Environ Geochem Health,2013,35:593
[12] Sun Y X,Xu X R,Hao Q,et al.Chemosphere,2014,95:442
[13] Salamova A,Hites R A.Environ Sci Technol,2013,47(1):349
[14] Yang Y,Chen J H,Chang L P,et al.Chinese Journal of Chromatography(杨扬,陈建海,常利平,等.色谱),2008,26(5):646
[15] Organization forEconomic Cooperation and Development(OECD).Guideline for Testing of Chemicals,No.107:Partition Coefficient(n-octanol/water)-Shake Flask Method,1981
[16] Brooke D N,Dobbs A J,Williams N.Ecotoxicol Environ Safe,1986,11(3):251
[17] OECD.Guideline for Testing of Chemicals,No.117:Partition Coefficient(n-octanol/water)-High Performance Liquid Chromatography Method,1989
[18] Braumann T.J Chromatogr,1986,373(2):191
[19] Lu P Z,Lu X M,Li X Z,et al.Chinese Science Bulletin(卢佩章,卢小明,李秀珍,等.科学通报),1982,27(19):1175
[20] Snyder L R,Dolan J W,Gant J R.J Chromatogr,1979,165(1):3
[21] Han S Y,Qiao J Q,Zhang Y Y,et al.Chemosphere,2011,83(2):131
[22] Hansch C,Leo A J.Substituent Constants for Correlation Analysis in Chemistry and Biology.New York:Wiley,1979
[23] Sangster J.J Phys Chem Ref Data,1989,18(3):1111
[24] De Bruijn J,Busser F,Seinen W,et al.Environ Toxicol Chem,1989,8(6):499
[25] Watarai H,Tanaka M,Suzuki N.Anal Chem,1982,54(4):702
[26] Doucette W J,Andren A W.Chemosphere,1988,17(2):345
[27] Banerjee S,Yalkowsky S H,Valvani S C.Environ Sci Tech,1980,14(10):1227
[28] Hansch C,Fujita T.J Am Chem Soc,1964,86(8):1616
[29] Demaaged P,Hulscher D,Heuvel H,et al.Environ Toxicol Chem,1998,17(2):251
[30] Helweg C,Nielsen T,Hansen P.Chemosphere,1997,34(8):1673
[31] Kenaga E E,Goring C A I//Eaton J G,et al.Aquatic Toxicology:Proceedings of the Third Annual Symposium on Aquatic Toxicology:ASTM STP 707,1980:78
[32] He Y B,Zhao Y H,Wang L S,et al.Environmental Chemistry(何艺兵,赵元慧,王连生,等.环境化学),1994,13(3):195
[33] Valsaraj K,Thibodeaux L.Sep Sci Tech,1990,25(4):369
[34] Rapaport R A,Eisenreich S J.Environ Sci Technol,1984,18(3):163
[35] Bruggeman W,Van Der Steen J,Hutzinger O.J Chromatogr,1982,238(2):335
[36] Risby T,Hsu T-B,Sehnert S,et al.Environ Sci Technol,1990,24(11):1680
[37] Gobas F,Lahittete J,Garofalo G,et al.J Pharm Sci,1988,77(3):265
[38] Sijm D T H M,Wever H,De Vries P J,et al.Chemosphere,1989,19:263
[39] Sarna L P,Hodge P E,Webster G R B.Chemosphere,1984,13(9):975
[40] Han S Y,Liang C,Qiao J Q,et al.Anal Chim Acta,2012,713:130
[41] Lian H Z,Wang W H,Li D N.J Sep Sci,2005,28:1179
[42] Ming X,Han S Y,Qi Z C,et al.Talanta,2009,79(3):752
[43] Han S Y,Ming X,Qi Z C,et al.Anal Bioanal Chem,2010,398(6):2731
[44] Han S Y,Qiao J Q,Zhang Y Y,et al.Talanta,2012,97:355
[45] Han S Y,Liang C,Zou K,et al.Talanta,2012,101:64
[46] Qi Z C,Mei S B,Lian H Z.Science in China:Series B(戚争春,梅少博,练鸿振.中国科学:B辑),2009,39(8):806
[47] Qi Z C,Han S Y,Wu Z Y,et al.Cur Anal Chem,2014,10:172
[48] Chen F Y,Cao X W,Han S Y,et al.J Liq Chromatogr Relat Technol,DOI:10.1080/10826076.2013.864977
