华南汉族成人烟雾病的危险因素分析
2014-05-08马国奋蒋晓江陈海坤
马国奋,蒋晓江,陈海坤
(1河源市人民医院,广东河源517000;2第三军医大学第三附属医院)
烟雾病(自发性基底动脉环闭塞症)是一种以双侧颈内动脉末端及其大分支血管进行性狭窄或闭塞,且颅底伴异常新生血管网形成为特征的血管性疾病[1],因脑血管造影时呈现许多密集成堆的小血管影,似吸烟时吐出的烟雾,故名烟雾病[2]。国内学者对烟雾病的病因学、流行病学、临床特征、诊断、治疗等方面的研究已有较多报道。然而,目前关于华南地区烟雾病的临床特点和危险因素报道较少[3]。2003年1月~2012年6月,我科收治烟雾病患者128例,现分析其危险因素。
1 资料与方法
1.1 临床资料 选取2003年1月~2012年6月我科收治的烟雾病患者128例,其中男87例、女41例,年龄19~68(44.5±23.8)岁。临床表现为脑梗死93例,脑出血15例,蛛网膜下腔出血6例,短暂性脑缺血发作(TIA)9例,无症状6例。既往史包括鼻咽癌放疗后5例,脑外伤3例,结核病7例,脑膜炎4例,高脂血症25例,糖尿病28例,高血压病32例。均均符合日本厚生省1998年修订的成人烟雾病诊断标准:①双侧或单侧颈内动脉末端或大脑前、大脑中动脉的起始端狭窄或闭塞;②脑血管造影动脉期可见颅底异常烟雾状血管网;③无临床症状,或与闭塞的血管供血区域相比,症状体征相对较轻;④年龄>18岁,有多种病因,或者病因不明[4]。排除标准:除外颅脑外伤、脑膜炎、脑肿瘤、唐氏综合征、神经纤维瘤病等[5]。
1.2 危险因素筛选 根据国内外文献报道,筛选可能与烟雾病发病相关的因素[6],包括高血压病、糖尿病、高脂血症、肥胖、嗜烟酒、缺乏运动和长期精神紧张共7个危险因素,统计每项危险因素的患者例数,计算每项危险因素的发生率。
1.3 统计学方法 采用SPSS13.0统计学软件,危险因素分析采用Logistic二元回归分析,将烟雾病发病赋值为1,无发病为0;各危险因素如存在则赋值为1,无则为0。采用逐步回归法处理数据。P<0.05为差异有统计学意义。
2 结果
回归共分5步进行,每个步骤的检验方程均有统计学意义(P均<0.05),说明调查表的条目设置较合理、所收集的患者信息较客观。逐步回归发现危险因素包括高血压病、糖尿病、血脂异常、肥胖、嗜烟酒、缺乏运动和长期精神紧张(P均<0.05)。见表1。
3 讨论
烟雾病的病理改变主要为病变血管的血管内膜明显增厚,内弹力层弯曲,间质萎缩变薄,血管壁上出现附壁血栓及脂质沉积等现象。烟雾病有两个发病高峰期,一个是10岁以内的幼儿期,主要表现为缺血性脑卒中,另一个是30~40岁,主要表现为脑出血[1]。但美国学者通过对116例烟雾病患者研究发现,美国成年人烟雾病以缺血性卒中多见,随访发现每年卒中再发生率为10.3%,预后好于亚洲患者。而亚洲烟雾病患者中,超过66%的患者以脑出血为主要表现,表现为脑内血肿、侧脑室出血和蛛网膜下腔出血,以侧脑室出血多见;儿童患者中仅约10%表现为脑出血,绝大多数表现为脑缺血,其中40%左右表现为TIA,30%表现为脑梗死,少数表现为头痛、癫痫等,因此,亚洲与西方人群烟雾病的表现存在差异[7]。
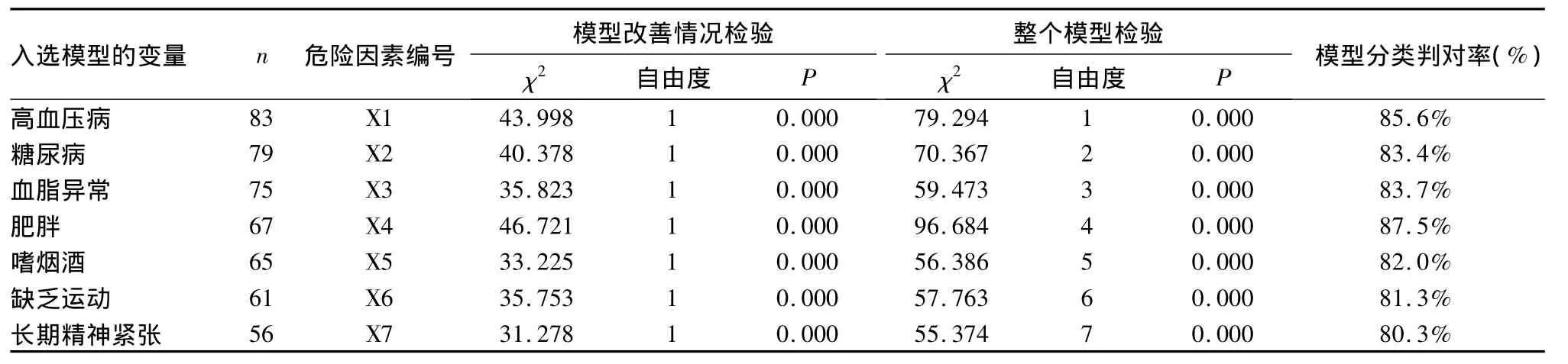
表1 128例烟雾病患者危险因素分析结果
烟雾病的发病原因尚不清楚,遗传和环境因素可能与该病发病有关。日本有8%~10%的病例呈家族性发病,且家族性患者中女性更多见、发病年龄更小。最近研究显示,烟雾病患者染色体8q23和12p12位点均存在遗传连锁现象[8]。部分细胞因子的变化在烟雾病的病变过程中也起重要作用。研究发现烟雾病患者的脑脊液中碱性成纤维细胞生长因子水平升高,提示该因子在烟雾病病理改变过程中可能发挥作用。肝细胞生长因子(HGF)是一种促血管生成的强烈诱导剂,研究发现烟雾病患者脑脊液及脑组织中HGF mRNA及蛋白表达增高,提示烟雾病发病与HGF有关。烟雾病患者血清中其他细胞因子如转化生长因子、血小板衍化生长因子及细胞维甲酸结合蛋白-Ⅰ等均表达增高。因此,炎症后的自身免疫性反应可能导致脑血管的闭塞性病变,也可能是烟雾病的病因之一[9]。
本研究发现,入选的128例华南地区烟雾病患者以脑梗死最为多见,脑出血次之,TIA占第三位,这与 Felbaum 等[1]及 Oh等[2]所报道的日本及韩国烟雾病的特点大体一致。在一定程度上为该病的预防提供了依据。
[1]Felbaum D,Henning E,Payne BR.Moyamoya in a non-Asian patient:a case report and review of the literature[J].W V Med J,2012,108(2):18-19.
[2]Oh CH,Chung J,Hyun D,et al.Cerebrovascular disease and stroke in Korean male adolescent[J].Yonsei Med J,2012,53(3):467-476.
[3]Li H,Zhang ZS,Liu W,et al.Association of a functional polymorphism in the MMP-3 gene with Moyamoya Disease in the Chinese Han population[J].Cerebrovasc Dis,2010,30(6):618-625.
[4]Liu W,Hashikata H,Inoue K,et al.A rare Asian founder polymorphism of Raptor may explain the high prevalence of Moyamoya disease among east Asians and its low prevalence among Caucasians[J].Environ Health Prev Med,2010,15(2):94-104.
[5]Kraemer M,Heienbrok W,Berlit P.Moyamoya disease in Europeans[J].Stroke,2008,39(12):3193-3200.
[6]Uchino K,Johnston SC,Becker KJ,et al.Moyamoya disease in Washington State and California[J].Neurology,2005,65(6):956-958.
[7]Liu W,Hitomi T,Kobayashi H,et al.Distribution of moyamoya disease susceptibility polymorphism p.R4810K in RNF213 in east and southeast Asian populations[J].Neurol Med Chir(Tokyo),2012,52(5):299-303.
[8]Shi KL,Wang JJ,Li JW,et al.Arterial ischemic stroke:experience in Chinese children[J].Pediatr Neurol,2008,38(3):186-190.
[9]Ueno M,Kira R,Matsushima T,et al.Moyamoya disease and transforming growth factor-beta1[J].J Neurosurg,2000,92(5):907-908.
