印楝细胞培养物控制黄粉虫幼虫的研究
2014-05-08李兴林韩广建曹雪飞
李兴林,赵 娜,韩广建,曹雪飞
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
印楝有着悠久的药用价值和农业化学应用价值[1].印楝代谢物具有杀虫、拒食、趋避、毒杀和引起昆虫不孕不育等显著特性,且有高效、无毒、易降解、环保等优势,使其成为国际上最重要的农药资源植物之一[1–2].比较印楝组织和器官中的活性成分发现,印楝素 A的杀虫效果最为显著[3–4].印楝素是一类柠檬苦素类三萜化合物,对上百种害虫有杀虫活性、拒食性、生长规律可调节性等突出特点[5].印楝细胞、组织和器官等提取物中除印楝素外,还存在其他抗虫活性的柠檬苦素类似物[6–7],且新的活性物质的种类在不断增加.甚至有些不含印楝素的印楝提取物也具有较好的杀虫效果,这将为印楝提取液混合物直接应用于控虫制剂生产提供了依据.
印楝素的含量在印楝的种子中最高[8–9],因此,生产上常以种子为提取原料.印楝素的提取方法主要有微波法、超声波法、快速萃取法和常规浸提法等,这些方法各有优缺点[10–11].
然而,以种子为原料提取印楝素存在着诸多问题:印楝品种、种植区地理环境等差异,导致收获种子的印楝素含量也存在着很大的差异,影响了印楝制剂的质量及其稳定性[2];印楝种子油脂的处理工艺差异也将对印楝素的提取产生较大影响[12–13];更为重要的是,在印楝种子贮藏过程中,随着时间的延长其有效成分将快速下降,而使用印楝杀虫剂又存在着明显的季节性,因而利用种子生产和贮藏印楝制剂有较大的局限性.复杂的印楝素分子结构导致它的化学合成途径一直未能取得突破,使得印楝素成为一种高成本、紧缺的生化试剂[14–15].因而,通过植物组织培养方法从印楝培养物中制备印楝素日益受到关注,但是,其培养物的控虫效果究竟如何却鲜有报道[16]. 本文通过印楝的愈伤组织、悬浮培养物和悬浮培养物细胞3种浸提液对黄粉虫幼虫的处理,以印楝素农药为对照,评估它们在不同时间的杀虫、拒食、趋避等方面的效果,为开发印楝培养物抗虫制剂提供依据.
1 材料与方法
1.1 印楝幼苗的制备
取无病虫害的印楝种子若干,在敲除坚硬的果壳后,将果仁浸没在洗衣粉溶液(每千克水加 1~2,g洗衣粉)中 1,h;在自来水反复清洗后,将其平铺于透气篮中,上面覆盖湿润纱布,定期换湿布;在室温下萌发30,d;取正常生长的幼苗移栽到培土盆中室外光照培养.
1.2 印楝愈伤组织的诱导及继代培养
种子萌发30,d后,剪取少量幼叶,用洗衣粉溶液洗涤,自来水冲洗 4~5,h,2% NaClO 消毒 5,min,无菌水冲洗 3次;再用体积分数 75%乙醇浸泡 30,s,无菌水冲洗 3次,无菌滤纸擦干叶片[17];再将叶片切成约 0.5,cm2的碎片,分别接种到已灭菌的含有 3%蔗糖、0.65%琼脂、3.0,mg/L NAA(α–萘乙酸)、1.0,mg/L 6-BA(6–苄氨基腺嘌呤)、pH 5.8的 MS培养基上,(25±2)℃暗培养 24,h[17–18].每隔 4周对愈伤组织在相同培养基和培养条件上继代培养1次,直至形成松散型愈伤组织为止.
1.3 悬浮细胞的制备及其继代培养
将易分散的愈伤组织以 2%的接种量接种到含有3.0,mg/L NAA、1.5,mg/L 6-BA 的 50,mL MS 液体培养基中(250,mL三角瓶);在125,r/min回转摇床上振荡培养,温度、光/暗周期分别为 25,℃和 16,h/8,h[19];培养 10,d后,将悬浮细胞转移到同种的新鲜培养基中进行继代培养,直至形成分散良好、呈现浑浊的悬浮细胞系为止.
1.4 印楝素A含量的测定
1.4.1 印楝素A样品溶液的制备
精确称取干燥至恒质量的样品5.0,mg,用二氯甲烷溶解,定容至 50,mL,配制成 0.1,mg/mL的样品溶液.
1.4.2 印楝素A最大吸收峰的确定
精确吸取样品溶液1.4,mL,加入0.02,g/mL香草醛甲醇溶液 0.4,mL,振荡混合均匀;室温放置 2,min后,分3次加入0.6,mL浓硫酸,每次加入后迅速振荡10,s,再加入 1.4,mL的甲醇溶液.以二氯甲烷作为空白对照,静置 10,min后于 400~600,nm 波长范围内扫描,结果在579,nm处呈现最大吸收峰.
1.4.3 印楝素A含量的标准曲线
分别取 0.0、0.3、0.5、0.7、0.9、1.1、1.4,mL 标准品(Sigma公司)溶液置于7支10,mL试管中,用二氯甲烷分别定容到1.4,mL;加入0.02,g/mL香草醛甲醇溶液 0.4,mL,振荡混合均匀;室温放置 2,min后,分 3次加入0.6,mL浓硫酸,每次加入后迅速振荡10,s,再加入1.4,mL的甲醇溶液;静置10,min后在紫外可见分光光度计测定其在 579,nm处的吸光度.以吸光度对印楝素 A质量浓度作回归处理,得到回归方程(y=0.006,9,x-0.118,7,R2=0.993,7);依据回归方程可计算待测溶液中的印楝素A含量.
1.4.4 印楝愈伤组织中印楝素A含量的测定
将印楝愈伤组织在 50,℃下烘干至恒质量;称取样品0.15,g(干质量),用10,mL CH3OH浸泡过夜,超声提取 2次,每次 30,min,按体积比为 60∶40的比例把水加到甲醇里,再用 10,mL 二氯甲烷萃取该甲醇溶液清洗 2次(浓度同上);合并二氯甲烷溶液,40,℃真空旋干,再用 5,mL二氯甲烷重溶获得样液待用.
取 1.4,mL样液于试管中,加入 0.02,g/mL香草醛甲醇溶液0.4,mL,振荡混匀,室温静置2,min;然后分 3次加入 0.6,mL浓硫酸,每次加入后迅速振荡10,s;再加入 1.4,mL的甲醇溶液,以二氯甲烷作为空白对照,测定吸光度.由回归方程计算样品溶液中印楝素A含量.
1.4.5 印楝悬浮细胞内印楝素A含量的测定
将悬浮细胞液以3,000,r/min的转速离心10,min,取上清液,备用;用重蒸水洗涤细胞 2次,50,℃烘干细胞至恒质量.测定上清液以及悬浮细胞内的印楝素A含量的步骤均与1.4.4节相同.
1.4.6 印楝悬浮培养物印楝素A含量的测定
摇瓶悬浮液直接用超声波破碎(20,kHz,20~30,min),然后准确移取 1.4,mL样液于试管中,按1.4.4节的步骤测定其印楝素A含量.
1.5 印楝素乳油(0.3%)农药对黄粉虫幼虫的有效作用浓度
0.3%印楝素乳油农药(海南利蒙特生物农药有限公司)100,mL.按该农药的使用说明书要求,在稀释700倍后可应用于菜青虫等害虫的防治,但还没有黄粉虫的相关杀虫浓度记载.为了了解该农药制剂对黄粉虫幼虫的有效作用浓度,将其用蒸馏水分别稀释成 1、100、300、500和700倍溶液;然后分别取2,mL混合于2,g麦麸中,再放入30条3龄(每正常蜕皮1次为1龄)黄粉虫幼虫;在第0、3、6和9天时测定虫质量和麦麸质量等,以确定其对黄粉虫幼虫的有效作用的浓度和开始发挥显著作用的时间[20].
1.6 对照与实验组工作液的设置
阴性对照:二氯甲烷溶液;阳性对照:在1.5节实验结果的基础上,以有效作用浓度的制剂确定为阳性对照;以阳性对照印楝素A的浓度为参照,将不同培养物浸提液稀释成相同印楝素 A浓度的工作液,以利于实验结果的比较,浸提液 1为愈伤组织浸提液,浸提液2为悬浮培养物浸提液,浸提液3为悬浮培养物细胞浸提液.
1.7 毒理实验
均含0.003%印楝素A的阳性对照和3组实验工作液以及不含印楝素 A的阴性对照分别按体积质量比为 1∶1浸泡麦麸,然后置于通风性好的低温黑暗处放置过夜后备用.
1.7.1 触杀性处理
瞬间浸泡法:将黄粉虫幼虫在工作液中瞬间浸泡2,s,然后放入没有进行药剂处理的麦麸中喂养,分别在第3、6、9和12天后观察黄粉虫的死亡情况,并计算致死率,对照组为二氯甲烷.每组 3次重复,每个重复30条3龄大小一致的幼虫.致死率和校正致死率分别按照式(1)和式(2)计算.

1.7.2 拒食性处理
采用随机喂养的生物实验方法[20],实验前对 3龄黄粉虫幼虫进行分组处理和隔夜 16,h饥饿处理.然后用麦麸和新鲜蔬菜喂饱(停止进食开始休息时即为吃饱,大约 15,min),再进行 3,h饥饿处理,然后用以上处理的麦麸喂食,每组 2,g,对照组用二氯甲烷处理麦麸,分别在第 3、6和 9天后称量麦麸的质量差即饲料减少量m,并计算拒食率.每组3次重复,每个重复 30条 3龄大小一致的幼虫.拒食率按式(3)计算.

1.7.3 趋避性处理
称取相同质量的药剂处理的麦麸和二氯甲烷溶液处理的麦麸,分别均匀放入培养皿的两边,中间留有2,cm宽的空间,防止黄粉虫幼虫.分别在3、6、9,d后记录培养皿中实验与对照组两边的黄粉虫的虫口数,并计算其趋避率.每组3次重复,每个重复30条3龄大小一致的幼虫.趋避率按式(4)计算.

1.8 统计分析
用Excel软件进行数据处理分析,实验结果用平均值±标准差表示,并以阴性对照或阳性对照为比较对象,分别同另一对照以及实验组的实验结果作显著性统计分析.
2 结果与讨论
2.1 印楝素乳油(0.3%)农药制剂的黄粉虫幼虫有效浓度确定
在菜青虫等害虫防治的使用说明中,0.3%印楝素乳油农药可以稀释700倍使用,但针对黄粉虫幼虫的有效处理浓度,还没有加以说明和相关的报道.将0.3%印楝素乳油制剂分别稀释 1、100、300、500和700倍后处理幼虫,并统计其校正致死率.图1显示,死亡的幼虫虫体局部有环状黑斑(图中箭头为幼虫的黑斑处)出现,以其可以辨别虫体的死活.图2显示,在稀释 100倍时,第 9天的幼虫校正致死率约为50%,而在稀释700倍时为10%以下.因此,采用稀释100倍的制剂作为阳性对照用药,以此确定印楝素 A的工作浓度为0.003%;3种印楝培养物浸提液在测定其印楝素含量后,用二氯甲烷分别将其稀释成印楝素含量为0.003%的工作液.

图2 不同稀释倍数的印楝素乳油农药对黄粉虫幼虫校正致死率的影响(第9天)Fig.2 Effect of different dilutions of azadirachtinEC on the correction mortality of Tenebrio molitor larvae(on the 9th day)
2.2 不同培养物浸提液对黄粉虫幼虫校正致死率的影响
不同培养物浸提液对黄粉虫幼虫校正致死率的影响结果见表1.
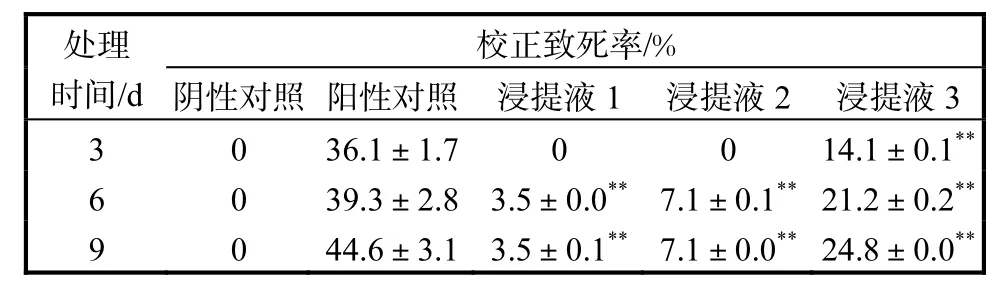
表1 不同培养物浸提液对黄粉虫幼虫校正致死率的影响(n=3)Tab.1 Effect of different extracts on the adjusted lethal rate of Tenebrio molitor larvae(n=3)
由表1可知:浸提液3即悬浮培养物细胞浸提液的幼虫致死率最高,但仍然明显低于印楝素农药;浸提液 1即愈伤组织浸提液的效果最差.由此表明,3种培养物中除印楝素外,还有其他杀虫成分发挥作用,且存在着组织、细胞内外等分布上的差异.
2.3 不同培养物浸提液对黄粉虫幼虫质量的影响
不同培养物浸提液对黄粉虫幼虫质量的影响结果见表 2.阴性对照表明,0~9,d时幼虫的质量不断增加;经印楝素农药处理后,幼虫质量持续下降;而经印楝培养物浸提液处理,幼虫质量先升高,后下降,第 9天,与阴性对照相比,达到了极显著差异水平.其中,浸提液 2即悬浮培养物浸提液的影响效果较其他两种浸提液有所延后.由此表明,培养物浸提液显著影响黄粉虫幼虫的生长.

表2 不同培养物浸提液对黄粉虫幼虫质量的影响(n=3)Tab.2 Effect of different extracts on the body weight of Tenebrio molitor larvae(n=3)
2.4 不同培养物浸提液对黄粉虫幼虫拒食率的影响
黄粉虫幼虫拒食率的结果见表3.由表3可知:3种培养物浸提液处理幼虫后,其拒食率均有显著提高,其中浸提液1和浸提液3即愈伤组织浸提液和悬浮培养物细胞浸提液的效果达到或超过印楝素农药的阳性对照组.高拒食率导致幼虫的食量下降也是幼虫质量下降的主要因素之一,在实际使用中具有重要价值.

表3 不同培养物浸提液对黄粉虫幼虫拒食率的影响(n=3)Tab.3 Effect of different extracts on the antifeeding rate of Tenebrio molitor larvae(n=3)
2.5 不同培养物浸提液对黄粉虫幼虫趋避率的影响分别应用对照液和 3种印楝培养物浸提液处理
幼虫的食源,幼虫在短期选择中趋向明显,但时间较长后,这种趋势明显减弱.表 4仅列出了前 2,d的统计结果.由表4可知,3种培养物浸提液在24,h内的幼虫趋避率最好,达到阳性对照的水平,但随后的趋避率明显下降,其中,浸提液1和浸提液2即愈伤组织浸提液和悬浮培养物浸提液在48,h后最为明显.
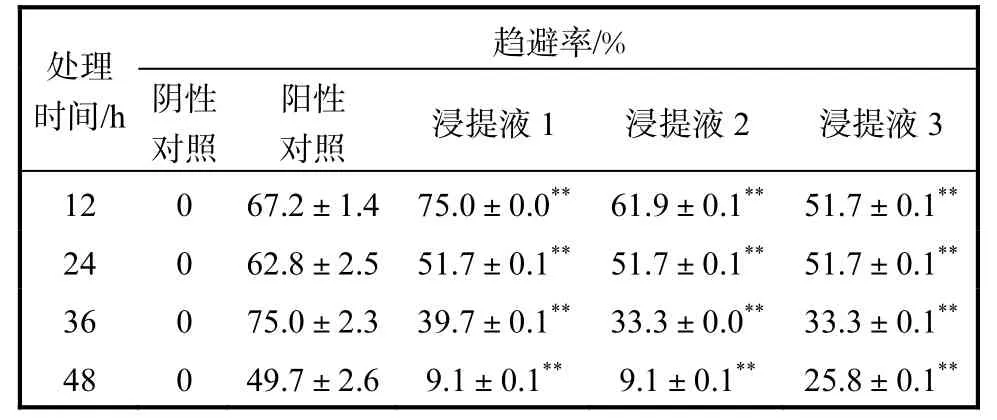
表4 不同培养物浸提液对黄粉虫幼虫趋避率的影响(n=3)Tab.4 Effect of different extracts on the repellent rate of Tenebrio molitor larvae(n=3)
3 结 论
愈伤组织浸提液、悬浮培养物浸提液和悬浮培养物细胞浸提液在幼虫质量、拒食率和趋避率等方面达到或超过印楝素农药的控虫效果,但在致死率方面三者表现较印楝素乳剂农药差.印楝培养物的 3种浸提液之间在控虫的各项指标上也存在着一定的差异,可能因为它们的有效成分及其含量上有所不同而导致控虫结果的差异,具体机制有待进一步研究.综上所述,通过组织、细胞途径获得的培养物经过一步浸提后可直接生产低成本的杀虫剂原料.
[1] Chaturvedi R,Razdan M K,Bhojwani S S. Production of haploids of neem(Azadirachta indica A. Juss. )by anther culture[J]. Plant Cell Reports,2003,21(6):531–537.
[2] Govindachari T R,Gopalakrishnan G,Suresh G. Triterpenoidal constituents of an aqueous extract from neem kernels[J]. Fitoterapia,1999,70(6):558–560.
[3] Sanderson K. Chemists synthesize a natural-born killer[J]. Nature,2007,448(7154):630–631.
[4] Thengane S,Joshi M,Mascarenhas A F. Somatic embryo genesis in neem(Azadirachta indica)[J]. Forestry Sciences,1995,44/45/46:357–374.
[5] Prakash G,Emmannuel C J S K,Srivastava A K. Variability of azadirachtin in Azadirachta indica neem and batch kinetics studies of cell suspension culture[J]. Biotechnology and Bioprocess Engineering,2005,10(3):198–204.
[6] Dai J,Yaylayan V A,Raghavan G S,et al. Extraction and colorimetric determination of azadirachtin-related limonoids in neem seed kernel[J]. Journal of Agriculture and Food Chemistry,1999,47(9):3738–3742.
[7] Jadeja G C,Maheshwari R C,Naik S N. Extraction of natural insecticide azadirachtin from neem(Azadirachta indica A. Juss)seed kernels using pressurized hot solvent[J]. The Journal of Supercritical Fluids,2011 ,56(3):253–258.
[8] Sujanya S,Devi B P,Sai I. In vitro production of azadirachtin from cell suspension cultures of Azadirachta indica[J]. Journal of Biosciences,2008,33(1):13–20.
[9] Prakash G,Srivastava A K. Statistical elicitor optimization studies for the enhancement of azadirachtin production in bioreactor Azadirachta indica cell cultivation[J].Biochemical Engineering Journal,2008,40(2):218–226.
[10] 段琼芬,王有琼,孙龙,等. 4种提取印楝素方法的比较[J]. 农药,2005,44(10):455–456,459.
[11] 杨军,罗喜荣,范菊娣,等. 罐组式动态逆流提取印楝素的工艺[J]. 农药,2010,49(6):413–415.
[12] Johnson S,Morgan E D. Supercritical fluid extraction of oil and triterpenoids from neem seeds[J]. Phytochemical Analysis,1997,8(5):228–232.
[13] Dai J M,Yaylayan V A,Raghavan G S V,et al. Influence of operating parameters on the use of the microwaveassisted process(MAP)for the extraction of azadirachtinrelated limonoids from neem(Azadirachta indica)under atmospheric pressure conditions[J]. Journal of Agricultural and Food Chemistry,2001,49(10):4584–4588.
[14] Tonthubthimthong P,Chuaprasert S,Douglas P,et al.Supercritical CO2extraction of nimbin from neem seedsan experimental study[J]. Journal of Food Engineering,2001,47(4):289–293.
[15] Kearney M L,Allan E J,Hooker E J,et al. Antifeedant effects of in vitro culture extracts of the neem tree,Azadirachta indica against the desert locust(Schistocerca gregaria(Forskål))[J]. Plant Cell,Tissue and Organ Culture,1994,37(1):67–71.
[16] 梁军,魏刚,吕全,等. 印楝细胞悬浮培养系的建立及悬浮培养[J]. 林业科学研究,2003,16(5):568–574.
[17] Singh M,Chaturvedi R. Statistical optimization of media for enhanced azadirachtin production from redifferentiated zygotic embryo cultures of neem(Azadirachta indica A. Juss. )[J]. In Vitro Cellular & Developmental Biology-Plant,2012,48(1):92–98.
[18] Murashige T,Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue culture[J].Physiologia Plantarum,1962,15(3):473–497.
[19] Prakash G,Srivastava A K. Statistical media optimization for cell growth and azadirachtin production in Azadirachta indica(A. Juss)suspension cultures[J].Process Biochemistry,2005,40(12):3795–3800.
[20] Lewis A C,Van Emden H F. Assays for insect feeding[M]. New York:Insect-Plant Interactions,1986:95–119.
