重组人心肌肌钙蛋白I基因工程菌的构建与表达
2014-05-08丁祥瑞汪建明蔡胜和
丁祥瑞,汪建明,蔡胜和
(1. 天津科技大学食品工程与生物技术学院,天津 300457;2. 天津石桥生物科技有限责任公司,天津 300457)
急性心肌梗死(acute myocardiacal infarction,AMI)是临床常见的心血管疾病,据统计在心血管疾病患者中有 40%死于 AMI,所以,对 AMI诊断的研究一直倍受临床研究的重视.AMI主要是根据临床症状、心电图和血清心肌酶谱的变化情况来诊断,但随着科学研究的深入,这些诊断标准越来越受到专家们的质疑.研究发现,人心肌肌钙蛋白 I(human cardiac troponin I,hcTnI)在心肌受到微小损伤时出现早,持续时间长,且为心肌细胞所特有,因此 hcTnI正逐步取代其他的生化标志物成为诊断心肌损伤的首选生化指标[1–2],特别是急性心肌梗死的诊断“金标准”[3–4].
本文采用基因工程方法利用原核表达系统制备未添加任何序列标签的重组 hcTnI,使其更接近天然蛋白和有更好的抗原性,为进一步制备高质量抗体及开发具有自主知识产权的 hcTnI诊断试剂盒奠定实验基础,并促进hcTnI诊断标准化问题的研究.
1 材料与方法
1.1 材料
1.1.1 目的基因片段、载体和菌株
hcTnI全基因合成菌液由北京华大基因公司合成;pET-11a载体菌液购自北京天恩泽公司;大肠杆菌(E.,coli)DH5α克隆菌株和 BL21(DE3)表达菌株均为本实验室保存.1.1.2 酶和实验试剂
Nde I内切酶、Bam HI内切酶、T4,DNA 连接酶,纽英伦生物技术(北京)有限公司;DNA凝胶回收试剂盒和质粒提取试剂盒,OMEGA公司;DNA marker,上海纯优生物科技有限公司;hcTnI抗体,Sigma公司;其他试剂均为分析纯.
1.1.3 实验仪器
高性能台式离心机,Thermo Scientific;电泳仪,北京市六一仪器厂;恒温摇床,上海智诚分析仪器制造有限公司;超声波细胞粉碎机,宁波新芝生物科技股份有限公司.
1.2 实验方法
1.2.1 重组hcTnI基因表达序列的设计
NCBI网站 GeneBank基因文库[5]提供的人心肌肌钙蛋白 I(hcTnI)基因序列号:NM_000,363.4,大小630,bp.本实验设计在目的基因的5’端添加Nde I限制性内切酶和3’端添加Bam HI限制性内切酶位点;并对上游引物的第2位和第4位密码子的第3个碱基简并定点突变,以便在表达过程中可提高表达产量.确定目的基因设计要求,委托北京华大基因公司进行全基因合成hcTnI目的片段.
1.2.2 重组hcTnI全长基因克隆获得
将含hcTnI全基因序列的大肠杆菌液按1∶100接种至氨苄抗性(AMP)的LB培养基中培养,用质粒回收试剂盒提取菌液质粒,经Nde I限制性内切酶和Bam HI限制性内切酶双酶切、1%琼脂糖凝胶电泳,并把酶切的目的片段用凝胶试剂盒回收待用.pET-11a载体商品菌液也按1∶100接种至AMP抗性LB液体培养基中培养,用质粒提取试剂盒提取载体质粒,经 Nde I酶和 Bam HI酶双酶切,琼脂糖凝胶电泳,切胶回收 pET-11a大片段质粒.按物质的量浓度比1∶3将切胶回收的pET-11a大片段质粒和切胶回收的目的基因片段用 T4,DNA连接酶连接,4,℃连接16,h.将连接产物转化至 E.,coli DH5α 感受态菌株,均匀挑取转化平板中的单克隆,提取质粒.挑取阳性转化子双酶切鉴定,1%琼脂糖凝胶电泳验证该克隆的正确性.
1.2.3 重组质粒的表达和鉴定
将双酶切鉴定正确的pET-11a-hcTnI/E.,coli DH5α单克隆扩大培养,提取重组质粒,转化BL21(DE3)感受态细胞于 AMP抗性的 LB平板上,过夜培养,均匀挑取阳性单抗隆菌落提取质粒,接种到 5,mL含1,mg/mL的 AMP抗性的 LB液体培养基中,37,℃、200,r/min过夜培养.再扩大转接 500,mL AMP抗性的 LB液体培养基中,37,℃、200,r/min振荡培养至A600为1.0后,加 1.0,mmoL/L的诱导剂 IPTG诱导,30,℃、200,r/min 振摇 4,h.4,℃、6,000,r/min 离心10,min收集菌体,加 20,mL PBS(10,mmoL/L,pH 7.4)重悬.超声破碎,其条件为:功率 285,W,1.5,s工作,1.5,s休息,破碎30,min至菌液透亮.取破碎菌液于 4,℃、9,000,r/min离心 30,min,收集离心上清液,沉淀用等体积的 PBS重悬,分别取 30,µL诱导前菌液、诱导后菌液、破碎离心上清液和破碎沉淀重悬液,进行12%的SDS-PAGE电泳分析.
1.2.4 表达产物的免疫特性分析
将菌体超声破碎后离心的上清液进行 SDSPAGE,转硝酸纤维素膜,蛋白免疫印迹反应.用半干式转移电泳仪电转硝酸纤维素膜 2,h,5%脱脂奶粉封闭液 4,℃过夜,1×PBS洗膜,加入鼠抗 hcTnI单抗(1∶1,000),37,℃结合 2,h,洗膜,加入辣根过氧化物酶标记的羊抗鼠二抗(1∶10,000),37,℃结合 2,h,充分洗涤后ECL鉴定表达产物.
2 结果与分析
2.1 设计的目的片段序列
在hcTnI基因5’端铰链区转录成mRNA后形成一个稳定的颈–环结构,在翻译时易形成位阻使酶结合能力减低或不能结合,从而造成目的蛋白的表达量低的问题[6].所以,为了提高目的蛋白 hcTnI的表达产量,在hcTnI基因5’端第2位和第4位密码子的第3个碱基进行简并碱基突变;在目的基因序列的5’端添加Nde I限制性内切酶和3’端添加Bam HI限制性内切酶位点.
hcTnI全基因合成序列(627,bp)如下:

2.2 酶切回收目的基因片段和载体pET-11a大片段
将全基因合成的含有目的基因片段的菌液和pET-11a载体菌液分别接种于AMP抗性的LB培养基中扩大培养,提取质粒,用限制性内切酶 Nde I和Bam HI进行双酶切,按照凝胶回收试剂盒回收酶切质粒,结果如图1所示.
由图 1可知:双酶切回收质粒 DNA条带进行1%琼脂糖凝胶电泳,凝胶分析仪下拍照并分析,泳道1显示双酶切回收的目的基因条带清晰大小约为630,bp 的片段,与(GeneBank NM_000363.4)公布的hcTnI条带大小相符;泳道 2显示只有 1个条带,条带的位置和载体pET-11a质粒理论值一致.
2.3 克隆菌株中重组质粒的酶切鉴定
连接产物转化克隆菌株 E.,coli DH5α感受态细胞,对重组质粒进行双酶切鉴定,结果如图 2所示.由图 2可知:重组质粒大小正确,酶切下的目的片段位置与理论相符,条带清晰,附近无杂带出现.阳性重组子被双酶切成 2个片段,其中小片段为630,bp,符合目的片段的大小;大片段和阴性对照一致.以上实验结果表明:目的基因已正确插入载体pET-11a中.

图2 重组质粒的酶切鉴定Fig.2 Enzyme identification of recombined plasmid
2.4 重组菌株的诱导表达及鉴定
重组质粒 pET-11a-hcTnI转化 BL21(DE3).挑取阳性克隆扩大培养,经 1,mmoL/L的 IPTG诱导.诱导前后分别取样并进行 12%的 SDS-PAGE,结果如图3所示.

图1 hcTnI和pET-11a的酶切回收Fig.1 Enzyme digestive and recovered product of hcTnI and the vector pET-11a

图3 重组菌株的诱导表达Fig.3 Expression states of induced recombined stains
诱导后在相对分子质量约 2.6×104处蛋白条带明显,与预期的 hcTnI蛋白相对分子质量相符合.用凝胶条带光密度软件 BandScan扫描显示,所表达的目的蛋白占总菌体蛋白的 30.1%.为了进一步确定目的蛋白的表达形式,取破碎离心上清液和相应的PBS重悬沉淀液进行SDS-PAGE.由图4泳道2可知:在相对分子质量2.6×104处有显著的条带,与所设计重组菌株表达的目的蛋白hcTnI的相对分子质量吻合;此条带大部分存在菌体破碎的上清液中,说明本研究所构建的重组菌株在该实验的条件下,目的蛋白主要是以可溶性形式表达而非包涵体形式存在.

图4 目的蛋白hcTnI在上清液和包涵体中的分布Fig.4 Distribution of hcTnI protein in the supernatant and inclusion body
2.5 目的蛋白的免疫学分析
在目的蛋白的最佳表达条件下,用 DEAESephrose离心交换层析柱、硫酸铵处理和苯基疏水柱纯化得到纯度为76%的目的蛋白.分别取蛋白Marker和重组菌株诱导前、诱导后、纯化后的目的蛋白,经12%的 SDS-PAGE胶分离后,小心取胶转膜,进行免疫印迹实验,结果如图5所示.
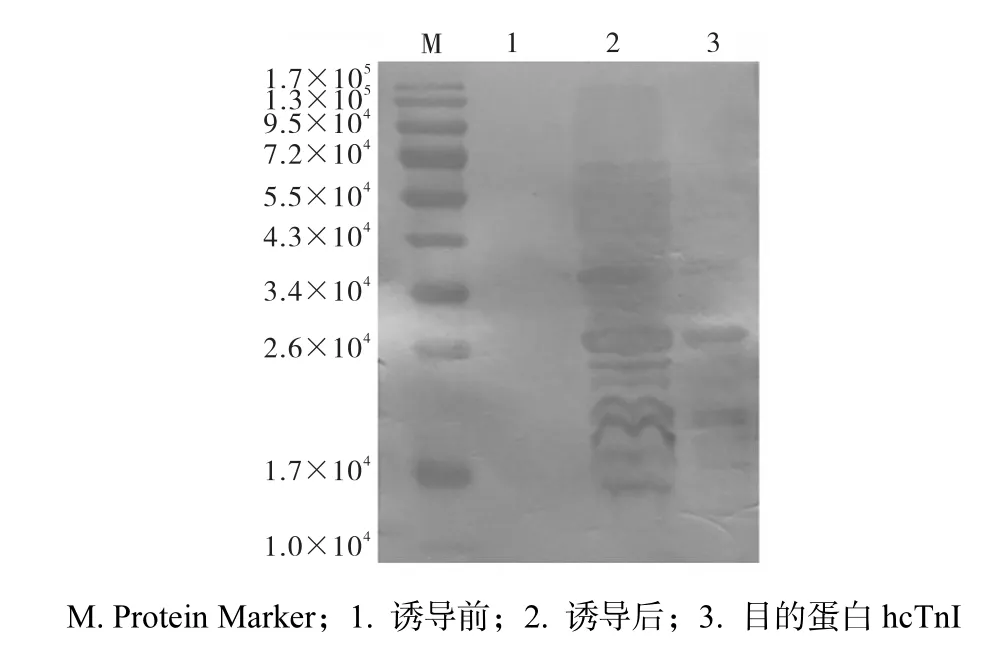
图5 hcTnI的免疫印迹鉴定Fig.5 Identification of the purpose protein (hcTnI) by Western Blot
由图 5可知,在相对分子质量 2.6×104处,泳道2和泳道3有明显条带,说明重组菌经诱导后表达的目的蛋白与hcTnI抗体是特异性反应的.由于纯化的目的蛋白的纯度达到72%,其他地方的显色条带有可能是降解的目的蛋白的某个抗原决定簇与抗体反应所致.
3 讨 论
肌钙蛋白是心肌横纹肌的结构调节蛋白[7],是 3个亚单位构成的复合体,分别为肌钙蛋白C(calcinmbinding component,TnC)、肌钙蛋白 I(in hibitory component,TnI)和肌钙蛋白 T(tropomyosin-binding component,TnT).TnI是 ATP酶的抑制性亚单位,可抑制肌球蛋白与肌动蛋白结合,阻止肌肉收缩.人心肌肌钙蛋白I只存在心肌组织中,含量(湿质量)为(5.7±0.6)mg/g,hcTnI的相对分子质量为 2.6×104.天然来源的 hcTnI直接从心肌组织中通过生化方法提取,由于人心肌组织来源十分困难,要直接从心肌组织中大量纯化抗原就十分困难和不经济;因此,利用基因工程的方法构建hcTnI的原核高效表达重组体就显得十分重要[8].
在构建重组工程菌时,本实验选用的表达载体是pET-11a,在此系列的载体中,外源基因的表达受 T7噬菌体 RNA聚合酶调控,可用 IPTG诱导外源基因的表达.本研究构建的重组体在诱导表达条件下以可溶性形式存在,不同于目前的hcTnI基因重组表达菌体目的蛋白以包涵体形式存在的报道[9].这可能是由于选取表达载体和菌体的表达条件的差异所致,这样不仅简化后续的纯化操作,也增加hcTnI稳定性和抗原性.
本研究采用基因工程等技术设计和鉴定后,成功构建了表达重组hcTnI的基因工程菌菌株.这解决了当前研制 hcTnI诊断试剂盒的过程中 hcTnI来源不足的问题,为进一步制备高特异性的抗体和推进hcTnI诊断标准化奠定基础.
[1] Mair J. Cardiac troponin I and troponin T:Are enxymes still relevant as cardiac markers[J]. Clinica Chimica Acta,1997,257(1):99-115.
[2] Wu A,Apple F,Gibler W,et al. National academy of clinical biochemistry standards of laboratory practice:Recommendations for the use of cardiac markers in coronary artery diseases[J]. Clinical Chemistry ,1999 ,45(7):1104-1121.
[3] Morjana N,Clark D,Tal R. Biochemical and immunological properties of human cardiac troponin I fragments[J]. Biotechnology and Applied Biochemistry,2001,33(2):107-115.
[4] Penttilä K,Koukkunen H,Halinen M,et al. Serum and plasma as alternative sample types in analysis of cardiac markers in the clinical routine[J]. Scandinavian Journal of Clinical & Laboratory Investigation,2002,62(7):553-560.
[5] Vallins W J,Brand N J,Dabhade N,et al. Molecular cloning of human cardiac troponin I using polymerase chain reaction[J]. FEBS Letters,1990,270(1/2):57-61.
[6] AI-Hillawi E,Minchin S D,Trayer I P. Overexpression of human cardiac troponin I and troponin C in E. coli and their purification and characterization[J]. European Journal of Biochemisty,1994,225(33):1195-1201.
[7] Farach C S,Reinach F C. The troponin complex and regulation of muscle contraction[J]. FASEB Journal,1995,9(9):755-767.
[8] 刘芬,汪莉,何辉,等. 人心肌肌钙蛋白 I基因原核表达载体的构建与鉴定[J]. 咸宁学院学报:医学版,2007,21(5):388-390.
[9] 李玉彬. 重组人心肌肌钙蛋白 I基因工程菌的构建[D]. 北京:中国协和医科大学,2007.
