PCR-DGGE结合测序在检测混合细菌感染中的价值
2014-05-05黄君华张书婉张宁
黄君华,张书婉,张宁
(1.西安医学院医学技术系,陕西 西安 710021;2.西安市儿童医院检验科,陕西 西安 710003;3.西安交通大学医学院第一附属医院检验科,陕西 西安 710061)
PCR-DGGE结合测序在检测混合细菌感染中的价值
黄君华1,张书婉2,张宁3
(1.西安医学院医学技术系,陕西 西安 710021;2.西安市儿童医院检验科,陕西 西安 710003;3.西安交通大学医学院第一附属医院检验科,陕西 西安 710061)
目的探讨变性梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE)结合测序在检测混合细菌感染中的作用,为细菌多重感染的诊断提供新的思路。方法以3份临床培养鉴定为混合感染的胆囊穿刺引流液为对象,提取细菌总DNA并扩增16S rDNA-V3区,后进行DGGE分析,将所得条带切胶纯化再扩增,扩增产物进行测序及BLAST比对,比较比对结果与临床培养结果的一致性。结果DGGE可以很好地分离16S rDNA-V3区混合PCR产物,每一个扩增子的测序比对结果与临床培养结果一致。结论PCR-DGGE结合测序的方法可以很好地鉴定临床混合感染标本中的病原菌,可作为快速检测方法在临床应用。
混合细菌感染;通用引物PCR;变性梯度凝胶电泳;测序;快速检测
混合细菌感染的发病率逐年增多[1],而目前临床上主要应用培养的方法检测混合细菌感染,耗时长,检出率低,容易出现假阴性[2]。近些年,分子生物学方法,尤其是16S rDNA PCR技术[3],在快速检测细菌感染方面应用广泛,然而检测混合细菌感染的分子生物学方法较少。本实验应用通用引物PCR扩增细菌16S rDNA-V3区,混合的扩增子在变性聚丙烯酰胺凝胶中进行电泳,从而使长度相同但序列不同的扩增子相互分离,然后将扩增子进行回收测序和序列比对,并将比对结果与培养结果相比较,取得满意的预期目标,为检测混合感染提供了新的分子生物学途径。
1 材料与方法
1.1 实验材料从西安交通大学医学院第一附属医院肝胆外科收集3份经VITEK compact全自动细菌鉴定药敏分析仪培养鉴定为混合细菌感染的胆囊穿刺引流液各2 ml。
1.2 方法
1.2.1 穿刺引流液细菌总DNA的提取将穿刺引流液标本离心5 min,取沉淀,应用QIAamp Blood DNA Mini Kit试剂盒(QIAGEN,Cat.No.51106),操作步骤按照试剂盒说明书。
1.2.2 PCR扩增选择可扩增细菌16S rDNA-V3区的通用引物扩增细菌总DNA。引物序列参照Muyzer等[4]设计,其中上游引物5'端延伸添加GC夹(GCclamps序例:GCGCGGCGGGCGGGGCGGGGGCACGGG GGG),用以提高PCR产物在DGGE中分离效率[5]。V3-F-GC:GCclamps-CCTACGGGAGGCAG,V3-R:ATTACCGCGGCTGCTGG,扩增产物大小为193 bp。50µlPCR反应体系,包括:10×buffer5µl,10mmol/LdNTP 1µl,2.5 mmol/LMgCl25µl,5µmol/LV3-F、V3-R各2µl,Taq酶(5 U/µl)0.4µl,DNA模板4µl,ddH2O 30.6µl。PCR反应程序:采用touchdown PCR[4],即预变性95℃5 min;95℃变性1 min,退火温度初次设定为65℃1 min,延伸65℃1 min,退火温度每2个循环降低1℃,最后退火温度降到55℃,在此退火温度上再进行10个循环;72℃7 min,4℃保存。PCR产物用2%琼脂糖凝胶电泳检测,电泳的电压为6 V/cm,采用溴化乙锭(EB)染色20 min,后在凝胶成像分析系统拍照保存。
1.2.3 DGGE分析应用DcodeTM Universal Mutation检测系统(Bio-Rad,Herchles,CA,USA),胶板大小16 cm×10 cm×1 cm。实验中通过反复摸索得到16S rDNA-V3区通用引物PCR扩增产物DGGE电泳的最适条件为:聚丙烯凝胶胶浓度为8%,变性梯度范围(由上到下)为30%~65%。按照仪器使用说明将凝胶装置在电泳系统中,在新配置的1×TAE电泳缓冲液中,以150 V电压预电泳30 min,然后取10µl扩增产物,与6×loading buffer混匀,加入到上样孔中,安装好电泳系统后,即电泳:先以60 V电泳1 h,后以100 V电压12 h,电泳温度设置为60℃。电泳完毕后,小心地将胶放入EB溶液(终浓度为0.5 μg/ml)中染色20 min,然后在凝胶成像系统中观察并拍照保存。用洁净的刀片切下目的条带,放入盛有100µl 1×TE的1.5 ml灭菌Ep管中。将盛有凝胶的Ep管放入99℃金属浴20 min,使凝胶融化,然后以管中液体为模板,再次PCR扩增,反应体系、扩增程序如前所述,但引物为不带GC夹的V3-F/V3-R。
1.2.4 测序比对获得的扩增产物经纯化后送上海生工生物工程有限公司测序,登陆http://www. ncbi.nlm.nih.gov/blast/Blast.cgi,将测序结果在Gen-Bank中进行BLAST比对。
2 结果
2.1 16S rRNA-V3区通用引物扩增结果16S rRNA-V3区通用引物的扩增产物与预期片段大小(193 bp)相符合(图1)。从结果可以看出混合细菌经通用引物扩增后仅有一种大小的产物,且混合扩增子经普通琼脂糖电泳无法区分。
2.2 DGGE结果我们预想16S rRNA-V3区通用引物所产生的混合扩增子通过DGGE可分离开,若出现两条条带,说明混合PCR产物中有两种扩增子;若出现三条条带,说明有三种扩增子;若条带出现在同一水平上则应为同一种病原菌。实验结果与预想的相同(图2),1道有两条条带,临床培养出两种菌(粪肠球菌、阴沟肠杆菌);2道有三条条带,临床培养出三种菌(粪肠球菌、屎肠球菌、产气肠杆菌);3道有三条条带,临床培养出三种菌(屎肠球菌、大肠埃希菌、表皮葡萄球菌)。
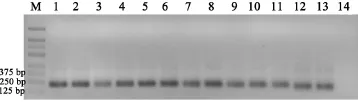
图1 16 S rRNA-V3区通用引物扩增结果

图2 多重感染标本DGGE结果
2.3 DGGE图谱切胶回收测序结果将所得到的8条条带进行测序,得到8个测序结果,利用BLAST进行比对。从结果中可以看到,比对结果与培养结果一致,并证实图谱上同一位置条带为相同菌种(表1,图2)。

表1 混合感染16S rRNA-V3区PCR-DGGE回收条带测序结果及临床培养结果
3 讨论
DGGE是根据DNA的解链特性,在不同浓度的变性剂中,不同碱基组成的DNA双螺旋的解链行为不同而导致其电泳迁移率发生变化,从而将片段大小相同而序列不同的DNA片段很理想地分开。DGGE主要应用在生物多样性调查、亲缘关系鉴定、基因突变检测等领域。在微生物研究领域中,其主要应用于微生物生态学。1993年Muyzer等[4]首次将变性梯度凝胶电泳技术应用到微生态领域。该技术对微生态的分析主要包括三步:首先从微生态标本中提取所有微生物总的DNA;其次用16S rRNA基因通用引物进行PCR扩增,将混合的扩增子在变性聚丙烯酰胺凝胶中进行电泳,从而使长度相同但序列不同的扩增子相互分离;最后进行DGGE指纹图谱分析。该技术的一大优点是可以从凝胶中切下条带,然后通过测序来鉴定菌种。不足之处在于如果不同DNA片段有相似的融点行为,则不能分离开来。为达到良好的分离效果,通常在一条通用引物的5'端连接一段长度为30~50bp富含GC的核苷酸序列,称为GC夹(GC-clamps),这样可以显著地提高分辨力。Wu等[5]应用UP-PCR扩增肠道菌群16S rRNA基因V3区,然后用DGGE进行分析,发现2型糖尿患者与正常人的肠道菌群有显著差异。
所有原核细胞基因组DNA经16S rRNA基因通用引物扩增后,所产生的扩增子长度都是相同的,因此对于混合细菌感染,仅用通用引物PCR和测序无法对感染病原菌进行鉴定。为了鉴定混合感染中的各个病原菌种类,本实验用DGGE对标本进行分析。首先从标本中提取所有病原菌的DNA,然后用16S rRNA基因通用引物V3-F/V3-R进行PCR扩增,得到193 bp的扩增产物,将混合的扩增子在变性聚丙烯酰胺凝胶中进行电泳使之相互分离,最后从凝胶中切下条带,通过测序来鉴定菌种,取得良好的效果,为多重感染标本中病原菌的分离鉴定提供了新思路。为达到良好的分离效果,提高分辨力,本实验也用了GC夹。由培养结果、DGGE结果和测序比对结果可知,在DGGE图谱中,同一水平位置上的条带为一种菌(条带1和3为粪肠球菌;条带4和6为屎肠球菌);两种菌感染出现两条条带,三种菌感染会出现三条条带。
混合细菌感染可发生于许多疾病,如支气管肺炎[6]、肺结核[7]、脑脓肿、脑膜炎[8]、骨关节感染[9]、糖尿病、胆囊感染、胸腹水感染、感染性心内膜炎[10]等。目前临床主要通过培养进行鉴定,耗时较长,假阴性率高。一些分子生物学方法,如多重PCR、荧光定量PCR[11],检测范围窄,同样会出现假阴性。本方法不仅适用于胆囊穿刺引流液,同样适用于其他无菌部位混合感染的病原菌鉴定,后期工作需增加样本的来源种类和数量,进一步验证本方法的灵敏度和特异性,规范操作步骤,使其具有临床实用性。
综上所述,PCR-DGGE结合基因测序是一种很有前景的检测混合细菌感染的方法,能够达到与常规培养一致的效果。
[1]王朝辉.糖尿病足患者混合细菌感染的培养及药敏分析[J].中国民康医学,2010,22(14):1772-1773.
[2]Keller PM,Rampini SK,Bloemberg GV.Detection of a mixed infection in a culture-negative brain abscess by broad-spectrum bacterial 16S rRNA gene PCR[J].Journal of Clinical Microbiology,2010,48 (6):2250-2252.
[3]Sontakke S.Use of broad range16S rDNA PCR in clinical microbiology[J].Journal of Microbiological Methods,2009,76(3): 217-225.
[4]Muyzer G,de Waal EC,Uitterlinden AG.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Appl Environ Microbiol,1993,59(3):695-700.
[5]Wu X,Ma C,Han L,et al.Molecular characterisation of the faecal microbiota in patients with type II diabetes[J].Curr Microbiol, 2010,61(1):69-78.
[6]李子玉,李俊华,赵爱华.混合细菌感染性肺炎46例临床分析[J].河南医药信息,2000,8(4):3-4.
[7]杨婉玲.住院肺结核病人肺部混合细菌感染者病原菌及其耐药性分析[J].内蒙古医学杂志,2008,40(1):52-54.
[8]Corless CE,Guiver M,Borrow R,et al.Simultaneous detection of Neisseria meningitidis,Haemophilus influenzae,and Streptococcus pneumoniae in suspected cases of meningitis and septicemia using real-time PCR[J].Journal of Clinical Microbiology,2001,39(4): 1553-1558.
[9]Fenollar F,Roux V,Stein A,et al.Analysis of 525 samples to determine the usefulness of PCR amplification and sequencing of the 16S rRNA gene for diagnosis of bone and joint infections[J].Journal of Clinical Microbiology,2006,44(3):1018-1028.
[10]Bosshard PP,Kronenberg A,Zbinden R,et al.Etiologic diagnosis of infective endocarditis by broad-range polymerase chain reaction:a 3-year experience[J].Clin Infect Dis,2003,37(2):167-172.
[11]Fukasawa C,Ohkusu K,Sanayama Y,et al.A mixed bacterial infection of a bronchogenic lung cyst diagnosed by PCR[J].J Med Microbiol,2006,55(Pt 6):791-794.
Value of PCR-DGGE following by sequencing for detecting mixed bacterial infection.
HUANG Jun-hua1,
ZHANG Shu-wan2,ZHANG Ning3.
1.Department of Medical Technology,Xi'an Medical University,Xi'an 710021, Shaanxi,CHINA;2.Clinical Laboratory,Xi'an Children's Hospital,Xi'an 710003,Shaanxi,CHINA;3.Clinical Laboratory,the First Affiliated Hospital,School of Medicine,Xi'an Jiaotong University,Xi'an710061,Shaanxi,CHINA
ObjectiveTo explore the value of PCR-DGGE and sequencing for detecting mixed bacterial infection.MethodsA total of 3 samples which has been identified mixed bacterial infection by culture were included.The bacterial DNA was extracted and amplified the 16S rDNA-V3,following by DGGE,sequencing and BLAST.Then,to compare the consistency of BLAST and cultivation.ResultsDGGE could differentiate the mixed amplicons of 16SrDNA-V3 sensationally,and the results of BLAST and cultivation were consistent.ConclusionPCR-DGGE and sequencing provide a new way to diagnose mixed bacterial infection,which might be effective for identifying the pathogen in the sample.
Mixed bacterial infection;Broad-spectrum PCR;DGGE;Sequencing;Rapid detection
R37
A
1003—6350(2014)08—1154—03
10.3969/j.issn.1003-6350.2014.08.0447
2013-11-10)
黄君华。E-mail:huangjunhua1985@163.com