小鼠脑缺血再灌注损伤模型的建立及评价
2014-05-02王朗卢燕云周琴水小兰
王朗,卢燕云,周琴,水小兰
(1.武汉大学人民医院心血管内科,湖北武汉 430060;2.武汉大学心血管病研究所,湖北武汉 430060;3.武汉大学人民医院神经内科,湖北武汉 430060)
·论著·
小鼠脑缺血再灌注损伤模型的建立及评价
王朗1,2,卢燕云2,周琴3,水小兰1
(1.武汉大学人民医院心血管内科,湖北武汉 430060;2.武汉大学心血管病研究所,湖北武汉 430060;3.武汉大学人民医院神经内科,湖北武汉 430060)
目的探讨稳定的小鼠脑缺血再灌注损伤模型的制备和评价方法,评价缺血时间的延长对缺血再灌注损伤的影响。方法采用硅胶线栓暂时性阻塞小鼠大脑中动脉制备脑缺血再灌注损伤模型,通过神经功能评分、TTC染色、伊文氏蓝染色、Tunel染色、免疫荧光染色等方法评价45 min和60 min缺血再灌注时间所导致的梗死体积、神经功能、神经元凋亡以及氧化应激水平的差异。结果与45 min组相比,60 min缺血再灌注损伤使脑梗死体积增加了78.21%、神经功能评分升高了31.66%,神经元凋亡比例增加了44.49%,血脑屏障的破坏程度和氧化应激水平随着缺血时间的增加也明显增高。结论通过严格的手术操作和严密的术中监测,可以获得稳定的小鼠脑缺血再灌注损伤模型,缺血时间的延长显著增加了脑组织的损伤。
脑缺血再灌注损伤;凋亡;氧化应激;小鼠
脑卒中是多种脑血管疾病的严重表现形式,具有极高的致残率和较高的致死率,是危害人类生命健康的最主要疾病之一。近30年来我国脑卒中发病率逐年升高,以每年8.7%的速度上升,目前已达到185~219/10万人,每年至少有200万新发病例[1]。其中,缺血性脑卒中是脑卒中最常见的发病类型,在某些地区可以占到整个脑卒中病例的79%。通过组织纤溶酶原激活剂(tPA)溶栓治疗恢复脑组织供血是目前临床上治疗缺血性脑卒中唯一有效的方法。但由于严格的治疗时间窗限制,只有不到5%的卒中患者有机会接受tPA溶栓治疗[2]。而在持续较长时间的脑缺血后,即使恢复了阻塞血管的血流灌注仍会导致脑组织不可逆的损伤,并且增加脑出血的风险[3]。因此,阐明脑缺血以及再灌注过程中的病理生理机制,研究有效的卒中治疗靶点对于临床脑卒中的治疗具有重要意义。
小鼠和基因工程小鼠资源是目前疾病机制研究、基因功能研究、药物创制等领域最重要的动物模型之一,也是这些领域创新研究的必要条件[4]。利用基因工程小鼠针对脑卒中病理过程中的各个分子环节进行研究,对阐明脑卒中发生发展过程中的分子机制,寻找脑卒中治疗的分子靶点具有重要的意义。而建立稳定的小鼠脑缺血及再灌注损伤的动物模型并建立系统的模型评价体系是利用基因工程小鼠研究脑卒中病理生理机制的前提及关键。本文将系统阐述小鼠脑缺血再灌注损伤模型的制备及评价方法,对比45 min和60 min缺血再灌注时间所导致的损伤差异,并对缺血再灌注损伤后神经元的凋亡及氧化应激损伤进行评价。这些实验方法及所得到的实验数据将为我们后续以基因工程小鼠为研究对象的科学研究提供重要的实验基础。
1 材料与方法
1.1 实验动物选用雄性小鼠,11~12周龄,体重25~30 g,背景为C57BL/6的野生型小鼠(购自北京华阜康生物科技有限公司,质量合格证号:949431),所有实验小鼠均饲养在武汉大学心血管病研究所SPF级实验动物中心。SPF级小鼠饲料购自北京华阜康生物科技有限公司。饲养条件:室温22℃~24℃,湿度40%~70%,明暗交替照明时间为12 h,自由饮水摄食。
1.2 实验动物分组60只实验小鼠,通过大脑中动脉缺血再灌注建立脑梗死模型(I/R),随机分为45 min缺血再灌注损伤组(30只)和60 min缺血再灌注损伤组(30只)。
1.3 小鼠脑缺血再灌注损伤模型通过暂时性大脑中动脉阻塞(Transient middle cerebral artery occlusion,tMCAO)手术制备小鼠脑缺血再灌注损伤模型[5-6]。操作流程如下:(1)使用3%异氟烷麻醉小鼠,8%硫化钠脱去颈部的鼠毛,颅顶鼠毛用手术剪迅速剪掉,3%活力碘消毒颈部及颅顶皮2次,75%酒精脱碘1次。(2)在小鼠的颅顶部位横向切口,暴露颅骨,用镊子轻轻剥离颅骨表面的结缔组织。将激光多普勒血流仪(Periflux System 5010,Perimed)的光纤探头用生物胶固定在前囟后方2 mm、左侧5 mm的部位,即大脑中动脉供血区域。(3)将小鼠仰卧固定,颈正中线切口,沿胸锁乳突肌内缘分离肌肉和筋膜,分离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。用微动脉夹暂时夹闭ICA、CCA,在ECA远心端结扎和剪一小口,将硅胶线栓(6~0,Doccol)由剪口送入ICA,当线栓进入深度在9~11 mm时遇阻力,此时可在多普勒血流仪器上观察到血流的急剧下降,固定线栓。(4)从线栓进入脑血管至血流下降遇阻力时开始计时,45 min或60 min后将线栓拔出,并将ECA近心端结扎,迅速松开CCA处动脉夹。观察血流恢复情况,血流下降大于基础血流的75%以上,血流恢复达基础血流的70%以上,视为缺血再灌注模型制备成功。(5)缝合小鼠颈部及头部皮肤,并用活力碘消毒伤口。手术结束后,将小鼠放在28℃温箱中,待小鼠苏醒后转入饲养笼中常规饲养。
1.4 梗死体积的评价采用TTC染色法评价梗死体积[5]。抓取小鼠,腹腔注射3%戊巴比妥钠麻醉小鼠,取出脑组织,将其放入1 mm小鼠脑模,置于-20℃冰箱冰冻后切成1 mm厚的切片,共切7片。将切片立即置于10 ml 2%TTC溶液中,37℃恒温孵育10 min。正常脑组织染色后呈鲜红色,而梗死区呈苍白色。用10%中性福尔马林溶液固定脑组织切片后拍照。使用Image-Pro Plus 6.0软件测量并计算脑梗死体积。梗死体积%=(对侧大脑半球体积-梗死侧未梗死体积)/(对侧大脑半球体积×2)×100%。
1.5 神经功能的评价在tMCAO手术后的24 h对小鼠进行神经功能及行为学评分,采用基于Berderson神经功能评分改进的9分制评分方法[7]。0分:无神经受损的症状;1分:提尾时对侧前肢蜷曲,或者不能完全到达患侧前肢;2分:提尾时对侧肩膀内收;3分:平推,向对侧推动时阻力下降;4分:可自发的向各个方向运动,但在脱尾巴时只向对侧转弯;5分:自发运动时转圈或只向对转;6分:无自主运动,只在刺激时运动;7分:无自主运动,刺激时也无运动;8分:与脑缺血有关的死亡。
1.6 血脑屏障破坏程度的评价通过伊文氏蓝染色法评价血脑屏障的破坏情况[8]。用磷酸盐缓冲液(PBS)配置2%的伊文氏蓝染液,在缺血60 min后在灌注的即刻,按照4 ml/kg体重将伊文氏蓝染液注入小鼠体循环。24 h后麻醉小鼠,用PBS灌流小鼠全身组织器官后完整取出脑组织,沿中线将梗死半球和非梗死半球分开,放入EP管中-80℃保存。进行检测时从-80℃冰箱中取出脑组织,迅速向脑组织里加入3颗预冷的钢珠和1 ml冰50%(w/v)三氯乙酸溶液,盖好EP管盖,将EP管放入研磨仪研磨罐中,30次/s,碾磨1 90 s。于4℃下离心(1 000 g,5 min)后取200 μl上清液,用酶标仪610 nm测吸光值。参照Evens Blue标准曲线,计算脑组织中Evens Blue含量(µg/g大脑重量)。
1.7 神经元凋亡的评价使用Tunel染色法评价神经元的凋亡。取缺血再灌注损伤后24 h的脑组织制备8 μm厚的冰冻切片。将冰切组织切片置于(pH 7.4)1%的多聚甲醛中,室温固定水解10 min;PBS洗两次,每次5 min;然后根据Tuenl试剂盒的操作流程,依次加入平衡缓冲液,TdT酶反应液,终止/洗涤缓冲液,抗地高辛抗体进行孵育。最后碘化丙啶复染,封片干燥,-20℃避光保存;在荧光显微镜下观察计数凋亡神经元细胞。
1.8 氧化应激水平的评价8OHDG和4HNE是反映氧化应激水平的两个重要标志[9]。8OHDG是DNA氧化损伤的标志物,4NHE则是脂质氧化损伤的标志物。取缺血再灌注损伤后24 h的脑组织制备8 μm厚的冰冻切片。将冰切组织切片置于1%的多聚甲醛(pH 7.4)中,室温固定15 min。用含10%羊血清的PBS漂洗切片后,在组织上滴加抗4HNE(ab48506,Abcam,Cambridge,MA)或8OHDG抗体(sc-66036,Santa cruz,CA),4°C孵育过夜。PBS漂洗后加入相应二抗37°C孵育1 h。PBS漂洗后DAPI复染细胞核,封片干燥,-20℃避光保存;在荧光显微镜下观察计数阳性细胞数。
1.9 统计学方法全部数据使用统计软件包SPSS11.0进行处理,所有数据均以均数±标准差(±S)表示,多组间比较采用Oneway-ANOVA,两组间比较用非配对Student's t-test分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 脑梗死体积的评价45 min及60 min缺血再灌注均造成了明显的脑梗死。手术24 h后取材评价梗死体积百分比,45 min组为(24.23±4.11)mm3, 60 min组为(43.18±3.20)mm3(图1),两组间比较差异有统计学意义(P<0.01)。激光多普勒血流仪监测显示,无论是45 min组还是60 min组,缺血过程中的血流下降程度以及再灌注过程中的血流恢复程度比较差异均无统计学意义(图2)。
2.2 神经功能评价神经功能评分显示,45 min及60 min缺血再灌注损伤均造成了显著的神经功能受损。45 min组神经功能评分为(3.98±0.77)分,60 min组的神经功能评分为(5.24±0.82)分,两者比较差异具有统计学意义(P<0.01)。
2.3 血脑屏障通透性的评价45 min和60 min缺血再灌注损伤均能造成明显的血脑屏障破坏,表现为梗死侧脑组织出现明显的伊文氏蓝染色(图3)。组织匀浆液分光光度法检测伊文氏蓝的浓度显示,60 min组梗死侧为(22.75±4.38)μg(伊文氏蓝)/g(脑组织),对侧为(3.24±1.77)μg/g。45 min组梗死侧脑组织伊文氏蓝含量为(11.36±2.92)μg/g,对侧为(2.78±0.94)μg/g。缺血侧与对侧比较,以及60 min组的缺血侧与45 min组的缺血侧比较,差异均具有统计学意义。

图1 TTC染色示梗死体积
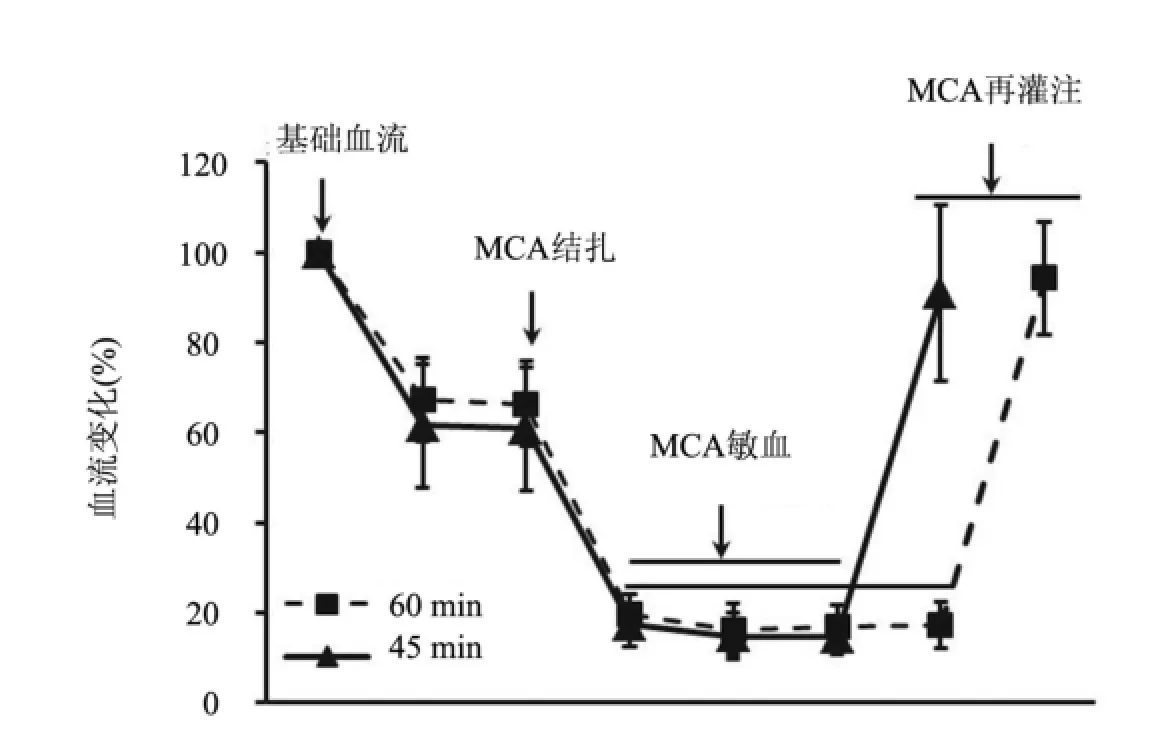
图2 多普勒血流监测示血流下降和恢复的程度
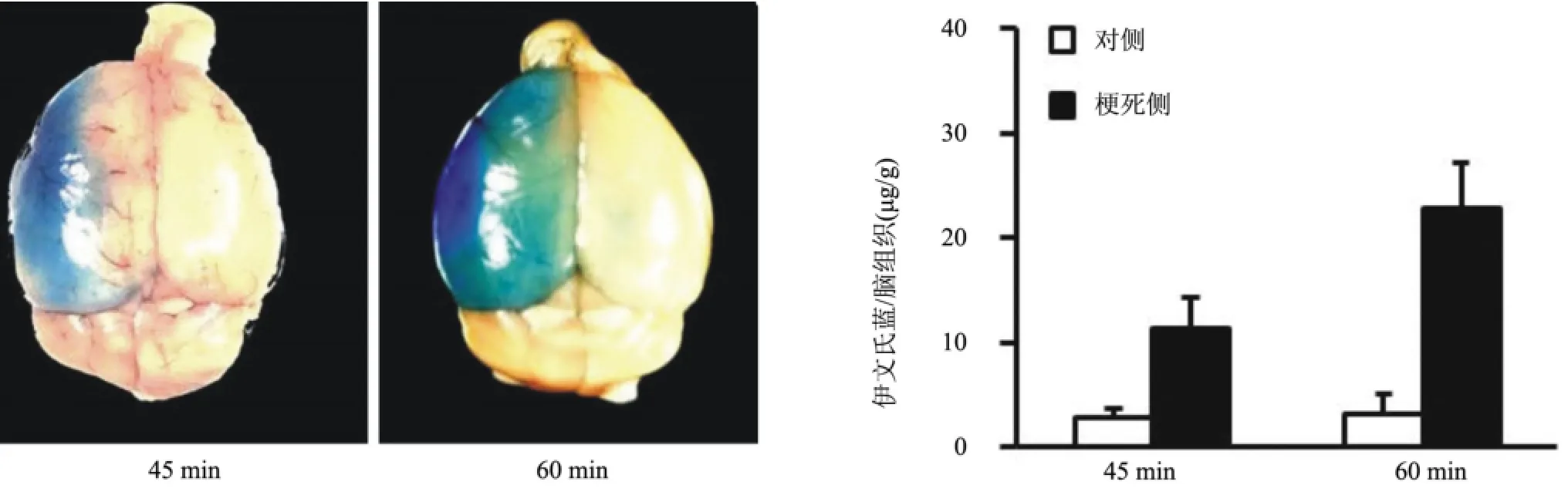
图3 伊文氏蓝染色示血脑屏障破坏程度
2.4 神经元凋亡水平的评价45 min和60 min脑缺血再灌注损伤后,在梗死周边区可以观察到明显的神经元凋亡,即Tunel和Neun双染阳性的细胞。45 min组梗死侧脑组织梗死周边区Tunel阳性细胞率为(41.65±2.48)%,60 min组为(60.18±1.40)%,两组间比较差异有统计学意义(P<0.01),见图4。
2.5 氧化应激水平的评价45 min和60 min缺血再灌注损伤后,在梗死周边区可以检测到大量4HNE和8OHDG阳性细胞,其中45 min组4HNE阳性细胞计数为(43.27±6.43)个/200倍视野,60 min组4HNE阳性细胞计数为(72.67±7.82)个/200倍视野,两组间比较差异有统计学意义(P<0.05)。45 min组8OHDG阳性细胞计数为(36.96±4.54)个/ 200倍视野,60 min组8OHDG阳性细胞计数为(61.45±4.36)个/200倍视野,两组间比较差异有统计学意义(P<0.05),见图5。
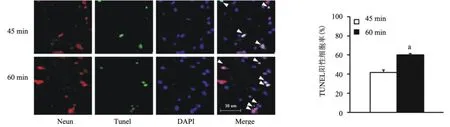
图4 Tunel和Neun双染示神经元凋亡

图54 HNE和8OHDG染色示氧化应激水平
3 讨论
本研究使用C57BL/6小鼠,建立了稳定的小鼠脑缺血再灌注损伤模型,通过对比45 min缺血时间和60 min缺血时间,发现缺血时间的延长显著地扩大了梗死体积,加重了神经功能损伤,并导致了更为严重的血脑屏障破坏、神经元凋亡以及氧化应激损伤。
目前国内研究脑缺血再灌注损伤大多使用大鼠模型,而随着基因敲除和转基因小鼠越来越广泛的应用,稳定的小鼠脑缺血再灌注损伤模型的建立显得尤为重要。通过本研究的实施,我们针对小鼠脑缺血再灌注损伤模型的成功建立总结了以下经验。首先,小鼠具有体重小、相对体表面积较大的特点,在麻醉状态下小鼠的体温不易保持,而体温对缺血损伤程度影响十分大。因此整个手术过程中应该保持手术室恒温,同时通过加热垫维持小鼠体温,并用肛温计监测整个手术过程中的小鼠体温。其次,合适的手术设备的选择十分重要。体视显微镜、较精细的显微手术器械、硅胶材质的具有一定弹性的线栓均是提高手术成功率的保障。第三,缺血区域脑血量流的监测是保证模型稳定的关键。激光多普勒血流测定是一种无创的血流监测手段,可以实时监测特定区域的血流供应情况。虽然用于实验的小鼠的周龄和体重均经过了严格的筛选,仍不能排除少数小鼠大脑中动脉直径存在个体差异,同时由于手术操作过程中存在的偶然因素,部分小鼠可能未能达到理想的血流阻断以及血流再灌。此时,通过激光多普勒脑血流仪的监测,可以将不符合实验要求的小鼠剔除,以保证模型的稳定以及实验结果的可靠。
本研究通过上述模型制备方法,建立了45 min缺血和60 min缺血两组小鼠脑缺血再灌注损伤模型。实验结果显示,45 min和60 min的缺血引起了明显的脑梗死和神经功能损伤。缺血时间的延长显著地增加了梗死体积并导致了神经功能的恶化。血脑屏障的破坏是脑缺血再灌注损伤的重要标志,是氧自由基、炎症因子、金属蛋白酶等共同作用的结果。本研究通过伊文氏蓝能够通过破坏的血脑屏障渗透进入脑组织的原理,检测两组小鼠血脑屏障破坏的情况,实验结果表明,缺血时间的延长会显著导致血脑屏障破坏程度的加重。
缺血再灌注损伤后神经元的凋亡是引起神经功能损伤和脑梗死体积扩大的主要原因。细胞在发生凋亡时,会激活一些DNA内切酶,这些内切酶会切断核小体间的基因组DNA,基因组DNA断裂时,暴露的3'-OH可以在末端脱氧核苷酸转移酶的催化下连接上荧光素标记的dUTP,从而可以通过荧光显微镜检测,即Tuenl染色。Tunel染色是目前国际上公认的凋亡细胞标测方法。本研究通过Tunel和神经元标志物Neun的双染,检测了梗死周边区神经元的凋亡水平,实验结果显示缺血时间的延长显著增加了凋亡细胞的比例。
氧化应激是缺血再灌注时引起细胞损伤的一个重要病理机制。氧自由基可以直接损伤细胞的核酸以及细胞膜的脂质从而引起细胞的死亡。8OHDG和4HNE是反映氧化应激水平的两个重要标志。8OHDG是DNA氧化损伤的标志物,4NHE则是脂质氧化损伤的标志物[9]。本研究通过8OHDG和4HNE的免疫荧光染色证实在缺血侧的脑组织中存在大量的氧化应激损伤的细胞。60 min缺血时间相对45 min缺血时间,显著加重了氧化应激损伤的程度。
综上所述,本研究摸索、建立了一种稳定的小鼠局灶性脑缺血再灌注损伤模型,证实了缺血时间的延长能显著加重脑缺血再灌注损伤的程度,具体表现在梗死体积增大、神经功能损伤加重以及血脑屏障破坏程度加剧这三个方面。缺血时间的延长还增加了缺血脑组织神经元的凋亡和氧化应激损伤。本研究将为今后以小鼠为实验对象的脑缺血再灌注损伤研究提供重要的技术参考。
参考资料:
[1]Zhao D,Liu J,Wang W,et al.Epidemiological transition of stroke in China:twenty-one-year observational study from the Sino-MONICA-Beijing Project[J].Stroke,2008,39:1668-1674.
[2]Chapman SN,Mehndiratta P,Johansen MC,et al.Current perspectives on the use of intravenous recombinant tissue plasminogen activator(tPA)for treatment of acute ischemic stroke[J].Vasc Health Risk Manag,2014,10:75-87.
[3]Ginsberg MD.Current status of neuroprotection for cerebral ischemia:synoptic overview[J].Stroke,2009,40:S111-114.
[4]张连峰,秦川.小鼠基因工程与医学应用[M].北京:中国协和医科大学出版社,2010:24-25.
[5]Shah ZA1,Namiranian K,Klaus J,et al.Use of an optimized transient occlusion of the middle cerebral artery protocol for the mouse stroke model[J].J Stroke Cerebrovasc Dis,2006,15:133-138.
[6]Wang L,Lu Y,Zhang X,et al.Mindin is a critical mediator of ischemic brain injury in an experimental stroke model[J].Exp Neurol, 2013,247:506-516.
[7]Xia CF,Smith RS Jr,Shen B,et al.Postischemic brain injury is exacerbated in mice lacking the kinin B2 receptor[J].Hypertension, 2006,47:752-761.
[8]Wang L,Lu Y,Guan H,et al.Tumor necrosis factor receptor-associated factor 5 is an essential mediator of ischemic brain infarction [J].J Neurochem,2013,126:400-414.
[9]Wang L,Lu Y,Deng S,et al.SHPS-1 deficiency induces robust neuroprotection against experimental stroke by attenuating oxidative stress[J].J Neurochem,2012,122:834-843.
Establishment and evaluation of a murine cerebral ischemia-reperfusion model.
WANG Lang1,2,LU Yan-yun2, ZHOU Qin3,SHUI Xiao-lan1.1.Department of Cardiology,Renmin Hospital of Wuhan University,Wuhan 430060, Hubei,CHINA;2.Cardiovascular Research Institute of Wuhan University,Wuhan 430060,Hubei,CHINA;3.Department of Neurology,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo establish a murine cerebral ischemia-reperfusion model and a scientific evaluation system for the model,and to evaluate the effect of prolonged ischemia time on ischemia reperfusion injury.MethodsTransient middle cerebral artery occlusion was used for establishing the murine cerebral ischemia-reperfusion model.Neurological score,TTC staining,Evan's blue staining,Tunel staining and immunofluorescence technique were used to compare the infarct volume,neurological deficit,blood brain barrier(BBB)disruption,neuronal apoptosis and oxidative injury between 45 min ischemia and 60 min ischemia.ResultsCompared with 45 min ischemia,60 min ischemia increased infarct volume by 78.21%,neurological score by 31.66%,neuronal apoptosis rate by 44.49%,and significantly exacerbated BBB disruption and oxidative injury.ConclusionStrict operation and rigorous intraoperative monitoring can obtain stable murine ischemia-reperfusion injury model.Prolonged ischemic time led to worsened brain injury.
Cerebral ischemia-reperfusion;Apoptosis;Oxidative stress;Mice
R-332
A
1003—6350(2014)20—2965—05
10.3969/j.issn.1003-6350.2014.20.1168
2014-08-13)
国家自然科学基金(编号:81100230);国家科技支撑项目(编号:2011BAI15B02、2012BAI39B05)
王朗。E-mail:wlang81@gmail.com
