灵仙新苷体外给药对小肠上皮内淋巴细胞功能的调节作用
2014-05-02韩望熊莺马岩李运曼方伟蓉刘丽芳
韩望,熊莺,马岩,李运曼*,方伟蓉,刘丽芳
1南京医科大学附属南京儿童医院药学部,南京 210008;中国药科大学2生理研究室3生药研究室,南京 210009
灵仙新苷体外给药对小肠上皮内淋巴细胞功能的调节作用
韩望1,熊莺2,马岩2,李运曼2*,方伟蓉2,刘丽芳3
1南京医科大学附属南京儿童医院药学部,南京210008;中国药科大学2生理研究室3生药研究室,南京210009
摘要目的:考察灵仙新苷体外给药对大鼠小肠上皮内淋巴细胞(IEL)功能的调节作用,并初步探讨其作用机制。方法:通过体外培养大鼠IEL,测定灵仙新苷对IEL的细胞毒性作用以及ConA、LPS分别诱导的IEL培养上清液中TNF-α及IFN-γ含量。结果:灵仙新苷高浓度组(5.5×10-6mol·L-1)可以显著抑制ConA、LPS分别诱导的IEL培养上清液中TNF-α及IFN-γ的含量。灵仙新苷中(5.5×10-7mol·L-1)、低(5.5×10-8mol·L-1)浓度组对IEL的细胞活性没有显著性影响。结论:灵仙新苷对大鼠小肠上皮内淋巴细胞功能具有较明显的调节作用,机制可能与抑制TNF-α和IFN-γ的水平有关。
关键词灵仙新苷;小肠上皮内淋巴细胞;TNF-α;IFN-γ
灵仙新苷(Clematichinenoside)是威灵仙的一种皂苷提取物,从我国威灵仙药材主流商品的毛茛科植物威灵仙(Clematis chinensisOsbeck.)的干燥根及根茎中提取纯化,纯度大于90%,其结构式如图1所示。威灵仙味辛咸,性温,有微毒,具有祛风除湿、通络止痛之功效,临床上主要用于风湿痹痛、肢体麻木、筋脉挛急、屈伸不利等症。灵仙新苷具有较强的抗炎镇痛作用,可显著改善胶原诱导型关节炎大鼠的足跖肿胀及病理形态,降低血清中的主要细胞炎症因子TNF-α,并显著升高血清中IL-10的含量;可不同程度地抑制滑膜组织中TNF-α、磷脂酰肌醇3-激酶(PI3K)及磷酸化蛋白激酶B(p-Akt)的蛋白表达,降低滑膜组织TNF-α、PI3K和Akt的mRNA含量。其抗炎机制可能与抑制PI3K/Akt–TNF-α信号通路有关[1]。
本文着重考察灵仙新苷体外给药对大鼠小肠上皮内淋巴细胞功能的调节作用,并初步探讨其作用机制。这对于灵仙新苷的新药研发具有重要的理论和实际应用价值。

图1 灵仙新苷结构式
1 材料
1.1药物与试剂
灵仙新苷(由江苏正大天晴药业股份有限公司提供,纯度在90%以上,批号:100731,药物在临用前用蒸馏水配成所需浓度);甲氨蝶呤(methotrexate,MTX)片(上海信谊药厂有限公司,批号:100504,规格:2.5 mg/片,药物在临用前先用二甲基亚砜(DMSO)溶解,再用相应的细胞培养液稀释至所需浓度);雷公藤多苷(tripterygiumglycosides,TP)片(江苏美通制药有限公司产品,批号:110507,规格:10 mg/片,药物在临用前先用DMSO溶解,再用相应的细胞培养液稀释至所需浓度);大鼠TNF-α、IFN-γ Elisa试剂盒(上海依科赛生物制品有限公司,批号分别为ZIZFBZAA01、ZFAGBZAA01)。
1.2仪器
Mikro 22R型高速冷冻离心机(德国Hettich公司);Bio-Rad 680酶联免疫检测仪(英国Bio-Rad公司)。
1.3实验动物
SPF级Wistar大鼠,体重110~130 g,雄性,苏州工业园区爱尔麦特科技有限公司提供,许可证号:SCSK(苏)2009-0001。
2 实验方法
2.1灵仙新苷对伴刀豆球蛋白A(ConA)、脂多糖(LPS)分别诱导的大鼠小肠上皮内淋巴细胞的影响
根据边值条件对热传导方程实施求解始终是数学领域的一个难题。针对工程实际问题,通过函数实现求解基本不可能。基于此,就会用到变分法[1]。
2.1.1大鼠小肠上皮内淋巴细胞的分离[2]取出动物从幽门至回盲部的全部小肠,用含青霉素与链霉素的D-Hank’s液冲洗肠腔,尽量将肠内容物冲洗干净,仔细剥离肠系膜和脂肪组织,用眼科弯剪剪下PP结,置于盛有D-Hank’s液的平皿中,用于PP结内淋巴细胞的分离纯化。沿纵轴剪开小肠,翻转小肠使黏膜面向外置于盛有消化液[1 L D-Hank’s液中加入1 mmol·L-1二硫苏糖醇(DTT)和1 mmol· L-1EDTA]的离心管中,37℃孵育20 min,重复2次,收集2次所得的细胞。将消化液经300目尼龙筛网过滤后,以1000 r·min-1离心5 min,弃去上清液,加入RPMI1640培养液。将细胞重悬于5 mL 40%Percoll,在试管底部轻轻加入4 mL 70%(v/v)Percoll,使两层液体间形成清晰的界面,制成Percoll梯度分离液;以2500 r·min-1离心20 min,收取40% Percoll与70%Percoll界面间的细胞,重复2次,用RPMI1640培养液清洗3次,即为小肠上皮内淋巴细胞(intestine intraepithelial lymphocytes,IEL),并进行台盼蓝染色。
2.1.2灵仙新苷对ConA诱导的大鼠IEL淋巴细胞TNF-α和IFN-γ过度分泌的影响96孔培养板分为空白对照组、模型组、甲氨蝶呤组(2.2×10-7mol· L-1)、雷公藤多苷组(1 μg·mL-1)、灵仙新苷高(5.5× 10-6mol·L-1)、中(5.5×10-7mol·L-1)、低(5.5×10-8mol· L-1)浓度组,每组均设3个复孔。每孔加入新鲜制备的IEL淋巴细胞悬液100 μL。除空白组外,每孔均加入终浓度为5 mg·mL-1的ConA诱导造模。造模后2 h每孔加入50 μL各浓度药物,空白组和模型组加入相同体积的PBS缓冲液。将孔板置于37℃、5% CO2恒温孵箱中培养48 h,然后各孔细胞取上清液备用。
2.1.3灵仙新苷对LPS诱导的大鼠IEL淋巴细胞TNF-α和IFN-γ过度分泌的影响实验方法同“2.1.2”节,除空白组外,每孔均加入终浓度为0.1 μg·mL-1的LPS诱导造模,其余操作同上。
2.2指标检测
2.2.1灵仙新苷对IEL的细胞毒性作用调整IEL淋巴细胞悬液浓度为1×109/L,96孔培养板分为空白对照组、甲氨蝶呤组(2.2×10-7mol·L-1)、雷公藤多苷组(1 μg·mL-1)、灵仙新苷高(5.5×10-6mol·L-1)、中(5.5×10-7mol·L-1)、低(5.5×10-8mol·L-1)浓度组,每组均设3个复孔。每孔加入新鲜制备的IEL淋巴细胞悬液100 μL,然后依次加入相应药物各100 μL,空白组加入同体积的PBS缓冲液。在37℃、5%CO2的培养箱中培养48 h,在培养结束前4 h每孔加入MTT溶液(5 g·L-1)20 μL,重新放入培养箱中继续培养4 h。培养结束后孔板离心后弃去上清液,每孔加入DMSO 150 μL,静置10 min后在酶标仪上于492 nm波长处测定吸光度(A)值。
2.2.2IEL培养上清液中TNF-α和IFN-γ的含量测定参照试剂盒的说明书,取100 μL置于酶联板上,按酶联免疫试剂盒要求测定ConA、LPS分别诱导的大鼠IEL淋巴细胞培养上清液中TNF-α和IFN-γ的含量,用酶标仪于指定波长处测定吸光度(A)值。
2.3统计学处理
3 结果
3.1灵仙新苷对IEL细胞毒性作用的影响
表1 灵仙新苷对IEL细胞毒性作用的影响(±s,n=3)

表1 灵仙新苷对IEL细胞毒性作用的影响(±s,n=3)
注:与空白组相比,*P<0.05,**P<0.01
组别浓度吸光度值空白组—0.326±0.014甲氨蝶呤组2.2×10-7mol·L-10.276±0.011**雷公藤多苷组1 μg·mL-10.298±0.016*灵仙新苷高5.5×10-6mol·L-10.293±0.013*灵仙新苷中5.5×10-7mol·L-10.303±0.014灵仙新苷低5.5×10-8mol·L-10.318±0.014
由表1可见,甲氨蝶呤组吸光度值与空白组相比,极显著降低(P<0.01),对IEL细胞活性具有极显著的抑制作用;雷公藤多苷与灵仙新苷高浓度组的吸光度值均显著低于空白组(P<0.05),提示对IEL细胞活性有显著抑制;灵仙新苷中、低浓度组与空白组相比无显著性差异,对IEL细胞活性没有显著性影响。
3.2灵仙新苷对ConA诱导的IEL上清细胞因子TNF-α及IFN-γ含量的影响
表2 灵仙新苷对ConA诱导的IEL上清细胞因子TNF-α及IFN-γ含量的影响(±s,n=3)

表2 灵仙新苷对ConA诱导的IEL上清细胞因子TNF-α及IFN-γ含量的影响(±s,n=3)
注:与空白组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01
组别IFN-γ(pg·mL-1)空白组43.56±11.25模型组87.93±16.17##灵仙新苷高51.21±11.71*灵仙新苷中70.77±12.64灵仙新苷低75.00±15.03浓度TNF-α(pg·mL-1)—109.80±22.60—205.74±31.12##5.5×10-6mol·L-1128.59±22.43*5.5×10-7mol·L-1159.34±28.835.5×10-8mol·L-1174.26±21.63甲氨蝶呤组雷公藤多苷组49.35±10.34**62.83±13.28*2.2×10-7mol·L-11 μg·mL-1116.96±20.25**133.03±26.09*
由表2可见,模型组ConA诱导的大鼠IEL上清细胞因子TNF-α含量与空白组相比,极显著升高(P<0.01);甲氨蝶呤组ConA诱导的IEL上清细胞因子TNF-α含量与模型组相比,极显著降低(P<0.01);雷公藤多苷与灵仙新苷高浓度组的上清TNF-α含量均显著低于模型组(P<0.05);灵仙新苷中、低浓度组与模型组相比无显著性差异。
模型组ConA诱导的大鼠IEL上清细胞因子IFN-γ含量与空白组相比,极显著升高(P<0.01);甲氨蝶呤组ConA诱导的IEL上清细胞因子IFN-γ含量与模型组相比,极显著降低(P<0.01);雷公藤多苷与灵仙新苷高浓度组的上清IFN-γ含量均显著低于模型组(P<0.05);灵仙新苷中、低浓度组与模型组相比无显著性差异。
3.3灵仙新苷对LPS诱导的IEL上清细胞因子TNF-α及IFN-γ含量的影响
表3 灵仙新苷对LPS诱导的IEL上清细胞因子TNF-α及IFN-γ含量的影响(±s,n=3)
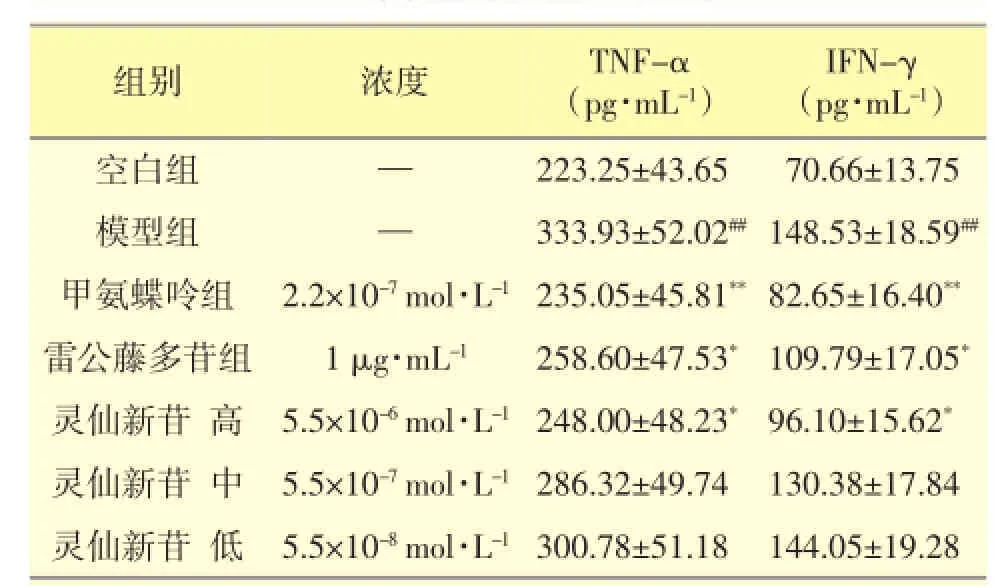
表3 灵仙新苷对LPS诱导的IEL上清细胞因子TNF-α及IFN-γ含量的影响(±s,n=3)
注:与空白组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01
组别IFN-γ(pg·mL-1)空白组70.66±13.75模型组148.53±18.59##灵仙新苷高96.10±15.62*灵仙新苷中130.38±17.84灵仙新苷低144.05±19.28浓度TNF-α(pg·mL-1)—223.25±43.65—333.93±52.02##5.5×10-6mol·L-1248.00±48.23*5.5×10-7mol·L-1286.32±49.745.5×10-8mol·L-1300.78±51.18甲氨蝶呤组雷公藤多苷组82.65±16.40**109.79±17.05*2.2×10-7mol·L-11 μg·mL-1235.05±45.81**258.60±47.53*
由表3可见,模型组LPS诱导的大鼠IEL上清细胞因子TNF-α含量与空白组相比,极显著升高(P<0.01);甲氨蝶呤组LPS诱导的IEL上清细胞因子TNF-α含量与模型组相比,极显著降低(P<0.01);雷公藤多苷与灵仙新苷高浓度组的上清TNF-α含量均显著低于模型组(P<0.05);灵仙新苷中、低浓度组与模型组相比无显著性差异。
模型组LPS诱导的大鼠IEL上清细胞因子IFN-γ含量与空白组相比,极显著升高(P<0.01);甲氨蝶呤组LPS诱导的IEL上清细胞因子IFN-γ含量与模型组相比,极显著降低(P<0.01);雷公藤多苷与灵仙新苷高浓度组的上清IFN-γ含量均显著低于模型组(P<0.05);灵仙新苷中、低浓度组与模型组相比无显著性差异。
4 讨论
肠道黏膜处于沟通机体内外环境的重要位置,具有消化、吸收、分泌和防御等重要功能,是机体免疫系统的重要组成部分。肠道黏膜具有重要的免疫功能,如在抗原刺激后产生分泌型IgA及介导口服抗原诱导的免疫耐受。胶原诱导型关节炎模型是研究自身免疫性疾病的动物模型,具有很多免疫异常的表现,而若干种炎性细胞因子等体液免疫因素在其发病过程中起重要作用。TNF-α可上调细胞内皮黏附分子的表达,加重CIA。关于IFN-γ对CIA的影响很多研究显示,IFN-γ对Th1型细胞具有正调节作用[3],可视为CIA严重程度的指标。近年来研究表明,如果抗原的剂量足够大则可能导致体内抗原特异性的CD4+T细胞凋亡,引起克隆清除或克隆无反应性[4]。
本实验结果显示,灵仙新苷在与IEL共培养后,TNF-α和IFN-γ的水平均有不同程度的降低,原因可能与下列因素有关:CD4+T细胞活化,但Th2型细胞的活化程度超过Th1型细胞,因而IL-4、IL-10、TGF-β等抑制因子的分泌增加,而导致Th1型细胞受到抑制,TNF-α和IFN-γ的水平下降[5-6]。此外P55肿瘤坏死因子受体(TNFR)和CC趋化因子2(CCL2)及其受体活化,导致CD4+T细胞凋亡,使TNF-α和IFN-γ的水平下降[7]。
IEL分泌TNF-α、IFN-γ水平的减少,提示Th1型细胞及NK细胞免疫活性受到抑制[8-9],因此灵仙新苷的应用,有可能为自身免疫性疾病的治疗提供新的思路。本部分实验为后续研究灵仙新苷体外给药对肠道粘膜免疫的调节功能和作用机制提供了良好的思路,我们将深入探讨灵仙新苷对相应免疫细胞的影响。
参考文献
[1] Han W,Xiong Y,Li YM,et al.Anti-arthritic effects of clematichinenoside(AR-6)on PI3K/Akt signaling pathway and TNF-α associated with collagen-induced arthritis[J].PharmBiol,2013,51(1):13-22.
[2] Sato A,Iwasaki A.Peyer′s patch dendritic cells as regulators of mucosal adaptive immunity[J].Cell Mol Life Sci,2005,62(12):1333-8.
[3] Qin Q,Chang Y,Wang D,et al.TACI-Ig induces immune balance of Th cells in MLN via BLyS/APRIL-receptors signaling in rats with adjuvant-induced arthritis[J].International Immunopharmacology,2011,11 (9):2167-75.
[4] TakanoF,Yamaguchi M,Takada S,et al.Capsicumethanol extracts and capsaicin enhance interleukin-2 and interferon-gamma production in cultured murine Peyer's patch cells ex vivo[J].Life Sciences,2007,80 (1):1553-63.
[5] Zhao H,Luo Y,Lu C,et al.Enteric mucosal immune response might trigger the immunomodulation activity of Ganoderma lucidum polysaccharide in mice[J].Planta Med,2010,76(3):223-7.
[6] Ebert EC.Interleukin 21 up-regulates perforin-mediated cytotoxic activity of human intra-epithelial lymphocytes[J].Immunology,2009,127(2):206-15.
[7] Liu Z,Yadav PK,Xu X,et al.The increased expression of IL-23 in inflammatory bowel disease promotes intraepithelial and lamina propria lymphocyte inflammatory responses and cytotoxicity[J].J Leukoc Biol,2011, 89(4):597-606.
[8] Ebert EC,Panja A,Praveen R.Human intestinal intraepithelial lymphocytes and epithelial cells coinduce interleukin-8 production through the CD2-CD58 interaction[J].Am J Physiol Gastrointest Liver Physiol, 2009,296(3):G671-7.
[9] Takayanagi Y,Osawa S,Ikuma M,et al.Norepinephrine suppresses IFN-γ and TNF-α production by murine intestinal intraepithelial lymphocytes via the β1adrenoceptor[J].J Neuroimmunol,2012,245(1-2):66-74.
中图分类号R965.1;R967
文献标志码A
文章编号1673-7806(2014)05-401-04
作者简介韩望,女,硕士,药师E-mail:hw.chloe@hotmail.com
*通讯作者李运曼,女,教授,博士生导师,主要从事药理研究Tel:(025)83271173E-mail:yucaoren@sina.com
收稿日期2014-05-06修回日期2014-05-20
Modulating Effects of Clematichinenoside on Intestine Intraepithelial Lymphocytes of Rats
HAN Wang1,XIONG Ying2,MA Yan2,LI Yun-man2*,FANG Wei-rong2,LIU Li-fang3
1Department of Pharmacy,Nanjing Children's Hospital Affiliated to Nanjing Medical University,Nanjing 210008,China;2Department of Physiology,3Department of Pharmacognosy,China Pharmaceutical University, Nanjing 210009,China
ABSTRACTObjective:To explore the modulating effects of clematichinenoside on the cultureed intestine intraepithelial lymphocytes(IEL)of rats.Methods:The cytotoxicity of clematichinenoside was examined in the cultured intestine intraepithelial lymphocytes of ratsin vitro,and the secretion of TNF-α and IFN-γ in the supernatant of IELs were also detected.Results:Clematichinenoside reduced the levels of TNF-α and IFN-γ secreted by IELs,and it had no significant effect on the cell viability of IEL.Conclusion:The modulating effects of clematichinenoside on intestine intraepithelial lymphocytes in rats may relate to the inhibition of TNF-α and IFN-γ.
KEY WORDSClematichinenoside;IEL;TNF-α;IFN-γ
