南高丛蓝莓奥尼尔快速增殖的研究
2014-04-29陈冰心刘奇畅邓喜艳黄雄军刘如石邱义兰
陈冰心 刘奇畅 邓喜艳 黄雄军 刘如石 邱义兰


摘要:为了探讨南高丛蓝莓奥尼尔快速增殖的条件,以奥尼尔无菌苗幼嫩茎段为试验材料,对增殖培养和叶片再生条件进行研究。结果表明,WPM(改良)+0.5~1.0mg/L ZT的增殖培养基能使增殖系数提高到5以上,且丛生苗生长健壮和生长速度快;降低盐浓度和添加玉米素是诱导叶片再生的关键:未切全叶的再生诱导优于切断叶片,前者在1/2WPM+2.0mg/L ZT的培养基中的再生率高达71.4%,且主要形成具有2~4个芽的簇生苗。因此,将最佳的增殖培养和叶片再生相结合,使南高丛蓝莓奥尼尔可持续快速增殖,为进一步获得优良的奥尼尔种苗及其工厂化生产奠定重要基础。
关键词:南高丛蓝莓;奥尼尔;增殖;叶片再生
中图分类号:S663.9
文献标识码:A
文章编号:1007-7847(2014)03-0246-04
蓝莓属杜鹃花科(Ericaeae)越桔亚科(Vaccin-ioideae)越橘属(Vaccinium)。蓝莓果实富含花青素、不饱和脂肪酸、鞣酸及钙、钾、锌、铁等元素,B族维生素含量尤为突出,被国际粮农组织列为五大健康食品之一,堪称世界水果之王,是近几年来发展最迅速的集营养与保健于一身的第3代果树品种[1~4]。近几年来,蓝莓鲜果和加工品风靡欧美等发达国家市场,虽然价格昂贵但仍供不应求,其传统的北美产区的产量已远不能满足本地和世界市场的需求,为此世界上其他国家已先后引种。我国有着可以生产蓝莓的广阔天地,南方红黄壤土地面积达2179600km2,占全国土地面积的22%,其中2040000km2土壤属酸性,而且很大一部分pH<5.0[5],由于土壤酸度大和肥力不足,农业生产水平较低。蓝莓特别适合酸性和强酸性土壤,正是红黄壤地区脱贫致富的理想作物。
随着我国南方对蓝莓引种栽培规模日益扩大,优良种苗需求量急剧增加,种苗生产供不应求。组织培养凭借其无性繁殖的独特优势,可以迅速去除病毒和更新品种,保留品种的本来特性,变异性小,并且可在较小空间内和较短时间内快速地获得大量无性系组培苗,成为蓝莓脱毒和快速繁殖的主要途径。到目前为止,国内外对蓝莓组织培养进行了大量的研究,但大多尚处于微繁阶段,对离体诱导不定芽再生植株的报道较少。有关蓝莓离体叶片再生的研究表明,影响蓝莓离体器官再生的影响因素很多,其中植物激素起决定性的作用,蓝莓叶片再生受基因型的限制,不同蓝莓品种再生条件及再生频率存在差异[6~10]。奥尼尔(O'Neal)为南高丛蓝莓的代表品种之一,果实大粒、蒂痕小、果粉较少、果肉质硬耐储运、丰产、香味浓,在南高丛蓝莓品种中香味评价较高,适宜在我国长江流域大部分地区种植。有关奥尼尔离体叶片再生及快速繁殖的研究尚未见报道。因此,我们将增殖培养和叶片再生条件优化,获得奥尼尔快速持续增殖的关键技术,为建立适宜于蓝莓奥尼尔苗木的工厂化育苗和商品基地建设奠定坚实基础。
1材料与方法
1.1材料
植物材料为智博生物科技公司种植园种植的南高从蓝莓品种奥尼尔(O'Neal)无菌苗。
1.2方法
1.2.1增殖培养
将无菌苗切成单芽茎段后转接于不同激素浓度的WPM[11](改良)培养基(各处理激素浓度组合见表1)+20g/L蔗糖+8.8g/L日产琼脂粉的增殖培养基(pH=5.2)中进行光照培养,培养40d后观察芽的生长状况和计算增殖系数。光照培养条件为:温度25+2℃,光强2500Lx,光周期16h光照/8h黑暗,下同。WPM培养基具体改良方法:以Ca(NO3)2·4H2O、KNO3分别代替原WPM培养基中的CaCl2、K2SO4。增殖系数=增殖芽总数/接种单芽茎段总数。
1.2.2叶片诱导再生
选取增殖培养的无菌苗植株第3~6节叶片,3种外植体包括未切全叶、离叶尖端的1/3处横切叶片形成的叶尖端叶片和叶柄端叶片,均按照背面朝下分开放置接种于不同盐浓度(各处理盐浓度见表2)和不同ZT浓度(各处理ZT浓度见表3)的WPS(改良)培养基+20g/L蔗糖+9g/L琼脂粉(pH=5.2)的培养瓶内,每瓶各10片左右,每个处理重复12瓶。先进行20d的暗培养(温度25±2℃),随后进行光照培养。30d后统计叶片出芽率及每个叶片相应形成的苗数。
2结果与分析
2.1增殖培养
将无菌苗切成单芽茎段转接到不同激素浓度的增殖培养基上进行优化,结果见表1。从表1可以看出,ZT的增殖效果明显优于6-BA和TDZ,且不定芽的发生率与培养基中的ZT浓度有密切的关系。当ZT质量浓度为0.5mg/L时,培养10d左右在茎基部产生黄绿色的愈伤组织,叶节处出现丛生芽,28d后增殖系数达到5.02,且主要为主枝芽,丛生芽粗壮,生长势头好,呈鲜嫩状。当ZT质量浓度升高到1mg/L时,开始生长和分化的时间与ZT 0.5mg/L时相差不大,其增殖系数稍有所增加。当ZT质量浓度等于或大于2mg/L时,再生苗开始生长和分化现象提前,多数分化出来的新梢枝上出现2次分枝,增殖系数达到10左右,由于侧枝芽多使苗长势较弱易出现玻璃化苗现象。WPM与其它激素组合效果均差于WPM+ZT组合。使用6-BA时,外植体不萌芽生长,生长停滞。使用TDZ时,10d后在外植体基部形成少量愈伤,虽然能萌芽,但萌芽率低且生长缓慢。因此,增殖培养基以WPM+0.5~1.0mg/L ZT为适宜。
2.2叶片诱导再生
2.2.1盐浓度对叶片再生诱导的影响
离叶尖1/3处横切叶片成叶尖端部分和叶柄端部分,以及未切全叶,均按照叶片背面朝下接种于含有不同盐浓度的培养瓶内,30d后统计叶片再生率,结果见表2。从表2中可以看出,高盐浓度不利于叶片的再生,其诱导再生苗率仅为0%~2.7%。将大量元素浓度减少一半,能明显促进叶片的再生,叶片诱导再生苗率提高至23.1%~70.9%。在叶片不同部位中,叶尖端的再生苗诱导率最低,叶柄端居中,未切全叶的诱导率最高。
2.2.2不同激素浓度对叶片诱导再生的影响
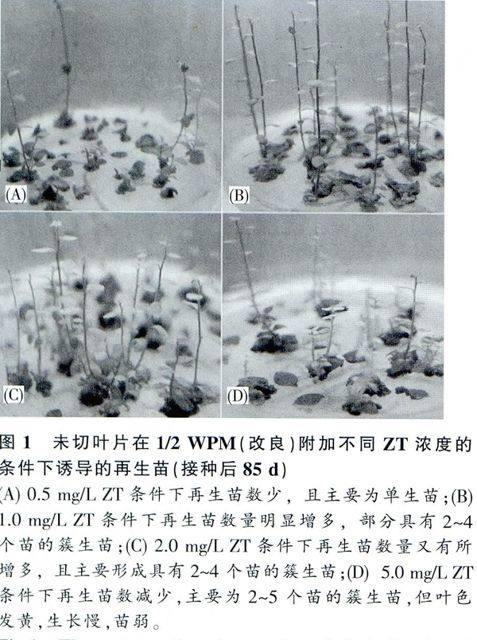
不同激素浓度对叶片不同部位的再生苗诱导效果不同。TDZ不能诱导叶片形成再生苗,叶片培养10d后在切口处形成愈伤组织,随着培养时间的延长,愈伤组织慢慢褐化,未见再生苗形成。ZT对叶片再生苗诱导效果明显优于TDZ,不定芽的发生率与培养基中的ZT有密切的关系。不同部位叶片的再生苗诱导率存在明显差异,叶尖端的诱导率最低,叶柄端的居中,全叶的诱导率最高(表3)。ZT对叶片再生苗诱导存在明显的浓度效应,低浓度ZT主要诱导形成单生苗,而高浓度ZT有利于簇生苗的形成(表3,图1A~D)。叶尖端叶片诱导的再生苗主要形成于切口处,叶柄端和全叶诱导的再生苗主要形成于叶柄一侧。叶尖端在0.5mg/LZT时诱导率为0,随着ZT浓度的升高诱导率逐渐增加,在5mg/L ZT时的诱导率达到32.3%;叶柄端和全叶的诱导率均随ZT质量浓度的升高逐渐增加,在2.0mg/L ZT时诱导率均达到最高,叶柄端和全叶的再生苗诱导率分别为54.3%和71.4%,5mg/LZT时的诱导率却均下降(表3,图1A~D)。综合以上结果,选用全叶进行叶片再生苗诱导,其再生苗诱导的最佳ZT质量浓度为2.0mg/L。
3讨论
已有研究表明,蓝莓快繁的培养基以WPM的效果最好[6],且在芽的诱导和增殖中细胞分裂素的作用至关重要[7,10]。ZT是一种高活力的细胞分裂素,具有打破植株顶端优势、促进腋芽萌发、诱导不定芽形成的作用。因此,我们主要采用了WPM培养基,重点探讨了ZT的效应。本研究表明,利用0.5mg/L ZT进行增殖培养,增殖系数达到5以上,且丛生芽生长健壮,生长速度快,通过2~3次继代,其增殖系数可达50—60;1mg/L ZT的增殖系数稍高于0.5mg/L ZT; ZT质量浓度大于等于2mg/L时增殖系数高达10倍左右,丛生苗太多生长速度慢,同时玻璃化现象的出现使有效苗数减少。由于ZT价格贵,从生产成本、增殖系数和苗的生长状况进行综合考虑,0.5mg/L ZT的增殖效果最佳。
叶片离体培养的相关研究证实了蓝莓可通过器官发生途径诱导再生植株[12~14]。本研究发现高丛蓝莓奥尼尔叶片在高盐浓度和单独添加TDZ均不能诱导植株再生,降低盐浓度和添加ZT是诱导叶片再生的关键因素;未切叶的诱导率优于切断叶,在1/2 WPM+2.0mg/L ZT条件下完整叶的再生率最佳,高达71.4%,且主要形成具有2~4个芽的簇生苗。该结果与兔眼蓝莓[16]和高丛蓝莓[8,14~16,18]有关的诱导叶片植株再生的条件不同,表明蓝莓叶片离体再生植株通过器官发生途径可能因培养体系、品种等的不同而存在差异。本研究建立了高丛蓝莓奥尼尔优良的继代增殖培养体系和叶片再生体系,使之能陕速持续增殖,其增殖系数非常可观,远远高于前人在高丛蓝莓增殖研究中的结果[8,14~19],为进一步建立适宜于蓝莓奥尼尔苗木的工厂化育苗和商品基地建设奠定坚实基础。
参考文献(References):
[1]CONNOR A M,LUBY J J,TONC C B S.Variability in antiox-idant activity in blueberry and correlations among diffferentantioxidant assays[J]. Journal of the American Socifety for Horti-cultural Science, 2002, 127(2):238-244.
[2]CONNOR A M,LUBY J J,TONC C B S,et al.Genotypic andenvironmental variation in antioxidant activity, total phenoliccontent, and anthocyanin content among blueberry cultivars[J].Journal of the American Society for Horticultural Science,2002, 127(1):89-97.
[3]LYRENE P M,VORSA N,BALLINGTO N R.Polyploidy andsexual polyploidization in the genus Vaccinium[J]. Euphytica,2003, 133(1):27-36.
[4]HANCOCK J F,LYRENE P,FINN C E,et al.Blueberries andcranberries. In:Hancock J F(ed) Temperate Fruit Crop Breed—ing[M]. New York: Springer-Verlag Press, 2008.115-149.
[5]顾姻,王传永,吴文龙,等.美国蓝浆果的引种[J].植物资源与环境学报(GU Yin, WANG Chuan-yong, WU Wen-long,etal. Introduction of American blueberries[J]. Journal of PlantResources and Environment), 1998, 7(4):33-37.
[6]WOLFE D E,ECK P,CHIN C.Evaluation of seven media formicropropagation of highbush blueherry[J]. Hortscience, 1983.18(6):703-705.
[7]SHARON G B,CHEE K.CHIN C.Regeneration Of blueberryplantlets from leaf segment[J]. Hortscience, 1988, 23(4):763-766.
[8]陶建敏,耿其芳,庄智敏,等蓝浆果叶片高效再生体系的建立[J].西北植物学报(TAO Jian-min, GENG Qi-fang, ZhUANGZhi-min, et al.Construction of the high-efficiency regenerationsystem of blueberry with its Ieaves[J]. Acta Botanica Boreali-Oc-cidentalia Sinica), 2006, 26 (3):610-614.
[9]孙阳,刘庆忠.3莓品种叶片离体再生及生根技术研究[J].安徽农业科学(SUN Yang, LIU Qing-zhong. Studies on theregeneration of leaf in vitro and rooting in three blueberry cul-tivars[J]. Journal of Anhui Agricultural Sciences), 2008, 36(11):4411-4412.
[10]LIU C, CALLOW P, ROWLAND L J, et al. Adventitious shootregeneration from leaf explants of southern highbush blueberrycultivars[J]. Plant Cell Tissue and Organ Cultural, 2010, 103(1):137-144.
[11]LLOYD E, MCCOWN B H. Commercially feasible microprop-agation of mountain laurel, Kalmia latifolia, by use of shoot tipculture[C]// Combined Proceedings of Intemational Plant Prop-agalors's Society, 1980, 30:421-427.
[12]SONG G Q, SINK K C. Agrobacterium tumefaciens-mediatedtransformation of blueberry (Vaccinium corymbosum L,) [J].Plant Cell Reports. 2004, 23(7):475-484.
[13]CAO X, FORDHAM I, DOUGLASS L, et al. Sucrose level in-fluences micropropagation and gene delivery into leaves fromin vitro propagated highbush blueberry shoots[J]. Plant Cell Tis-sue and Organ Cultural, 2003, 75(3):255-259.
[14]CAO X, HAMMERSCHLAG F A. Improved shoot organogene-sis from leaf explants of highbush blueberry[J]. Hortscience, 2000(5),35:945-947.
[15]CAO X,HAMMERSCHLAG F A,DOUGLASS L.A two steppretreatment significantly enhances shoot organogenesis fromleaf explants of highbush blueherry cv. Bluecrop[J]. Hortscience,2002,37(5):819-821.
[16]ROWLAND L J,OCDEN E L.Use of a cytokinin conjugatefor efficient shoot regeneration from leaf sections of highbushblueberry[J]. Hortscience, 1992, 27(10):1127-1129.
[17]邱义兰,陈冰心,邓喜艳,等,兔眼蓝莓组织培育苗高效快繁技术[J]湖南师范大学自然科学学报(QIU Yi-lan, CHENBing-xin, DENG Xi-yan,et al.Efficient propagation technology of tissue culture seedlings of Vaccinium Ashei Reade[J].Journal of Natural science of Hunan Normal University), 2013,36(1):68-74.
[18]崔广荣,陆峰,曹华龙,等.蓝莓离体叶片胚状体高效发生及其组织学观察[J]激光生物学报(CUI Guang-rong, LU Feng,CAO Hua-long,et al.High efficient somatic embryogenesis onleaf explants of blueberry in vitro culture and histological ob-servations[J]. Acta Laser Biology Sincica), 2008, 17(5):599-607.
[19]王淑珍,来文国,周历萍,等,南高丛蓝莓组培再生技术研究[J].现代农业科技(WANG Shu-zhen, LEI Wen-guo, ZHOU Li-ping,et al.Studies of regeneration technique of tissue cultureon southern high blueberry[J]. Modern Agricultural Science andTechnology), 2011, (21):119-120.
