麦氏安瘿蜂体内侵染Wolbachia的WO噬菌体的检测及其orf7基因序列分析
2014-04-29苏成元杨筱慧朱道弘
苏成元 杨筱慧 朱道弘

摘要:Wolbachia为节肢动物等的细胞质共生细菌,能对宿主的繁殖模式进行调控,包括诱导胞质不亲和、孤雌生殖、雌性化及雄性致死。WO噬菌体是一类侵染节肢动物体内Wolbachia的细菌病毒。为检测麦氏安瘿蜂Wolbachia是否被WO噬菌体侵染,本研究使用WO噬菌体的orf7基因引物,对信阳、六安及长沙3种群的WO噬菌体进行了PCR检测。结果显示,3种群的雌、雄虫体内的Wolbachia均有WO噬菌体的侵染,感染率为100%。获得的3种群麦氏安瘿蜂Wolbachia的WO噬菌体orf7基因序列均为371bp,序列完全一致。其序列与粉斑螟Ephestia cautella的wECau B3-1和wCauA5-1株系、反颚茧蜂Asobara tabida的wAtabA3-3株系的一致性最高,在NJ和ML系统树中,均聚合在同一分支,属于WO噬菌体的第Ⅲ大群。
关键词:麦氏安瘿蜂;Wolbachia;WO噬菌体;orf7基因;系统发育关系
中图分类号:Q968
文献标识码:A
文章编号:1007-7847(2014)03-0227-05
沃尔巴克氏体Wolbachia是一类母系遗传的细胞质共生菌,属于原核生物界细菌门,变形菌纲的α亚纲,立克次氏体目,立克次氏体科,Wol-bachia族,Wolbachia属[1]。先前基于单一基因序列,将Wolbachia分为A、B、C、D、E、F、G和H8个群(group)[2],最近也用多位点分型对其加以了验证[3]。研究得较多的是A、B大群和C、D大群,前者主要感染节肢动物[4],后者主要感染丝状线虫[5]。估计超过17%的节肢动物、几乎全部的丝状线虫都感染了Wolbachia[6~8]。Wolbachia能导致多种的宿主表现型,即在线虫类中表现为互利共生,而在节肢动物中则表现为对宿主生殖的调控。Wol-bachia对节肢动物宿主的生殖调控包括:诱导宿主胞质不亲和(cytoplasmic incompatibility,CI)[9]、孤雌生殖(parthenogenesis induction,PI)[10]、雌性化(feminization of genetic males)[1l]及雄性致死(malekilling,MK)[12]。此外,还发现Wolbachia对某些膜翅目昆虫的卵巢成熟有促进作用[13]。但也有一些Wolbachia种群并不导致宿主的生殖异常[14]。
20世纪70年代末在Culex pipiens体内检测到WO类似元件的存在[15],Masui等首次在Teleo-gryllus taiwanemma感染的Wolbachia中发现了WO噬菌体[16]。经噬菌体衣壳蛋白orf7基因的PCR检测,发现超过89%的节肢动物Wolbachia感染了WO噬菌体[17.18]。由于现在广泛使用的orf7基因的引物还不是足够的保守,不能扩增所有的WO噬菌体类型,所以WO噬菌体的实际侵染率可能更高。如利用orf7基因的PCR扩增,仅发现Wolbachia wRi株系的单一WO噬菌体感染[18],但对其全基因测序则发现共含3种噬菌体片段[19]。另一方面,在丝状线虫的Wolbachia种群中尚未检测到WO噬菌体的感染[18]。二十面体结构的WO噬菌体粒子已经在一些感染Wolbachia的节肢动物中成功纯化,通过透射电镜观察,可以发现WO噬菌体头部的尺寸约为20~40nm,偶尔可见具备类似于T2噬菌体的蛋白质尾部[20,21]。最新的研究表明,WO噬菌体染色体为环状,其复制类型类似于λ噬菌体[22]。目前,将WO噬菌体分为WO-A和WO-B两种类型[23]。利用现有orf7基因引物,仅能扩增到WO-B,基于其基因序列,可将WO-B划分为3个大群( group)[17]。
瘿蜂科为瘿蜂总科(Cynipoidea)中的植食性类群,一般于为害部位形成虫瘿,已知约l400种,可划分为两个亚科,即古瘿蜂亚科Hodiernocynip-lnae和瘿蜂亚科Cynipinae,瘿蜂亚科包含6个族,即栎瘿蜂族Cynipini、客瘿蜂族Synergini、豆瘿蜂族Eschatocerin、蔷薇瘿蜂族Diplolepidini、槭瘿蜂族Pediaspidili及草瘿蜂族Aylacinj[24,25]。已证实草瘿蜂族、蔷薇瘿蜂族、栎瘿蜂族和客瘿蜂族的部分种类有Wolbachia的感染[26~29]。麦氏安瘿蜂Andricus mairei Kieffer属于瘿蜂亚科瘿蜂族(Cynip-ini),寄主为短柄袍栎QMercus glandulifera var. bre-vipetiolata Nakai,于春季在寄主的枝条上形成虫瘿,杨筱慧等证实其具Wolbachia感染,感染的Wolbachia属于A大群[30]。本研究于河南信阳、安徽六安及湖南长沙采集了麦氏安瘿蜂虫瘿,并获得羽化成虫。利用WO噬菌体的orf7基因特异性引物,通过PCR法扩增了其基因片段,测定了目的基因片段的DNA序列,证实了麦氏安瘿蜂体内共生的Wolbachia具WO噬菌体侵染。通过与已知昆虫种类的orf7基因序列的一致性比对,构建了系统发育树,确定了其WO噬菌体的进化地位。
1材料与方法
1.1供试样品的采集
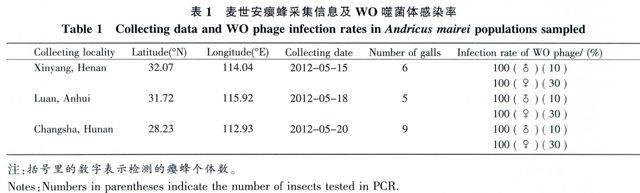
麦氏安瘿蜂的虫瘿于2012年5月分别采集自河南信阳、安徽六安和湖南长沙,采集信息见表1。虫瘿寄主为短柄袍栎Quercus glandulifera var.brevipetiolata Nakai。采集的虫瘿饲养于常温条件,待成虫羽化后以无水乙醇浸泡,-40℃条件备用。
1.2总DNA提取
取麦氏安瘿蜂不同地理种群的雌成虫各30头、雄成虫各10头,用超纯水洗涤2次后,分别放置到预先装有100μL STE缓冲液的离心管中。为方便捣碎,将装有样本的离心管置于-20℃冰箱中冷冻25min,充分捣碎后加入10μL的10% SDS缓冲液,继续研磨1min,加入蛋白酶K(20mg/mL)2μL,充分混匀后56℃水浴2h。加入等体积的酚氯仿异戊醇,充分混匀,5000r/min离心10min,取上清液,重复离心2次。在第2次取得的上清液中加入10μL的醋酸钠混匀,再加250μL的冰无水乙醇于-20℃过夜。4℃ 14000r/min离心20min,弃上清液。加200μL 75%冷乙醇洗涤,离心弃上清液。待其干燥后加入50μL的TE缓冲液溶解,置于4℃保存。
1.3WO的orf7基因片段的PCR扩增及检测
扩增WO噬菌体orf7基因(WO噬菌体编码衣壳蛋白基因)的特异性引物序列是:WO-F:5'-CCCACATGACCAATGACGTCTG-3'和WO-R:5'-CGTTCGCTCTGCAAGTAACTCCATTAAAAC-3',PCR反应体系为25μL包括:14.8μL H2O,2.5μLlOxbuffer,2μL dNTPs,2.5μL MgCl2(25mmol/L),0.2μL Taq DNA polymerase(lU),上下游引物各0.5μL和2μL DNA模板。PCR反应程序:94℃3min;94℃ 30s,66℃ 30s,72℃ 30s,30个循环;最后72℃延伸5min。
取扩增产物5μL点样于1.0%的琼脂糖凝胶,置于o.5xTBE缓冲液中电泳,在70V条件下电泳45min。电泳完成后用溴化乙锭染色,凝胶成像系统检测。
1.4orf7基因片段的测序及分析
将目的基因片段的PCR产物回收、纯化,委托上海英骏生物技术有限公司进行双向测序。从NCBI网站下载其他昆虫WO噬菌体的orf7基因序列,并利用Blast进行一致性比较。使用Clustal X2.0软件将这些序列进行完全排列。最后将排列好的基因序列数据输入MEGA5.0软件,根据Kimu-ra's 2-parameter模型计算遗传距离,参照Model-Test 3.7最优进化模型设定Gamma参数,并进行1000次自导复制,使用邻位相连法(neighbor-joining method)构建NJ系统树。
2结果与分析
2.1麦氏安瘿蜂Wolbachia的WO噬菌体的感染率
使用编码衣壳蛋白基因orf7的引物WO-F和WO-R,检测了WO噬菌体在麦氏安瘿蜂信阳、六安和长沙种群Wolbachia中的感染。各地理种群分别检测了雌成虫30个体、雄成虫10个体,均获得了长度约为400的基因片段,且三地理种群的感染率均为100%,证实了WO噬菌体在麦世安瘿蜂Wolbachia中的感染(表1)。
2.2麦氏安瘿蜂与其他昆虫Wolbachia的WO噬菌体orf7基因的序列一致性
检测的信阳、六安和长沙种群麦氏安瘿蜂Wolbachia的WO噬菌体,均获得了371bp的相同orf7基因片段,已提交GenBank注册,登录号为KJ609514。由于麦氏安瘿蜂Wolbachia属于A大群,本文将获得WO噬菌体命名为wAmaiAl-l株系。使用NCBI网站的Blast工具,对麦氏安瘿蜂及GenBank已登录的其他代表性昆虫种类的Wolbachia的WO噬菌体orf7基因序列进行了一致性分析(表2)。wAmaiAl-l株系与其他昆虫的Wolbachia的WO噬菌体orf7基因一致性介于77%~99%之间,与粉斑螟Ephestia cautella的wECauA5一l株系、反颚茧蜂A.sobara tabida的wAtabA3-3株系等的orf7基因序列的一致性最高,达99%,与丽蝇蛹集金小蜂Nasonia vitripennis的wNvitBl-l和wNvitA4-1株系的一致性最低,为77%。
2.3麦氏安瘿蜂与其他昆虫Wolbachia的WO噬菌体系统树的构建
基于orf7基因序列,分别使用NJ法和ML法构建了麦氏安瘿蜂与其他昆虫WO噬菌体的系统发育树(图1、2)。获得的NJ和ML系统树除一些小的分支存在细微差异之外,基本一致。麦氏安瘿蜂Wolbachia所感染的WO噬菌体属于第Ⅲ大群,与粉斑螟Ephestia cautella的wECauB3—1和wCauA5-1株系、反颚茧蜂Asobara tabida的wAtabA3-3株系聚合在同一分支。
在进行序列比对时,可见三大群之间的序列差异性存在区域特异性,I大群主要在序列的3'端存在差异,而Ⅱ和Ⅲ大群主要在序列的5'端存在差异。按Jukes和Cantor的方法,计算了不同株系间orf7基因的序列差异性,三大群之间orf7基因的序列差异性明显高于群内:I和Ⅱ大群为20.6%、Ⅱ和Ⅲ为18.4%、I和Ⅲ为30.0%;I~Ⅲ大群内的序列差异性分别为6.8%、8.O%和4.4%。
3讨论
在独立生活的细菌中,噬菌体元件往往能占其基因总量的lo%~20%,而专性的细胞质共生菌往往保持最为简洁的基因组,仅包括一些基本的功能基因,这可能是由于细胞质共生菌能从宿主细胞获得大多数的必需品而不需自身合成[31,32]。因此,通常认为细胞质共生菌缺乏噬菌体元件[33,34]。但是,通过对Wolbachia专性噬菌体WO的PCR检测,以及近几年对Wolbachia全基因组的测序分析,均证实了Wolbachia中噬菌体元件的存在[17~19,23]。并且,WO噬菌体的丰度大,超过89%的节肢动物Wolbachia均有其侵染[35,36]。在膜翅目昆虫中,除几种赤眼蜂Wolbachia中未发现之外,其他种类的Wolbachia中均检测到了WO噬菌体的感染,且个体感染率多为100%[17]。Wolbachia能对节肢动物的生殖方式进行调控,但其调控机制尚不清楚。最近的研究发现,WO噬菌体所携带的锚蛋白基因(ankyrin repeat-encoding genes)与尖音库蚊Culex pipiens的胞质不亲和有关[37]。一些学者因而推测WO噬菌体可能在Wolbachia调控节肢动物的生殖之中,扮演一种调节者的角色。换言之,WO噬菌体或许携带生殖调控的关键基因[17,19]。节肢动物-Wolbachia-WO噬菌体三者间的相互关系,确实是令人感兴趣的问题。
本研究通过对WO噬菌体衣壳蛋白基因orf7的PCR扩增,证实了麦氏安瘿蜂Wolbachia中WO噬菌体的感染,信阳、六安和长沙种群的感染率均为100%,获得的3种群麦氏安瘿蜂Wolbachia的WO噬菌体orf7基因序列完全一致。其序列与粉斑螟Ephestiacautella的wECauB3-1和wCauA5-l株系、反颚茧蜂Asobara tabida的wAtabA3-3株系的一致性最高,在NJ和ML系统树中,均聚合在同一分支。为进一步探讨瘿蜂-Wolbachia-WO噬菌体的互作关系提供了基础。
参考文献( References):
[1]WERREN J H.Biology of Wolbachia[J]. Annual Review of En-tomology, 1997, 42:587-609
[2]WERREN J H,ZHANG W,GUO L R.Evolution and phyloge-ny of Wolbachia: reproductive parasites of arthropods[J]. Pro-ceedings of the Royal Society-biological Sciences, 1995, 261(1360):55-63.
[3]13ALDOL,HOTOPP J C D,JOLLEY K A,et al.Multilocus se-quence typing system for the endosymbiont Wolbachia pipien-tis[J]. Applied and Environmental Microbiology, 2006, 72 (11):7098-7110
[4]SARIDAKI A.BOURTZI Sourtzis K.Wolbachia: more thanjust a bug in insects genitals[J]. Current Opinion in Microbi-ology, 2010, 13(1):67-72.
[5]ASUGUSTINO A A,SANTOS C D,DIONYSSOPOULOU E,etal.Detection and characterization of Wolbachia infections innatural populations of aphids: is the hidden diversity fully un-raveled[J]. PLoS ONE, 2011,6 (12):e28695.
[6]WERREN J H,WINDSOR D M.Wolbachia infection frequen-cies in insects: evidence of a global equilibrium[J]. Proceedingsof the Royal Society B:Biological Sciences, 2000, 267 (1450):1277-1285.
[7]杨筱慧,朱道弘,刘志伟.日本并腹客瘿蜂共生菌Wolbachia的多重感染[J].湖南师范大学自然科学学报(YANG Xiao-hui,ZHU Dao-hong, LIU Zhi-wei. Multiple infection of Wolbachiain Synergus Japonicus[J]. Journal of Natural Science of HunanNormal University), 2013, 36(3):75-78.
[8]BAND C,TREES A J,BRATTIG N W.Wolbachia in filarialnematodes: evolutionary aspects and implications for the path-ogenesis and treatment of filarial diseases[J]. Veterinary Parasitol-ogy, 2001, 98(1—3):215-238.
[9]O'NEILL S L,KARR T L.Bidirectional incompatibility be-tween conspecific populations of Drosophila .simulans[J]. Nature,1990, 348 (6297):178-180.
[10]STOUTHAMER R.LUCK R F,HAMILTON W D.Antibioticscause parthenogenetic Trichogramma (Hymenoptera/Trichog-rammatidae)to revert to sex[J].Proceedings of the National A—cademy of Sciences USA, 1990, 87 (7):2424-2427.
[11]BOUCHON D,RIGAUD T,JUCHAULT P.Evidence forwidespread Wolbachia infection in isopod crustaceans: molecu-lar identification and host feminisation[J]. Proceedings of the Roy-al. Society B: Biological Sciences, 1998, 265(1401):1081-1090.
[12]JIGGINS F M.HURST G D,SCHULENBURG J H,et al.Twomale-killing Wolbachia strains coexist within a population ofthe butterfly Acraea encedon[J]. Heredity, 2001, 86(2):161-166.
[13]DEDEINE F,VAVRE F,FLEURY F,et al.Removing symbi-otic Wolbachia bacteria specifically inhibits oogenesis in aparasitic wasp[J]. Proceedings of the National Academy of Sci-ences USA, 2001, 98 (11):6247-6252.
[14]VAVRE F,FLEURY F,VARALDl J, et al.Infection polymor-phism and cytoplasmic incompatibility in Hymen,optera-Wol-bachia associations[J]. Heredity, 2002, 88 (5):361-365.
[15]WRIGHT J D.The ultrastructure of the rickettsia-like mi-croorganism Wolbachia pipientis and associated virus-likebodies in the mosquito Culex pipiens[J]. Journal of UltrastructureResearch,1978, 63(1):79-85.
[16]MASUI S. Distribution and evolution of bacteriophage WO inWolbachia, the endosymbiont causing sexual alterations inarthropods[J].Journalof Molecular Evolution, 2000, 5l(5):491-497.
[17]BORDENSTEIN S R, WERNEGREEN J J. Bacteriophage fluxin endosymbionts(Wolbachia):infection frequency, lateral trans-fer, and recombination rates[J]. Molecular Biology and Evolution,2004, 21(10):1981-1991.
[18]CAVOTTE L. A survey of the bacteriophage WO in the en-dosymbiotic bacteria Wolbachia[J]. Molecular Biology and Evo-lution, 2007, 24(2):427-435.
[19]KLASSON L. The mosaic genome structure of the WolbachiawRi strain infecting Drosophila simulans[J]. Proceedings of theNational Academy of Sciences USA,2009,106(14):5725-5730.
[20]SANOGO Y 0, DOBSON, S L. WO bacteriophage transcrip-tion in Wolbachia-infected Culex pipiens[J]. Insect Biochemistryand Molecular Biology, 2006, 36 (1):80-85.
[21]FUJII Y. Isolation and characterization of the bacteriophageWO from Wolbachia, an arthropod endosymbiont[J]. Biochemi-cal and Biophysical Research Communications, 2004, 317(4):1183-1188.
[22]TANAKA K. Complete WO phage sequences revealed their dy-namic evolutionary trajectories and putative functional ele-ments required for integration into Wolbachia genome[J]. Appliedand Environmental Microbiology, 2009, 75(17):5676-5686.
[23]MARTIN Wu, LING V S, JESSICA V, et al. Phylogenomics ofthe reproductive parasite Wolbachia pipientis wMel: a stream-lined genome overrun by mohile genetic elements[J]. PLoS Biolo-gy, 2004, 2(3):327-341.
[24]LIUEBLAD J, RONQUIST F. A phylogenetic analysis of high-er-level gall wasp relationships (Hymenoptera: Cynipidae)[J].Systematic Entomology, 1998, 23 (3):229-252.
[25]RONQUIST F. Phylogeny, classification and evolution of theCynipoidea[J]. Zoologica Scripta, 1999a, 28 (1-2):139-164.
[26]PLANTARD O, RASPLUS J Y, MONDOR C, et, al. Distribu-tion and phylogeny of Wolbachia inducing thelytoky in Rhodi-tini and Aylacini (Hymenoptera: Cynipidae)[J]. Insect Molec-ular Biology, 1999, 8 (2):185-191.
[27]ABE Y, MIURA K. Does Wolbachia induce unisexuality in oakgall wasps (Hymenoptera: Cynipidae)[J]. Annals of The Ento-mological Society of America, 2002, 95 (5):583-586.
[28]ROKAS A, ATKINSON R J, NIEVES A J L, et al. The inci-dence and diversity of Wolbachia in gallwasps (Hymenoptera:Cynipidae) on oak[J]. Molecular Ecology, 2002, 11(9):1815-1829.
[29]ZHU D H, HE Y Y, FAN Y S, et al. Negative evidence ofparthenogenesis induction by Wolbachia in a gallwasp species,Dryocosmus kuriphilus(Hymenoptera: Cynipidae)[J]. Entomolo-gia Experimentalis Et Applicata, 2007, 124 (3):279-284.
[30]杨筱慧,朱道弘,刘志伟,等.湖南三地区麦氏安瘿蜂体内Wolbachia 的感染及其wsp基因序列分析[J].昆虫学报(YANGXiao-hui, ZHU Dao-hong, LIU Zhi-wei, et al. Sequencingand phylogenetic analysis of the wsp gene of Wolbachia inthree geographic populations of an oak gall wasp, Andricusmairei(Hymenoptera: Cynipidae), from Hunan, South China[J].Acta Entomologica Sinica), 2012, 55 (2):247-254.
[31]MORAN N A. Genomics and evolution of heritable bacterialsymbionts[J]. Annual Review of Genetics 2008, 42:165-190.
[32]WERNEGREEN J J. Genome evolution in bacterial endosym-bionts of insects[J]. Nature Reviews Genetics. 2002, 3:850-861.
[33]MORAN N A, PLAGUE G R. Genomic changes following hostrestriction in bacteria[J]. Current Opinion in Genetics & Devel-opment, 2004, 14 (6):627-633.
[34]BORDENSTEIN S R, REZNIKOFF W S. Mobile DNA in obli-gate intracellular bacteria[J]. Nature Reviews Microbiology, 2005,3 (9):688-699.
[35]GAVOTTE L, VAVRE F, HENRI H, et al. Diversity, distribu-tion and specificity of WO phage infection in Wolbachia offour insect species[J]. Insect Molecular Biology, 2004, 13(2):147-153.
[36]MASUI S, KAMODA S, SASAKI T, et al. Distribution andevolution of' bacteriophage WO in Wolbachia, the endosym-biont causing sexual alterations in Arthropods[J]. Journal of Mo-lecular Evolution, 2000, 51 (5):491-497.
[37]SINKINS S P, WALKER T, LYND A R, et al. Wolbachiavariability and host effects on crossing type in Culex mosquitoes[J]. Nature, 2005, 436(7048):257-260.
