一种在豌豆植物中瞬时表达外源蛋白的新方法
2014-04-29范亚军倪秀珍
范亚军 倪秀珍


摘要:以豌豆植物为实验材料建立了一种瞬时表达外源蛋白的新方法一发芽种子真空侵染法。以绿色荧光蛋白作为报告基因对该体系进行优化的结果表明其最佳工作条件为:菌体工作液浓度OD600=1.0~1.5,真空压力0.08MPa,真空侵染时间1min。该方法操作简单,可以同时侵染大量的豌豆植物材料,并将实验周期缩短为15d,植物侵染后12~14d可收获外源蛋白,外源蛋白表达量与叶片注射法相当,是一种在豌豆植物中批量生产外源蛋白的新方法。
关键词:豌豆;瞬时表达;发芽种子;真空侵染
中图分类号:Q819
文献标识码:A
文章编号:1007-7847(2014)03-0218-04
豌豆植物早褐病毒(pea early browning virus,PEBV)是一种寄生在豌豆植物体内的双链RNA病毒,其中一条RNA链负责编码病毒外壳及与线虫传播相关的蛋白,而另外一条RAN链编码的蛋白则与病毒的移动和复制有关。目前经过人工改造的豌豆早褐病毒载体是一种研究豆科植物基因功能及在豆科植物中瞬时表达外源蛋白的有效工具[1]。利用植物体瞬时表达外源重组蛋白是植物生物反应器的一个重要研究方向,该体系外源蛋白表达量高,实验周期短,而且具有相对操作简单的优势,但整体来看接种方式是影响该体系实验效率的一个关键因素[2~5]。传统的接种方式主要有摩擦接种法、叶片注射法和离体植物组织真空侵染法[4~12],其中摩擦接种法是将含有重组基因的载体在体外转录,并通过机械方式在植物叶片上制造伤口,然后以转录产物涂抹或喷洒于植物叶片上进行接种,该方法操作相对比较繁琐,实验费用较高[4]。目前常用的离体植物组织真空侵染法主要是利用真空压力对离体的植物组织如叶片等进行接种,此方法操作简单,但是在收获外源蛋白之前保持离体组织的新鲜度具有一定难度[5]。叶片注射接种法是在活体植物叶片上进行,要求植物具有2~3片展开的叶片,目前此种方法比较常用。利用叶片注射法已经成功在豌豆植物中表达了绿色荧光蛋白及其他重组蛋白[6,7],但是在实验操作中发现此种接种方式很难实现在植物中批量的生产外源重组蛋白,在此基础上本研究建立了一种高效地在豌豆中批量表达外源蛋白的新方法即发芽种子真空侵染法,并对此种新的实验体系进行了优化,实验结果表明发芽种子真空侵染法与叶片注射法外源蛋白的表达量相当,但是发芽种子真空侵染法缩短了实验周期,可以批量侵染实验材料,是一种产业化生产外源蛋白的新方法。
1材料和方法
1.1实验材料
1.1.1质粒、菌株、抗体及植物材料
农杆菌GV3101由本实验室保存,豌豆早褐病毒表达载体pCAPE2-GFP和pCAPEI由丹麦农科院惠赠,豌豆植物品种为矮秧豌豆(Pisumsativum L.)。绿色荧光蛋白抗体、Rubisco大亚基抗体由东北师范大学遗传所制备并提供。
1.1.2试剂
实验过程中所用抗生素利福平、卡那霉素、四环素及乙酰丁香酮均购自北京鼎国生物技术有限公司,DNA2000 Marker、蛋白质低分子质量Marker购自日本TakaRa公司,蛋白质杂交所用二抗为HRP标记的山羊抗兔IgG,购自北京中山生物技术有限公司。
用来鉴定豌豆早褐病毒载体pCAPE2-GFP的引物为:5'-CGGGATCCATGAGTAAAGGAGAAGAACTT-TT-3'5'-GGGGTACCTTATTTGTATAGTTCATCCATG-C-3'
用来鉴定pCAPEl载体的引物为:5'-CGTTAGATTGCGCTGTGG-3'5'-TGCCTTTGCTACGAACCT-3'
以上引物由上海生物工程有限公司合成。
实验过程中所用菌体重悬液各成分:100μmol/L乙酰丁香酮、10mmol/L NaCl、1.75 mmol/L CaCl、250μL Tween 20、pH5.6的无菌水溶液。蛋白质提取缓冲液各成分(1L):KC1 0.2g、NaCl 8g、KH2PO40.27g、Na2HPO4 1.42g、pH7.4。
1.2方法
1.2.1豌豆早褐病毒载体的鉴定
分别以豌豆早褐病毒载体pCAPE2-GFP和pCAPEl为模板进行PCR鉴定,PCR反应条件为94℃预变性3min; 94℃50s,50℃ 50s.72℃50s,33个循环;72℃ 8min。反应结束后进行琼脂糖凝胶电泳。
1.2.2菌种工作液及植物材料的处理
将豌豆早褐病毒载体分别转入农杆菌GV3101中,在含有卡那霉素(50mg/L)、利福平(50mg/L)和四环素(25mg/L)的液体LB培养基中常规培养,当OD600值为0.8~1.0时收集菌体并以菌体重悬液调节菌体工作液浓度,将含有两种载体的农杆菌按浓度比1:1混合后于室温静置90min备用。将豌豆种子在清水中浸泡4~5h,当种子吸水膨胀后置于28℃恒温培养箱中催芽培养,芽长为1~2cm的豌豆种子置于上述菌体工作液中进行真空侵染。
1.2.3豌豆发芽种子真空侵染体系的建立及优化
本研究选择真空处理时间、菌体工作液浓度及真空压力3个因子对该体系进行优化,实验过程中以绿色荧光蛋白(green fluorescent protein,GFP)表达率(表达绿色荧光蛋白的植株占总株数的比率)来评价该体系的工作效率,实验设置3次重复,每次处理种子数目不少于20粒,结果取平均值。
1.2.3.1真空压力对工作效率的影响
在菌体工作液浓度(OD00=1.0~1.5)和真空处理时间(1min)恒定的条件下选择真空压力分别为:0.02、0.04、0.06、0.08MPa对发芽的豌豆种子进行真空侵染,侵染后播种于土壤中,幼苗出土后紫外灯下跟踪绿色荧光蛋白的表达情况并记录。
1.2.3.2真空处理时间对工作效率的影响
在真空压力(0.08MPa)和菌体工作液浓度(OD00=1.0~1.5)恒定的条件下选择真空处理时间分别为:1、10、15min对豌豆种子进行真空侵染,侵染后播种于土壤中,幼苗出土后紫外灯下跟踪绿色荧光蛋白的表达情况并记录。
1.2.3.3菌体工作液浓度对工作效率的影响
在真空压力(0.08MPa)和真空处理时间(1min)恒定的条件下选择菌体工作液浓度分别为:OD600=0.3、0.6、0.9、1.2、1.5对豌豆种子进行真空侵染,侵染后播种于土壤中,幼苗出土后紫外灯下跟踪绿色荧光蛋白的表达情况并记录。
1.2.4发芽种子真空侵染法与叶片注射法的比较
选择相同的菌体工作液浓度,分别采用叶片注射法及发芽种子真空侵染法进行接种,紫外灯下跟踪观察GFP的表达情况并拍照记录。在外源蛋白表达高峰期分别收集可溶性总蛋白,15%聚丙烯酰胺凝胶进行电泳后转膜,并以Rubisco大亚基作为内参,以GFP抗体检测外源蛋白质的表达情况。
2.2实验结果
2.2.1豌豆早褐病毒载体的PCR鉴定结果
豌豆早褐病毒的两个载体同时接种植物才能完成正常的侵染工作,通过PCR法对pCAPE2-GFP载体上的GFP基因片段和pCAPEI上的特异片段进行鉴定,实验结果呈阳性,结果如图1所示。
2.2.2发芽种子真空侵染体系的优化
侵染后在紫外灯下跟踪观察GFP的表达情况(从CFP开始表达连续跟踪观察15d),虽然真空处理的时间不同,但是GFP的表达率及表达趋势基本一致,均是在真空侵染一周后(豌豆幼苗出土)绿色荧光蛋白开始表达,随后GFP表达率升高,在侵染后第12~14d时表达率能达到90%,结果如图2A所示。实验发现真空压力的大小是影响实验体系工作效率的重要因素,在侵染时间及工作液浓度一致的条件下,真空压力为0.02MPa时几乎没有植株表达绿色荧光蛋白,随着真空压力增大GFP表达率增高,在0.08MPa时GFP表达率最高,实验结果如图2B所示。
菌体工作液浓度是影响体系工作效率的另一个重要因素,实验结果表明GFP的表达率随着菌体工作液浓度的增大而升高,当菌体工作液浓度为OD600=0.9~1.5时有90%的豌豆植株表达绿色荧光蛋白,实验结果如图2C所示。
2.2.3发芽种子真空侵染法与叶片注射法的比较
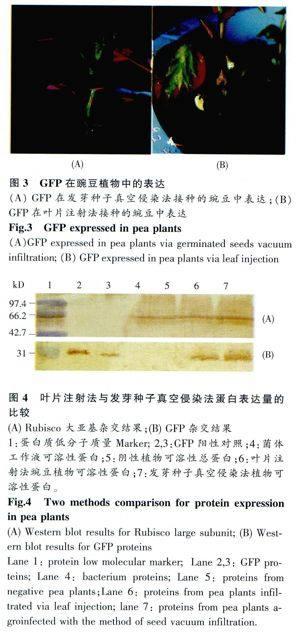
实验中以相同的菌体工作液分别采用了真空侵染法及叶片注射法进行接种,接种后跟踪观察GFP表达情况,两种方法均在接种后第8d开始表达绿色荧光蛋白,真空侵染法的植物材料出土后植物茎最先表达绿色荧光蛋白,随后出现在新生叶片的主脉和侧脉,在侵染后12~14d时GFP在叶肉中大量表达并扩散;叶片注射法的植物材料绿色荧光蛋白首先在注射的叶片中开始表达,随后扩散至邻近的主茎中并相继出现在邻近及新生叶片的主脉和侧脉,侵染后12~14d GFP在叶肉中大量表达,如图3所示。
12~15d时提取豌豆植物可溶性总蛋白,以Rubisco大亚基作为内参通过蛋白杂交法比较两种接种方法外源蛋白的表达量,实验结果如图4所示,Rubisco大亚基杂交结果表明各泳道(5~7)植物蛋白质上样量基本一致,GFP杂交结果表明两种接种方法外源蛋白的表达量相当。
3讨论
利用植物瞬时表达外源蛋白最主要的优势是操作简单、实验周期短及外源蛋白表达量高,目前已有的几种接种方式各有利弊,本研究以豌豆植物为实验材料建立了一种新的接种方式,菌体工作液浓度OD600=1.0~1.5时0.08MPa真空处理1min为该体系的最适条件,真空压力及菌体浓度是影响该实验体系的关键因素,当真空压力及菌体工作液浓度很低时几乎没有GFP表达,随着压力及工作液浓度升高GFP表达率增加,当真空压力为0.08Mpa,菌体工作液浓度为OD6oo=1.0~1.5时有90%以上的豌豆植株表达绿色荧光蛋白。该方法与常用的叶片注射法进行比较:叶片注射法在接种前需要豌豆植物具有2~3片完全展开的叶片(播种后2~3周),接种时需要逐株逐个叶片进行接种,而豌豆发芽种子真空侵染法直接以发芽的豌豆种子为材料进行侵染,可以在同一时间内批量地进行接种;叶片注射法获得外源蛋白的周期约为30d,而发芽种子真空接种法获得外源蛋白的实验周期约为15d;两种方法均是在侵染后12~14d外源蛋白表达量最高,蛋白质定量分析结果表明二者外源蛋白表达量相当,通过两种不同接种方式的比较我们认为发芽种子真空侵染法是一种可以批量在豌豆植物中快速表达外源蛋白的新方法。
参考文献(References):
[1]CONSTANIN G D,KRATH B N,MACFARLANE S A.et alVirus-induced gene silencing as a tool for functional genomicsin a legume species[J]. The Plant Journal, 2004, 40(4):622-631.
[2]RAMWSSAR K,SABALZA M,CAPELL T,et al.Maize plants:An ideal production platform for effective and safe molecularpharming[J]. Plant Science, 2008, 174(4):409-419.
[3]FISCHER R,STOGER E,SCHILLERC S,et al.Plant basedproduction of biopharrnaceuticals[J]. Current Opinion in PlantBiology, 2004, 7(2):152-158.
[4]DAWSON W O,BECK D L,KNORR D A.et al.cDNAcloning of the complete genome of tobacco mosaic virus andproduction of infectious transcripts[J]. Proceedings of the Na-tional Academy of Science of USA, 1986, 83(6):1832-1836.
[5]VALENTINE N,GALINA E,HYUNG-IL L,et al.Highly effi-cient transient expression of runctional recombinant antibodiesin lettuce[J]. Plant Science, 2005, 169(2):433-438.
[6]LIU J Y,MA P D,SUN Y,et al.Expression of human acidicfibroblast growth factor in Nicotiana benthamiana with a pote-to-virus-X-based binary vector[J]. Biotechnology and AppliedBiochemistry, 2007, 48(3):143-147.
[7]FAN Y J,LI W,ZHU X J,et al.Transient expression of fi—broblast growth factor in pea (Pisum sativum L)plants[J]. AfricanJournal of Biotechnology, 2012, 11(20):6060-6063.
[8]GREEN B J,FUJIKI M,METT V,et al.Transient protein ex-pression in three Pisum sativum (green pea) varieties[J].Biotech-nology Joumal, 2009,4(2):230-237.
[9]JIA H,PANG Y,FANG R.Agroinoculation as a simple way todeliver a tobacco mosaic virus-based expression vector[J].Ac-to Botanica Sinica, 2003, 45(7):770-773.
[10]11 Y,GENG Y F,SONG H H,et al.Expression of a humanlactoferrin N-lobe in Nicotiana henthmiana with potato virusX-based agroinfection[J]. Biotechnology letters, 2004, 26(12):953-957.
[11]FERRARO G,BECHER M L,ANGEL S O.et al.Efficientexpression of a Toxoplasma gondii dense granule Cra4 antigenin tobacco leaves[J]. Experimenlal Parasitology, 2008,120(1):118-122.
[12]LEUZINGER K,DENT M,HURTADO J,et al.Efficitent a—groinfiltration of planls for high-level transient expression ofrecombinant proteins[J].Journal of Visualized Experiments, 2013,23(77): dio:10.3791/50521.
