pIRES2—NGF—NT—3真核表达载体的构建与鉴定
2014-04-29栗炳南李卫东林俊堂丰慧根原志庆
栗炳南 李卫东 林俊堂 丰慧根 原志庆

摘要:构建双基因共表达载体pIRES2-NGF-NT-3并检测其在HEK293细胞中的表达。人神经生长因子(nerve growth factor, NGF)和神经营养素3(neurotrophin-3,NT-3)是采用直接PCR的方法从人外周血单个核细胞的基因组DNA中获取,将人神经生长因子的cDNA片段插入到pIRES2-EGFP多克隆位点构建成为pIRES2-NGF-EGFP神经营养素3cDNA片段通过替换绿色荧光蛋白基因(EGFP)的方式插入到pIRES2-NGF-EGFP中构建成为pIRES2-NGF-NT-3双基因共表达载体,将pIRES2-NGF-NT-3用脂质体转染HEK293细胞并采用RT-PCR与Western-blot的方法检测其表达。人神经生长因子和神经营养素3被克隆,通过测序和酶切鉴定的得知与基因库报道序列一致。pIRES2-NGF-NT-3转染HEK293细胞后双基因在mRNA和蛋白水平均得到了表达。人神经生长因子和神经营养素3双基因真核表达载体成功构建,它提供了一个新的表达系统,为进一步研究双基因的功能奠定了基础。
关键词:人神经生长因子;神经营养素3;真核双表达裁体;内部核糖体进入位点
中图分类号:Q812
文献标识码:A
文章编号:1007-7847(2014)04-0315-08
外伤性脊髓损伤发生率比较高,一般都会导致严重的神经系统损害。中枢神经系统损伤的恢复是相当困难的,因为受伤的中枢神经系统,其细胞与髓鞘再生以及重建功能性神经连接的能力有限。随着干细胞技术的发展,增加轴突再生的治疗策略之一——干细胞向受损脊髓部位的移植研究越来越广泛。
间充质干细胞(mesenchymal stem cells,MSCs)被认为是一个很好来源的干细胞,由于巨大的自我更新和多谱系分化潜能。使用间充质干细胞治疗缺血性脑损伤的动物实验中,其疗效已经得到证实。人类骨髓细胞在治疗血液病方面有着悠久的历史。此外,非造血干细胞,如骨髓间充质干细胞(MSCs),却可以分化成成熟的骨细胞、软骨细胞、脂肪细胞。研究发现,骨髓细胞(骨髓间充质干细胞)在特定的实验条件下可以诱导分化为成熟的神经元或神经胶质细胞。这些发现为骨髓间充质干细胞应用于神经性疾病患者的治疗增加了可能性,这也避免了使用胚胎干细胞而带来的伦理问题。
在组织工程研究中,采用基因修饰的方法来提高干细胞的增值和定向分化的能力一直是研究的热点领域。神经生长因子、神经营养因子-3脑源性神经营养因子或衍生的支架或在这些因素的基础上构建的表达载体在动物实验研究中得到了广泛的使用,并逐渐应用于临床研究。本研究旨在通过一种简单和有效的方法构建一个双基因的真核表达载体pIRES2-NGF-NT-3,为进一步研究NGF (nerve growth factor)与NT-3 (neu-rotrophin-3)这两个基因的协同功能奠定基础。
1材料与方法
1.1实验材料
pIRES2-EGFP购自北京天恩泽基因科技有限公司(中国);人外周血单个核细胞取自健康捐献者,已签署知情同意书;E.coli菌株DH5α、HEK293T细胞株为本实验室保存;T4 DNA连接酶、TaqDNA聚合酶、Xho I、BamH I、Not I、BstX I限制性内切酶、总RNA的提取试剂盒、逆转录试剂盒、高纯度凝胶提取试剂盒、DNA marker均购自购自宝生物工程大连有限公司(中国);Tri-zol Reagent和转染试剂脂质体2000购自Invitro-gen公司(美国);DMEM培养基与新生牛血清、胰蛋白酶为购自Gibco公司(美国);质粒小提试剂盒购自Sangon公司(中国);NGF与NT-3抗体一抗购Santa Cruz公司(美国);引物由上海生物工程技术服务有限公司合成(中国)。
1.2引物的设计与合成
NGF(NM_002506.2)和NT-3(NM_0011026-54.1)在基因库中的基因序列用来作为模板设计引物(见表1)。人神经生长因子(NGF基因片段的核心编码序列完全的基因组DNA的外显子3上。两条特异性的引物被设计用于从外显子3上扩增出人神经生长因子。Xho I限制性内切酶切割位点和保护性碱基添加在上游引物,在下游引物中加入BamH I限制性内切酶切割位点和保护性碱基,扩增片段长度为726bp。接着设计了两对引物来扩增人类神经营养因子3。长的正向引物在5'末端比短的正向引物多出来4个碱基。与此类似,反向长引物序列比反向短引物序列也多出来4个碱基,我们通过双PCR的方法在正向引物序列中引入了BstX I粘性末端一部分,而在反向引物序列中引入了Not I粘性末端一部分,这将用于组装BstX I位和Not I粘性末端,扩增片段长度为774bp。
1.3 pIRES2-NGF-EGFP表达载体的构建
人外周血单核细胞的基因组DNA为模板,采用神经生长因子特异性引物用于扩增NGF基因。人神经生长因子基因片段的核心编码序列是完全位于基因组DNA的第3个外显子上。采用20μL PCR反应体系,包括基因组DNAO.5μL(10ng), 2xPrimeSTARMaxDNAPolymerase 10μL,无RNase水7.5μL,上游引物和下游引物各1μL。反应条件为:95℃ 5min,98℃ 10s,55℃,5s,72℃ 50s,30循环,最后,72℃,保持5min。用PCR纯化试剂盒纯化PCR产物,然后将PCR产物和pIRES2-EGFP质粒用Xho I和BamH I限制性内切酶双酶切。酶切后的PCR产物用PCR纯化试剂盒纯化。通过T4 DNA连接酶将该DNA片段插入到质粒中。连接体系为20μL,包括质粒pIRES2-EGFP 2μL,cDNA(神经生长因子)8μL,T4 DNA连接酶0.2μL,其余添加灭菌水至20μL。在22℃水浴中连接30min。将连接后的片段转化入DH5α中,然后平铺入含有卡那抗性的LB培养板中37℃培养16h。第二天挑取阳性菌落进行接种,在37℃、225r/min摇床中进行培养12~16h,然后提取质粒后酶切鉴定,即可得到重组pIRES2-NGF-EGFP质粒。
1.4pIRES2/NGF-NT-3双基因表达载体构建
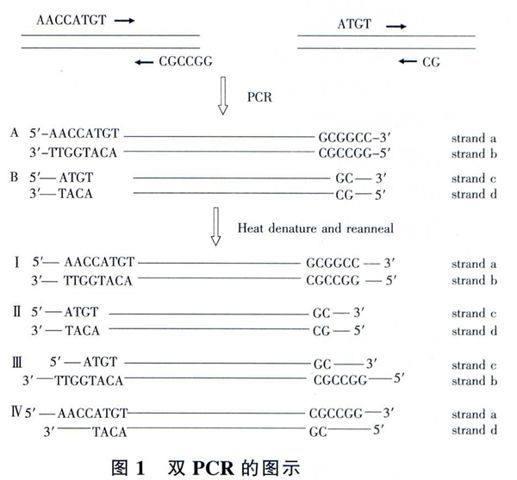
我们应用一种简单而有效的方法将未经双酶切的PCR扩增产物定向克隆入目的质粒中。我们针对一个基因设计了两对特异性的引物,该两对引物均含有限制性内切酶的部分序列,这两对引物分别用来做孪生PCR。即首先产生的PCR产物混合,经热变性和退火,以产生杂交的DNA片段,由此产生与特定内切酶相对应的粘性末端。这个方法在某些情况下是特别有用的,例如在克隆构建时必须要用到一种限制酶,但不巧的是这种限制酶切位点正好位于要扩增的序列内部,或者当PCR产物末端的限制性内切酶的敏感性不高而引起的某些问题,都可以采用这种方法。
我们采用长正向引物/长反向引物或者短正向引物/短反向引物两种引物对,以人的外周血单个核细胞基因组DNA为模板进行孪生PCR反应(图1)。两种反应体系的反应条件如下:94℃,30s;54℃,30s:72℃,1min,共30个循环,随后由72℃,5min进行延伸。PCR反应采用的聚合酶为Prime STAR Max DNA Polymerase。预期的4种PCR产物采用DNA凝胶提取试剂盒量来进行纯化,并用分光光度计来进行定量。
将质粒pIRES2-NGF—EGFP经BstX I与Not I双酶切,然后进行电泳后凝胶回收线性化载体片段,与此同时,将每一种类型的经由高保真酶扩增获取的NT-3 PCR产物混合后,94℃热变性4min,65℃退火2min。连接反应如下:即将退火后形成的NT-3 PCR产物与线性化后pIRES2-NGF-EGFP(按照摩尔比为4:1)混合后在T4连接酶的作用下,16℃连接时间为3h。将连接产物经由标准的氯化钙转化方法转化入DH5α,抗性筛选出重组体,培养扩增后进行质粒的提取后双酶切(BstX I与Not I)初步鉴定和DNA测序。
首先需要进行两个平行的PCR反应,一个反应采用的是长正向引物与长反向引物,另一个采用的是短正向引物与短反向引物。产生的PCR产物即PCR产物A(I)与B(Ⅱ),两者唯一不同的地方如图所示在于PCR产物两最末端的序列不同。接着将两种PCR产物即等摩尔的PCR产物A(I)与B(Ⅱ)混合后经热变性与退火,两种双链DNA分子解链后随机互补配对生成4种类型的PCR产物。其中PCR产物A(I)和B(Ⅱ)两端为平端序列与原始序列相同,PCR产物Ⅲ和Ⅳ两端为粘性末端序列,其中只有PCR产物Ⅲ两末端含有正确的酶切位点序列即5'BstX I酶切序列和3'Not I酶切序列。PCR产物Ⅲ可以直接插入到经BstX I和Not I。双酶切线性化后的质粒载体pIRES2-NGF-EGFP中。
1.5体外转染HEK293细胞
采用含有10%新生牛血清与100μg/mL青霉素/链霉素的DMEM培养基中培养HEK293细胞,细胞培养条件为37℃与CO2浓度为5%。细胞活力的测定采用台酚蓝的方法并且在所有的实验中活力均在95%以上,细胞以5x105/孔的数量接种入6孔板中,培养24h后达到60%~80%融合。然后我们将各孔HEK293细胞划分为4个组,即空白对照组、pIRES2-EGFP转染组、pIRES2-NGF/EGFP转染组、pIRES2-NGF/NT-3转染组,质粒转染均采用(LipofectamineTM 2000)脂质体转染法,每孔加入质粒的量为5μg,在37℃条件下孵育2h。然后去除含有转染液的上清,添加新鲜的含血清培养基,转染72h后,确保倒置荧光显微镜观察pIRES2-EGFP转染组与pIRES2-NGF/EGFP,转染组的转染效率大于80%,然后收集各处理组上清液用于Western-blot检测目的蛋白的表达,收集细胞裂解后用于RT-PCR检测目的基因mRNA水平的表达。
每份收集的细胞加入1mL TRIZOL试剂反复吹打,提取细胞总RNA,按照说明书的步骤将提取的1μg总RNA反转录成cDNA。取2μL反转录的cDNA采用基因特异性引物(见表2)进行PCR扩增,并采用β-actin做内参,反应条件为94℃预变性5min; 94℃ 30s、55℃ 30s、72℃ 30s,进行35个循环;72℃ 10min延伸。取5μL PCR扩增产物加入1μL Loading buffer,100V电压下在2%的琼脂糖凝胶中电泳。采用凝胶分析系统拍摄,并对各条带的灰度值进行分析。
为了检测各处理组HEK293细胞中NGF与NT-3蛋白水平的表达,脂质体转染72h后,我们采用Western-blot的方法检测基因的表达。方法如下:即提取各处理组的HEK293细胞上清液,经BCA法检测蛋白浓度后行8%十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后,电转移至PVDF膜浸入含5%脱脂奶粉的TBST中,37℃慢摇lh(85r/min),一抗4℃过夜、二抗37℃孵育lh,加入凯基超敏型ECL检测液进行发光,在暗室中经压片、显影、定影。条带的灰度我们采用Gel-Pro analyzer软件进行分析。
1.6统计分析
采用SPSS 13.0统计软件对数据进行统计学处理,数据用x±s表示,组间数据的差异比较采用单因素方差分析法,P<0.05为差异有显著性意义。
2结果与分析
2.1 NGF与NT-3基因的扩增
从人外周血单核细胞的基因组DNA通过PCR获得NGF和NT-3基因,NGF基因的大小为726bp,NT-3基因的大小为774bp(图2A)。
2.2pIRES2-NGF-EGFP质粒的鉴定
质粒载体pIRES2-NGF-EGFP被Xho I和BamH I双酶切后进行凝胶电泳,结果在726bp处出现一条目的条带,与NGF基因大小完全一致(图3)。
2.3pIRES2-NGF-NT-3双基因表达质粒的鉴定
质粒载体pIRES2-NGF-NT-3被Xho I和BamH I双酶切后进行凝胶电泳,结果在约726bp处出现一条目的条带,与NGF基因大小完全一致;质粒载体pIRES2-NGF-NT一3被Xho I和Not I双酶切后,结果在约2106bp出现一条目的条带与NGF-IRES-NT-3基因片段序列一致;质粒载体pIRES2-NGF-NT-3被BamH I和Not I双酶切后,结果在约l374bp出现一条目的条带大小与IRES-NT-3基因片段一致。载体pIRES2一NGF-NT-3经DNA测序后可知NGF与NT-3与基因库中的序列顺序完伞一致(图4)。
2.4RT-PCR检测NGF与NT-3的表达
采用RT-PCR方法检测各处理组HEK293细胞中NGF与NT-3的mRNA表达,检测采用NGF与NT-3特异性引物进行PCR反应,并以β一肌动蛋白作为表达的内参,采用倒置荧光显微镜观察pIRES2-EGFP与pIRES2-NGF/EGFP转染组的绿色荧光表达量约80%以上。提取总RNA逆转录采用基因特异性引物进行PCR扩增,电泳跑胶后利用光密度扫描软件进行表达量分析。结果显示:NGF基因在pIRES2-NGF/EGFP与pIRES2-NGF/NT-3转染组表达量明显高于pIRES2-EGFP转染组与空白对照组(图5)。与上述方法相似,结果显示NT-3基因在pIRES2-NGF/NT-3转染组的表达量明显高于其他3组(图6)。结果显示NGF与NT-3基因成功导入了HEK293细胞中并且得到了表达。
2.5Western-blot检测NGF与NT-3的表达
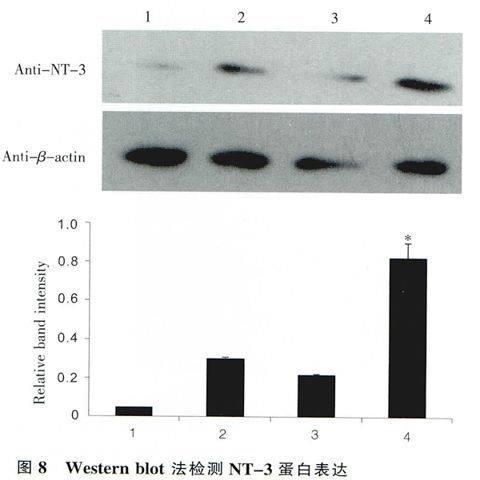
采用Western-blot方法检测各处理组HEK293细胞中NGF与NT-3的蛋白水平的表达,以β-肌动蛋白一抗作为目的蛋白表达的内参,即提取各处理组的HEK293细胞上清液,经BCA法检测蛋白浓度后行SDS-PAGE电泳分离后,电转、抗体孵育,在暗室中经压片、显影、定影。条带的灰度我们采用Gel-Pro analyzer软件进行分析。采用倒置荧光显微镜观察pIRES2-EGFP与pIRES2-NGF/EGFP转染组的绿色荧光表达约80%以上结果显示:NGF蛋白在pIRES2-NGF/EGFP与pIRES2-NGF/NT一3转染组表达量明显高于pIRES2-EGFP转染组与空白对照组(图7)。与上述方法相似,结果显示NT-3蛋白在pIRES2-NGF/NT-3转染组的表达量明显高于其他3组(图8);NGF与NT-3基因成功导人了HEK293细胞中并且在蛋白质水平得到了表达。
3讨论
为了提高克隆的效率简化克隆流程,我们采用孪生PCR的方法获取插入的目的基因片段,该插入片段含有由一条单链的突出端形成的末端结构,该末端结构与酶切后的载体质粒末端产生互补结构。如图l所示,PCR产物通过热变性和退火的互补配对的方式进行组装,最后产生了4种类型数量相等的分子片段。其中两个为平端结构,两个为粘性末端结构。理论上来讲,含有粘性末端结构分子片段数量的一半可以用来适合某种连接反应。采用孪生PCR策略,仅仅通过引物设计和PCR扩增的方法即可使得杂交后的PCR产物可以形成各种各样的粘性末端结构与几乎所有的酶切后断端片段发生互补。因为该PCR产物作为插入片段无需进行酶切反应,所以其可以克服由于限制性内切酶的敏感性而带来的一系列问题。扩增产生的插入片段内部的酶切位点也不会限制克隆位点的选择,这尤其适合于长PCR片段的克隆,因为克隆插入的片段越长,内部含有的限制性酶切位点的数量和可能性就越多。
此实验将NT-3片段通过长短PCR产物退火的方法产生BstX I与Not I两个酶切位点,并定向插入到质粒载体pIRES2-NGF-EGFP中。这种克隆方法经济省时有效。此外我们在克隆过程中采用了高保真DNA聚合酶,保证了我们扩增片段的精确性,这些优势使得孪生PCR技术广泛地应用于PCR产物的定向克隆当中。在众多的神经营养因子(neurotrophic factors, NTFs)中,NGF是最受关注和重视的一种,它是一种兼有神经元营养和促进突起生长双重生物学功能的细胞生长调节因子,对中枢和周围神经元的发育、分化、生长、再生和功能特性表达均具有重要调控作用。研究证实NGF对周围神经再生有密切关系,并起着重要作用。
在周围神经切断处局部给予外源性NGF经4-6h可逆行运输到背根神经节胞体,通过影响背根神经节细胞的新陈代谢,并将这一影响转换成别的信息传到脊髓联络神经元,引起脊髓神经生理和功能上的变化。NGF是具有调节神经修复的活性分子。NGF属于一种多聚体,主要包括α、β、γ3种亚型,其中β亚基上含有NGF的所有生物学活性。1)NGF能够在神经系统的发育期对神经细胞的成熟以及存活产生促进作用,也可有效控制神经元存活数量;2)NGF在神经系统的发育成熟期会将作用由调节神经元的存活转移至对神经元的表现以及功能方面,可以使感觉神经元以及中枢神经元的功能得到维持;3)NGF可以对神经纤维的定向生长进行有效的促进,而且会使神经纤维再生得到加速,有效促进了雪旺氏细胞、胶质细胞的生长,促进髓鞘的修复,对轴突、树突的发育产生积极的诱导,从而使神经元的有丝分裂、分化、修复得到促进,能够有效降低神经细胞死亡率,避免受损神经元遭到继续损害,对神经元的存活产生了促进作用。
神经营养因子是能支持神经元存活,促进其生长、分化及维持其功能的一类因子。NT-3是在1990年利用NGF与BDNF序列同源性被发现的NTF,NT-3与NGF、BDNF一样出现在胚胎神经系统发生的时候。脊髓损伤后NT-3的表达与损伤前相比均有所提高,说明受损脊髓对NT-3内源性需求增加。NT-3是在脊髓中作用最强神经营养因子,它可以明显促进皮质脊髓束的再生和神经元的存活、迁移与轴突生长。体外研究表明,NT-3可维持交感、感觉、基底前脑胆碱能和运动神经元的存活,能在体外上调胆碱能神经元乙酰胆碱转移酶的表达,支持中脑多巴胺能神经元分化,以及促进发育和损伤的CST侧枝出芽。由于NT-3不能透过血脑屏障,只能局部给药,而在损伤局部持续给药必须通过反复室管膜内注射或借助于侵袭性微管装置,实际应用极不方便。研究证明,通过转基因技术,可使含有神经营养作用基因的细胞不断分泌所需营养因子,促使神经再生和功能恢复。
本组实验利用真核表达载体共表达神经生长因子和神经营养素3转染HEK293细胞,结果显示HEK293细胞能高效表达神经生长因子和神经营养素3,为利用细胞作为载体传送神经生长因子和神经营养素3至脊髓损伤部位提供依据。此外,本组实验还具有以下特点:1)在同一个真核表达载体里编码两个基因,利用内部核酸进入位点(IRES)序列,将神经生长因子和神经营养素3两个基因连接,受一个启动子CMV调控后,两个基因均获得有效表达。尽管IRES是一种常用的双基因表达载体的构成元件,但在不同的体系下,IRES连接的两个基因的表达水平并不完全一致,常常是靠近启动子的基因表达水平高,而IRES下游的基因表达水平较低,甚至不能有效地表达。而本组实验中证实用IRES连接神经生长因子和神经营养素3均能获得高效的表达;2)以神经生长因子和神经营养素3和人间充质干细胞以及真核表达载体作为研究对象,可能更有利于脊髓损伤后的神经再生与重建,更利于研究结果向临床应用转化,首先在体外感染细胞载体的方法避免了真核表达载体直接体内注射所带来的安全隐患以及异源性基因直接导入所产生的伦理学问题。在脊髓损伤修复的研究中,细胞承担着两种角色:靶细胞或者载体细胞。靶细胞是通过细胞替代再生组织,重建神经通路起作用。载体细胞是被作为基因表达或者治疗性因子释放的媒介,促进神经工程恢复起作用。综合目前的研究,间充质干细胞具备作为靶细胞和载体细胞的特点,非常适合于基因治疗脊髓损伤的研究。目前用于基因治疗的常用载体有病毒类载体与非病毒类载体两大类。虽然病毒类载体有转染效率高,表达稳定等特点,但容易整合到靶细胞的染色体内,因此安全性差,需谨慎使用;非病毒载体主要为各种质粒,进入靶细胞后以附加体的形式存在,具有安全性好,容量大的优点。
本实验采用pIRES2-EGFP真核表达载体,通过基因重组的方法成功构建出神经生长因子和神经营养素3真核表达载体,并且证明这两个基因能在HEK293细胞中共表达。查阅国内外文献,目前尚无利用神经生长因子和神经营养素3促进间充质干细胞分化修复脊髓损伤的基因治疗研究,我们计划在下一步的实验研究中,将该双基因表达的质粒pIRES2-NGF-NT-3转染入间充质干细胞中,并获取稳定转染细胞系。我们推测双基因修饰的间充质干细胞在促进神经元再生方面相对于单基因而言可能效果会更加显著。
